1 . 现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为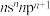 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的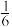 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能___________ (填“<”“>”或“=”)B元素的第一电离能, A、B、C三种元素的电负性由小到大的顺序为___________ (用元素符号表示)。
(2)D元素原子的价电子排布式是___________ 。
(3)C元素的电子排布图为___________ ;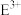 的离子符号为
的离子符号为___________ 。
(4)F元素位于元素周期表的___________ 区,其基态原子的电子排布式为___________ 。
(5)G元素可能的性质___________。
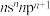 ;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的
;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的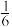 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。(1)A元素的第一电离能
(2)D元素原子的价电子排布式是
(3)C元素的电子排布图为
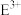 的离子符号为
的离子符号为(4)F元素位于元素周期表的
(5)G元素可能的性质___________。
| A.其单质可作为半导体材料 | B.其电负性大于磷 |
| C.其原子半径大于锗 | D.其第一电离能小于硒 |
您最近半年使用:0次
2 . 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其中A是宇宙中含量最多的元素;B元素原子最高能级的不同轨道都有电子,并且自旋方向相同;C元素原子的价层电子排布是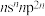 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:___________ 。
②B、C、D、E 4种元素的第一电离能由大到小顺序为:___________ 。
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是___________ 。
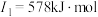
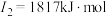
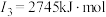
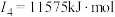
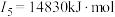
(3)F在周期表中的位置___________ ,位于周期表的___________ 区。
(4)BA3是一种很好的配体,BA3的沸点___________ (填“>”“=”或“<”)AsA3。
(5)B原子核外有___________ 种不同运动状态的电子;基态B原子中,能量最高的电子所占据的原子轨道的形状为___________ ;F原子核外电子占据的最高能层的符号是___________ 。
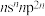 ;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。
;D元素原子中只有两种形状的电子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其最外层电子数等于其能层数。F元素原子的最外层只有一个电子,其次外层内的所有轨道的电子均成对。(1)请用元素符号完成下列空白:
①A、B、C三种元素的电负性由大到小顺序为:
②B、C、D、E 4种元素的第一电离能由大到小顺序为:
(2)下面是A~F元素中某种元素的部分电离能,由此可判断该元素是
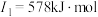
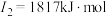
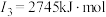
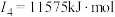
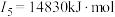
(3)F在周期表中的位置
(4)BA3是一种很好的配体,BA3的沸点
(5)B原子核外有
您最近半年使用:0次
名校
3 . 当汽车遭受一定碰撞力量以后,安全气囊中的物质会发生剧烈的反应: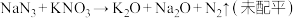 ,生成大量气体。下列说法正确的是
,生成大量气体。下列说法正确的是
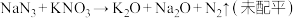 ,生成大量气体。下列说法正确的是
,生成大量气体。下列说法正确的是A.半径大小: | B.电负性大小: |
C.第一电离能大小: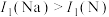 | D.金属性强弱: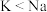 |
您最近半年使用:0次
解题方法
4 . 三草酸合铁酸钾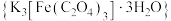 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: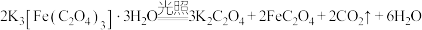 。回答下列问题:
。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为___________ ,基态 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为___________ 。
(2)三草酸合铁酸钾所含元素中,第一电离能最大的是___________ (填元素符号,下同),电负性最大的是___________ 。
(3)1个 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为___________ , 分子的立体构型为
分子的立体构型为___________ 。
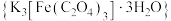 是制备铁触媒上的主要原料。在光照下分解:
是制备铁触媒上的主要原料。在光照下分解: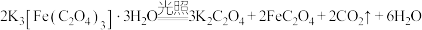 。回答下列问题:
。回答下列问题:(1)基态
 原子的电子排布式为
原子的电子排布式为 与
与 中未成对电子的数目之比为
中未成对电子的数目之比为(2)三草酸合铁酸钾所含元素中,第一电离能最大的是
(3)1个
 与1个
与1个 分子中
分子中 键数目之比为
键数目之比为 分子的立体构型为
分子的立体构型为
您最近半年使用:0次
名校
5 . 我国科学家在实验室中成功地实现了“空气变馒头”的壮举:化学总反应可表示为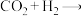

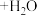 (未配平),下列说法错误的是
(未配平),下列说法错误的是
A.从电子云重叠方式角度看, 中存在两类共价键 中存在两类共价键 |
| B.从共用电子对是否发生偏移角度看,Starch中存在两类共价键 |
| C.键的极性:H—O>C—O |
| D.键长:C=C>C—C |
您最近半年使用:0次
解题方法
6 . 近年来,我国半导体材料市场发展迅速,其中以氮化嫁、碳化硅、氧化锌、金刚石等为主的材料备受关注。回答下列问题:
(1)基态Ga原子的价电子轨道表示式为___________ ,基态N原子核外电子有___________ 种空间运动状态。Zn在元素周期表中位于___________ 区。
(2)C,N、O的第一电离能由大到小的顺序为___________ 。 的空间结构为
的空间结构为___________ 。
(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为( ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为___________ ,C和Si原子的最短距离为___________ pm。
①GaN晶体中N原子的杂化轨道类型为___________ 。
②GaN晶体的密度为___________ g/cm3(列出计算式,用含b、c、NA的代数式表示)。
(1)基态Ga原子的价电子轨道表示式为
(2)C,N、O的第一电离能由大到小的顺序为
 的空间结构为
的空间结构为(3)SiC的立方晶胞结构如图1所示,已知;1号C原子的坐标参数为(
 ,
, ,
, ),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
),晶胞参数为apm。则晶胞中2号C原子的坐标参数为
①GaN晶体中N原子的杂化轨道类型为
②GaN晶体的密度为
您最近半年使用:0次
名校
解题方法
7 . 双氰胺( )为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮
)为白色晶体,在冷水中溶解度较小,溶于热水、乙醇,其水溶液在80℃以上会发生分解等副反应,主要用于生产树脂、涂料、含氮复合肥等。实验室以石灰氮 为原料制备双氰胺的流程如下:
为原料制备双氰胺的流程如下:
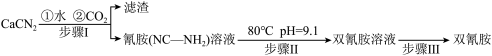
已知氰胺二聚反应机理为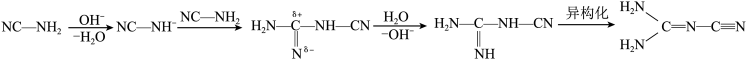
(1)已知:氰基是吸电子基团。氰氨
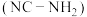 的碱性
的碱性(2)写出步骤Ⅰ的化学反应方程式:
(3)步骤Ⅱ中调节溶液pH为9.1,pH不能过低的原因:
(4)步骤Ⅲ中蒸发浓缩时,常采用真空蒸发浓缩,目的是
(5)凯氏定氮法是测定有机物中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐。
已知:
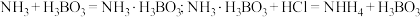

②仪器清洗后,g中加入硼酸
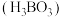 和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭
和指示剂。铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭 ,d中保留少量水。打开
,d中保留少量水。打开 ,加热b,使水蒸气进入e。
,加热b,使水蒸气进入e。d中保留少量水的目的是
③取双氰胺样品m克进行测定,滴定g中吸收液时消耗浓度为
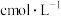 的盐酸VmL,则样品中氮的质量分数为
的盐酸VmL,则样品中氮的质量分数为
您最近半年使用:0次
名校
解题方法
8 . 过渡金属元素及其化合物的应用广泛,是科学家们进行前沿研究的方向之一、
(1)基态N原子核外能量最高的能级的电子云有___________ 种不同的伸展方向。
(2)锌化铜是一种金属互化物,元素铜的第二电离能大于锌的第二电离能的理由是___________ 。
(3)已知苯酚(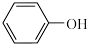 )具有弱酸性,其
)具有弱酸性,其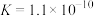 水杨酸第一步电离形成的离子
水杨酸第一步电离形成的离子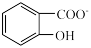 能形成分子内氢键,据此判断,相同温度下电离平衡常数
能形成分子内氢键,据此判断,相同温度下电离平衡常数 (水杨酸)
(水杨酸)___________ K(苯酚)(填“>”或“<”),其原因是___________ 。
(4)下列几种有机羧酸中,按酸性由强到弱的顺序排顺序为___________ (填序号)。
①乙酸( )②氯乙酸(
)②氯乙酸(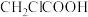 )③三氯乙酸(
)③三氯乙酸(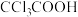 )④三氟乙酸(
)④三氟乙酸( )
)
(5)键角大小比较(填“>”“<”或“=”):①
___________  ②
②
___________  ③
③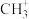
___________ 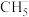 ④
④
___________ 
(6)利用 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成砖红色的
悬浊液检验醛基时,生成砖红色的 ,其晶胞结构如图所示。
,其晶胞结构如图所示。 ,C为
,C为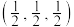 ,则D原子分数坐标为
,则D原子分数坐标为___________ 。
②若 晶体密度为d g⋅cm
晶体密度为d g⋅cm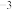 ,晶胞参数为a pm,则阿伏加德罗常数的值
,晶胞参数为a pm,则阿伏加德罗常数的值 为
为___________ (用含d和a的式子表示)。
(1)基态N原子核外能量最高的能级的电子云有
(2)锌化铜是一种金属互化物,元素铜的第二电离能大于锌的第二电离能的理由是
(3)已知苯酚(
 )具有弱酸性,其
)具有弱酸性,其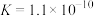 水杨酸第一步电离形成的离子
水杨酸第一步电离形成的离子 能形成分子内氢键,据此判断,相同温度下电离平衡常数
能形成分子内氢键,据此判断,相同温度下电离平衡常数 (水杨酸)
(水杨酸)(4)下列几种有机羧酸中,按酸性由强到弱的顺序排顺序为
①乙酸(
 )②氯乙酸(
)②氯乙酸(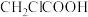 )③三氯乙酸(
)③三氯乙酸(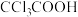 )④三氟乙酸(
)④三氟乙酸( )
)(5)键角大小比较(填“>”“<”或“=”):①

 ②
②
 ③
③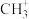
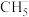 ④
④

(6)利用
 和NaOH制备的
和NaOH制备的 悬浊液检验醛基时,生成砖红色的
悬浊液检验醛基时,生成砖红色的 ,其晶胞结构如图所示。
,其晶胞结构如图所示。
 ,C为
,C为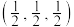 ,则D原子分数坐标为
,则D原子分数坐标为②若
 晶体密度为d g⋅cm
晶体密度为d g⋅cm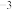 ,晶胞参数为a pm,则阿伏加德罗常数的值
,晶胞参数为a pm,则阿伏加德罗常数的值 为
为
您最近半年使用:0次
名校
9 . 下列对有关事实的解释错误的是
| 选项事实 | 解释 | |
| A | 酸性:CF3COOH>CH3COOH | F电负性更大使羟基极性变强 |
| B | 金刚石的熔点高于单晶硅 | 金刚石的C-C比单晶硅的Si-Si键能大 |
| C | 稳定性:H2O>H2S | H-O键的键能比H-S键的键能大 |
| D | SiO2的熔点比干冰高 | SiO2比CO2相对分子质量大,分子间作用力大 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
10 . 一种工业洗涤剂中间体的结构如图,其中 、
、 、
、 、
、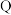 、
、 原子序数依次增大且分属三个短周期。
原子序数依次增大且分属三个短周期。 、
、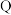 元素的基态原子中均有两个未成对电子,下列说法正确的是
元素的基态原子中均有两个未成对电子,下列说法正确的是
 、
、 、
、 、
、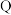 、
、 原子序数依次增大且分属三个短周期。
原子序数依次增大且分属三个短周期。 、
、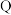 元素的基态原子中均有两个未成对电子,下列说法正确的是
元素的基态原子中均有两个未成对电子,下列说法正确的是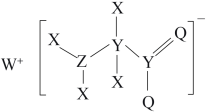
A.电负性大小: |
B.简单离子半径: |
C.简单氢化物的沸点: |
D.阴离子中各原子都满足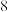 电子稳定结构 电子稳定结构 |
您最近半年使用:0次



