1 . 锂离子电池能够成为产业发展方向,主要基于其拥有较高的能量重量比和能量体积比等多项特性,正极材料为钴酸锂、锰酸锂和磷酸亚铁锂材料等。
(1)工业上用 、
、 、LiCl及苯胺(
、LiCl及苯胺(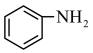 )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为_______ ,其在元素周期表中的位置为_______ ,O、N、P的电负性由大到小的顺序为_______ 。
(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。
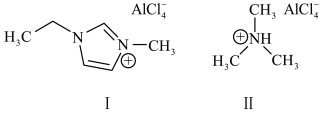
化合物Ⅰ中碳原子的杂化轨道类型为_______ ,1mol化合物Ⅰ中含有_______ 个σ键;化合物Ⅱ中阳离子的空间构型为_______ 。传统的有机溶剂大多易挥发,而离子液体有相对难挥发的优点,原因是_______ 。
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。
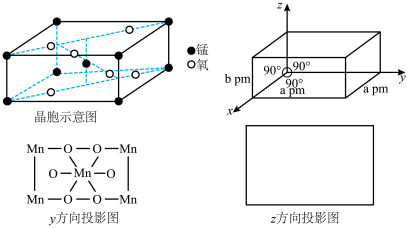
该锰的氧化物中Mn的化合价为_______ ,请画出z方向投影图_______ 。
(1)工业上用
 、
、 、LiCl及苯胺(
、LiCl及苯胺( )为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为
)为原料制备磷酸亚铁锂。基态Cl原子价电子的轨道表示式为(2)锂离子电池可采用离子液体作为电解质,以下为2种离子液体的结构。

化合物Ⅰ中碳原子的杂化轨道类型为
(3)实验室可利用硝酸锰受热分解的方式制备锰的一种氧化物(晶胞结构如图所示)。

该锰的氧化物中Mn的化合价为
您最近一年使用:0次
名校
解题方法
2 . 常见的锂离子聚合物电池材料有石墨、LiCl、LiAsF6、LiPF6等。回答下列问题:
(1)Li、O、P、As四种元素电负性由大到小的顺序为___ (填元素符号);H2O、PH3的沸点关系为H2O___ (填“>”、“<”或“=”,下同)PH3;PH3、AsH3的键角大小关系为PH3___ AsH3。
(2)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成如图所示的稳定结构W。基态碳原子的价电子轨道表示式为___ 。W中Li+与孤对电子之间的作用属于___ (填标号)。
A.离子键 B.金属键 C.氢键 D.配位键
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是___ 。
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺(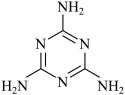 )制得。三聚氰胺分子中环上的氮原子杂化类型是
)制得。三聚氰胺分子中环上的氮原子杂化类型是___ ;三聚氰胺分子不溶于冷水,溶于热水,主要原因是___ 。
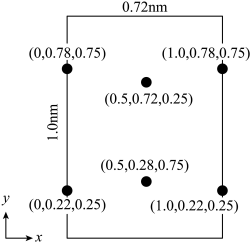
(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子坐标。据此推断该晶胞中Cl原子的数目为___ 。LiCl·3H2O的摩尔质量为Mg·mol-1,设NA为阿伏加德罗常数的值,则LiCl·3H2O晶体的密度为___ g·cm-3(列出计算表达式,不必化简)。
(1)Li、O、P、As四种元素电负性由大到小的顺序为
(2)冠醚是由多个二元醇分子之间失水形成的环状化合物。X、Y、Z是常见的三种冠醚,其结构如图所示。它们能与碱金属离子作用,并且随着环的大小不同而与不同金属离子作用。

①Li+与X的空腔大小相近,恰好能进入到X的环内,且与氧原子的一对孤电子对作用形成如图所示的稳定结构W。基态碳原子的价电子轨道表示式为
A.离子键 B.金属键 C.氢键 D.配位键
②冠醚Y能与K+形成稳定结构,但不能与Li+形成稳定结构,理由是
(3)一种类石墨的聚合物g—C3N4可由三聚氰胺(
 )制得。三聚氰胺分子中环上的氮原子杂化类型是
)制得。三聚氰胺分子中环上的氮原子杂化类型是(4)以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,记为原子坐标。LiCl·3H2O属正交晶系(长方体形)。晶胞参数为0.72nm、1.0nm、0.56nm。如图为沿x轴投影的晶胞中所有Cl原子的分布图和原子坐标。据此推断该晶胞中Cl原子的数目为

您最近一年使用:0次



