名校
解题方法
1 . A、B、C、D、E、F、G是元素周期表前四周期常见元素,且原子序数依次增大,其相关信息如表所示,请用化学用语回答下列问题。
(1)元素F简单离子的价电子排布式为___________ ;写出元素G在周期表中的位置___________ 。
(2)B与氢元素形成的简单气态氢化物的空间构型为___________ ,C与氢元素形成的简单气态氢化物的VSEPR模型为___________ 。
(3)C、D、E三种元素的简单离子半径由大到小的顺序为___________ (用元素符号表示)。
(4)已知元素A、B形成的 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为___________ 。
(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是___________ 化合物(填“离子”或“共价”);M的最高价氧化物对应的水化物与NaOH溶液反应的化学方程式为___________ 。
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 电离能数据(单位: ):738、1451、7733、10540、13630…… ):738、1451、7733、10540、13630…… |
| E | 基态原子最外层电子排布式为: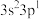 |
| F | 基态原子的最外层p轨道上2个电子的自旋状态与其他电子的自旋状态相反 |
| G | 其中一种氧化物是有磁性的黑色固体 |
(2)B与氢元素形成的简单气态氢化物的空间构型为
(3)C、D、E三种元素的简单离子半径由大到小的顺序为
(4)已知元素A、B形成的
 分子中所有原子都满足8电子稳定结构,则
分子中所有原子都满足8电子稳定结构,则 中σ键与π键之比为
中σ键与π键之比为(5)短周期元素M与D同族,已知元素M、F的电负性分别为1.5和3.0,预测它们形成的化合物是
(6)FC—常用作消毒剂,单质砷(As)在碱性溶液中可被FC—氧化为AsO
 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
2 . 现有五种元素A、B、C、D、E,其中A、B、C为三个不同周期的短周期元素,E为第四周期元素。请根据下列相关信息,回答下列问题:
(1)C基态原子中能量最高的电子,其电子云在空间有___________ 个方向,C简单离子核外有___________ 种运动状态不同的电子。
(2) 难溶于二硫化碳,简要说明理由
难溶于二硫化碳,简要说明理由___________ 。
(3) 分子的空间构型为
分子的空间构型为___________ , 分子的VSEPR模型名称为
分子的VSEPR模型名称为___________ 。
(4)下列气态分子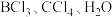 和
和 中,其键角由大到小的顺序为
中,其键角由大到小的顺序为___________ 。
| 元素 | 相关信息 |
| A | 核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B | 原子核外P电子数与s电子数相等 |
| C | 基态原子的价电子排布为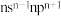 |
| D | 能层数与C相同,且电负性比C大 |
| E | 元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
(2)
 难溶于二硫化碳,简要说明理由
难溶于二硫化碳,简要说明理由(3)
 分子的空间构型为
分子的空间构型为 分子的VSEPR模型名称为
分子的VSEPR模型名称为(4)下列气态分子
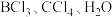 和
和 中,其键角由大到小的顺序为
中,其键角由大到小的顺序为
您最近一年使用:0次
名校
解题方法
3 . 据世界权威刊物《自然》最近报道,我国科学家选择碲化锆(ZrTe2)和砷化镉(Cd3As2)为材料验证了三维量子霍尔效应,并发现了金属-绝缘体的转换。回答下列问题:
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是______ (填字母)。
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是_______ 。在硫的化合物中,H2S、CS2都是三原子分子,但它们的键角(立体构型)差别很大,用价层电子对互斥理论解释:_________ ;用杂化轨道理论解释:_________ 。
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是___________ 。1 mol [Cd(NH3)4]2+含___________ mol σ键。
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为__________ 。
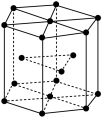
(5)锆晶胞如图所示,1个晶胞含_______ 个Zr原子;这种堆积方式称为__________ 。
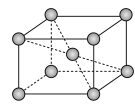
(6)镉晶胞如图所示。已知:NA是阿伏加 德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为______ nm(用含NA、d的代数式表示),镉晶胞中原子空间利用率为________ (用含π的代数式表示)。
(1)锌和镉位于同副族,而锌与铜相邻。现有 4 种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10。失去1个电子需要的能量由大到小排序是
A.④②①③ B.④②③① C.①②④③ D.①④③②
(2)硫和碲位于同主族,H2S的分解温度高于H2Te,其主要原因是
(3)Cd2+与NH3等配体形成配离子。[Cd(NH3)4]2+中2个NH3被2个Cl-替代只得到1种结构,它的立体构型是
(4)砷与卤素形成多种卤化物。AsCl3、AsF3、AsBr3的熔点由高到低的排序为
(5)锆晶胞如图所示,1个晶胞含

(6)镉晶胞如图所示。已知:NA是阿伏加 德罗常数的值,晶体密度为 d g·cm-3。在该晶胞中两个镉原子最近核间距为

您最近一年使用:0次
2020-04-23更新
|
371次组卷
|
3卷引用:重庆市第一中学2019-2020学年高二下学期期末考试化学试题



