解题方法
1 .  (直线形分子)、
(直线形分子)、 (平面三角形分子)、
(平面三角形分子)、 (正四面体型分子)都是非极性分子,
(正四面体型分子)都是非极性分子, (三角锥型分子)、
(三角锥型分子)、 (V形分子)、
(V形分子)、 (V形分子)都是极性分子。请分析什么样的
(V形分子)都是极性分子。请分析什么样的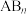 型分子为非极性分子
型分子为非极性分子_______ 。
 (直线形分子)、
(直线形分子)、 (平面三角形分子)、
(平面三角形分子)、 (正四面体型分子)都是非极性分子,
(正四面体型分子)都是非极性分子, (三角锥型分子)、
(三角锥型分子)、 (V形分子)、
(V形分子)、 (V形分子)都是极性分子。请分析什么样的
(V形分子)都是极性分子。请分析什么样的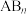 型分子为非极性分子
型分子为非极性分子
您最近半年使用:0次
2022-11-25更新
|
64次组卷
|
2卷引用:苏教2020版选择性必修2专题4第一单元 分子的空间结构课后习题
解题方法
2 . 用价层电子对互斥理论判断 分子的几何构型为
分子的几何构型为
 分子的几何构型为
分子的几何构型为| A.正四面体型 | B.V形 | C.三角锥型 | D.平面三角形 |
您最近半年使用:0次
2022-11-25更新
|
290次组卷
|
2卷引用:苏教2020版选择性必修2专题4第一单元 分子的空间结构课后习题
名校
解题方法
3 . 下列关于原子杂化类型的说法中,正确的是
A.晶体硅和石英( )晶体中的硅原子均采用 )晶体中的硅原子均采用 杂化 杂化 |
B. 中的两个碳原子与 中的两个碳原子与 中的硼原子均采用 中的硼原子均采用 杂化 杂化 |
C. 中的铍原子与 中的铍原子与 中的氧原子均采用 中的氧原子均采用 杂化 杂化 |
D. 中的碳原子与 中的碳原子与 中的两个碳原子均采用 中的两个碳原子均采用 杂化 杂化 |
您最近半年使用:0次
2022-11-25更新
|
269次组卷
|
3卷引用:苏教2020版选择性必修2专题4第一单元 分子的空间结构课后习题
4 . 下列叙述中正确的是
| A.NH3、CO、CO2都是极性分子 |
| B.CH4、CCl4都是含有极性键的非极性分子 |
| C.HF、HCl、HBr、HI的稳定性依次增强 |
| D.CS2、H2O、C2H2都是直线形分子 |
您最近半年使用:0次
2022-10-18更新
|
2540次组卷
|
75卷引用:2008年理综全国卷Ⅰ高考试题化学试题
2008年理综全国卷Ⅰ高考试题化学试题(已下线)2012届广西桂林十八中高三第一次月考化学试卷(已下线)2011-2012学年山西大同实验中学高二下学期期中考试化学试卷(已下线)2011-2012学年新疆农七师高级中学高二下学期期末考试试化学试卷(已下线)2011-2012学年福建省漳州立人学校高二下学期期中考试化学试卷(已下线)2012-2013学年山东省济南一中高二下学期期中考试理科化学试卷(已下线)2012-2013学年河北省衡水市第十四中学高二下学期期末考试化学试卷(已下线)2012-2013学年河北省唐山市第一中学高二下学期期末考试化学试卷(已下线)2013届山西省山西大学附中高三9月月考化学试卷2013-2014山东省即墨市高二下学期期中考试化学试卷2015-2016学年重庆市第八中学高二下第三次月考化学试卷2015-2016学年陕西西藏民族学院附中高二4月月考化学卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷2015-2016学年重庆四十二中高一下期中化学试卷(已下线)同步君 选修3 第二章 第三节 键的极性和分子的极性2016-2017学年宁夏育才中学孔德校区高二下学期第一次(3月)月考化学试卷2016-2017学年山东省淄博市高青一中、淄博实验中学高二下学期期中联考化学试卷新疆生产建设兵团第二中学2016-2017学年高二下学期第二次月考化学试题陕西省黄陵中学2016-2017学年高二(重点班)下学期第三学月考化学试题河南省焦作市博爱一中2016-2017学年高二下学期第一次月考化学试题高中化学人教版 选修三 第2章 分子结构与性质 键的极性和分子的极性(已下线)【段考模拟】高二化学下学期第一次月考(3月)原创B卷宁夏银川市唐徕回民中学2017-2018学年高二4月月考化学试题陕西省黄陵中学2017-2018学年高二(重点班)下学期期末考试化学试题云南省双柏县第一中学2018-2019学年高二上学期期中考试化学试题贵州省遵义市正安县第一中学2018-2019学年高二上学期期中考试化学试题云南省元江哈尼族彝族傣族自治县一中2018-2019学年高二上学期12月考试化学试题贵州省剑河县第二高级中学2018-2019学年高二上学期12月份考试化学试题宁夏回族自治区银川市长庆高级中学2018-2019学年高二下学期第二次月考化学试题【全国百强校】新疆维吾尔自治区兵团第二师华山中学2018-2019学年高二下学期第一次调研化学试题(已下线)2019年6月12日 《每日一题》 选修3-物质类别、键的极性及分子的极性之间的关系安徽省淮北师范大学附属实验中学2018-2019学年高二下学期第二次月考化学试题吉林省长春市汽车经济开发区第三中学2018-2019学年高二下学期期中考试化学试题云南省普洱市孟连县一中2018-2019学年高二下学期期末考试化学试题云南省鹤庆三中2018-2019学年高二下学期期末考试化学试题黑龙江省哈尔滨市第三中学校2019-2020学年高二上学期期末考试化学试题上海市青浦二中2016届高三上学期8月摸底考试化学试题山西省运城市永济涑北中学2019-2020学年高二下学期3月月考化学试题黑龙江省哈尔滨市第三中学2019-2020学年高二上学期第一模块(期末)考试化学试题吉林省长春市第二十九中学2019-2020学年高二下学期线上检测化学试题河北省唐山市路北区第十一中学2019-2020学年高二期中考试化学试题辽宁省六校协作体2019-2020高二下学期期初考试化学试卷吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题安徽省六安中学2019-2020学年高二下学期期末考试化学试题新疆昌吉回族自治州呼图壁县第一中学2019-2020学年高二下学期期末考试化学试题福建省龙岩市武平县第一中学2021届高三上学期10月月考化学试题福建省龙海市第二中学2019-2020学年高二下学期期末考试化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 章末综合检测卷四川省绵阳市江油中学2020-2021学年高二上学期期中考试化学试题辽宁省大连市普兰店区第三十八中学2020-2021学年高二上学期期末考试化学试题辽宁省阜新二高2020-2021学年高二下学期期中考试化学试题云南省通海县一中2020-2021学年高二下学期期中考试化学试题黑龙江省哈尔滨市第三十二中学2019-2020学年高二下学期期中考试化学试题人教2019选择性必修2第二章 分子结构与性质复习与提高黑龙江省绥化市第九中学2021-2022学年高二4月月考化学试题新疆乌鲁木齐市第四中学2021-2022学年高二下学期期中考试化学试题陕西省宝鸡市长岭中学2021-2022学年高二下学期期中考试化学试题福建省南安市侨光中学、昌财实验中学2021-2022学年高二下学期第4次联考(期中)化学试题宁夏贺兰县景博中学2021-2022学年高二下学期第一次月考化学试题四川省绵阳市盐亭中学2022-2023学年高二上学期第一次月考教学质量检测化学试题宁夏吴忠市吴忠中学2022-2023学年高三上学期阶段性测试 化学试题(已下线)【知识图鉴】单元讲练测选择性必修2第二章03单元测山东省威海市文登新一中2021-2022学年高二上学期期中考试化学试题广东省广州市第三中学2022-2023学年高二上学期期末测试化学试题广东省台山市第一中学2022-2023学年高二下学期第一次月考化学试题江西省景德镇市2022-2023学年高二下学期4月期中测试化学试题广东省深圳市观澜中学2022-2023学年高二下学期月考(物质结构)化学试题福建省德化第二中学2022-2023学年高二下学期期中考试化学试题安徽省合肥市第七中学2022-2023学年高二下学期期中检测化学试题广东省珠海市第三中学2023-2024学年高二下学期3月月考化学试卷河北省衡水市枣强中学2023-2024学年高二下学期第一次调研考试化学试题河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷广东省四会中学、广信中学2023-2024学年高二下学期第一次联合考试化学试题
解题方法
5 . 表中的中心原子A上没有孤电子对,运用价层电子对互斥模型,完成表中的空白:
 | 分子的空间结构 | 典型例子 |
 | ||
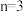 | ||
 |
您最近半年使用:0次
解题方法
6 . 分析乙烷、乙烯和乙炔的分子结构。其中的碳原子采取什么杂化轨道形成σ键_______ ?怎样理解乙烯中的双键和乙炔中的三键_______ ?乙炔加氢变成乙烯和乙烷,碳原子的杂化轨道发生什么变化_______ ?
您最近半年使用:0次
名校
解题方法
7 . 下列描述中,正确的是
A. 是空间结构为V形的极性分子 是空间结构为V形的极性分子 |
B. 的空间结构为平面三角形 的空间结构为平面三角形 |
C. 中所有的原子不都在一个平面上 中所有的原子不都在一个平面上 |
D. 和 和 的中心原子的杂化轨道类型均为 的中心原子的杂化轨道类型均为 杂化 杂化 |
您最近半年使用:0次
2021-12-03更新
|
2173次组卷
|
15卷引用:人教2019选择性必修2第二章 分子结构与性质复习与提高
人教2019选择性必修2第二章 分子结构与性质复习与提高海南省儋州川绵中学2021-2022学年高二下学期期中考试化学试题湖北省潜江市华中师范大学潜江附属中学高二上学期12月月考化学试题重庆市巫山县官渡中学2021-2022学年高二下学期期末考试化学试题重庆市万州纯阳中学校2021-2022学年高二下学期期中考试化学试题辽宁省大石桥市第三高级中学2021-2022学年高二12月月考化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题浙江省宁波市奉化区2022-2023学年高二上学期期末联考化学试题北京市顺义区第一中学2022-2023学年高二下学期3月月考化学试题广东省佛山市顺德区第一中学2022-2023学年高二下学期4月期中考试化学试题广东省云浮市罗定中学2022-2023学年高二下学期第2周周测(分子结构与性质)化学试题广东省深圳市盐田高级中学2023-2024学年高二上学期1月期末化学试题(已下线)热点04 分子的空间结构贵州省安龙县第一中学2023-2024学年高二下学期第一次阶段考试化学试题内蒙古赤峰新城红旗中学2023-2024学年高二下学期4月月考化学试题
9-10高二下·福建漳州·期末
名校
解题方法
8 . 下列叙述正确的是
A. 是极性分子,分子中氮原子是在3个氢原子所构成的三角形的中心 是极性分子,分子中氮原子是在3个氢原子所构成的三角形的中心 |
B. 是非极性分子,分子中碳原子处在4个氯原子所构成的正方形的中心 是非极性分子,分子中碳原子处在4个氯原子所构成的正方形的中心 |
C. 是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中间 是极性分子,分子中氧原子不处在2个氢原子所连成的直线的中间 |
D. 是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的中间 是非极性分子,分子中碳原子不处在2个氧原子所连成的直线的中间 |
您最近半年使用:0次
2021-02-16更新
|
921次组卷
|
39卷引用:2010年福建省华安一中高二下学期期末考试化学试题
(已下线)2010年福建省华安一中高二下学期期末考试化学试题(已下线)2011届上海市南汇中学高三上学期期中考试化学卷(已下线)2010-2011学年山西省吕梁市高二下学期期中考试化学试卷(已下线)2011-2012学年江苏省泰州中学高二上学期期中考试化学(选修)试卷(已下线)2011-2012学年甘肃省甘谷一中高二下学期期中考试化学试卷(已下线)2011-2012学年福建省四地六校高二下学期第三次月考化学试卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷2014-2015学年辽宁实验分校高二下6月阶段测试化学试卷2015-2016学年湖北省黄石市有色一中高二下学期期中考试化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题2018版化学(苏教版)高考总复习专题十一课时跟踪训练--分子空间结构与物质性质河南省济源第一中学2017-2018学年高二下期6月月考化学试题(已下线)2018年11月30日 《每日一题》一轮复习-键的极性与分子的极性云南省彝良县民族中学2018-2019学年高二上学期12月份考试化学试题【全国百强校】吉林省长春外国语学校2018-2019学年高二下学期第一次月考化学试题(已下线)2019年4月12日 《每日一题》选修3-分子的极性判断吉林省吉林市第五十五中学2018-2019学年高二下学期3月月考化学试题【全国百强校】贵州省思南中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市呼兰一中、阿城二中、宾县三中、尚志五中四校2018-2019学年高二下学期期中考试化学试题【校级联考】福建省宁德市高中同心顺联盟校2018-2019学年高二下学期期中考试化学试题甘肃省临泽一中2018-2019学年高二下学期期末模拟化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题贵州省罗甸县第一中学2019-2020学年高二上学期期末考试化学试题河南省林州市第一中学2019-2020学年高二3月线上调研考试化学试题课时3 分子的空间构型与分子性质——A学习区 夯实基础(鲁科版选修3)宁夏回族自治区银川一中2019-2020学年高二下学期期中考试化学试题山西省太原市实验中学校2019-2020学年高二下学期期中考试化学试题河北省唐山市开滦第二中学2019-2020学年高二6月月考化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第三节 分子结构与物质的性质 第1课时 共价键的极性高二选择性必修2(人教版2019)第二章 分子结构与性质 第三节 分子结构与物质的性质 课时1 共价键的极性(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构 第2课时 分子的空间结构与分子性质山东省泰安市宁阳一中2020-2021学年高二下学期3月月考化学试题人教2019选择性必修2第二章第三节 分子结构与物质的性质课后习题(已下线)第31讲 分子结构与性质(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)福建省三明市五县2021-2022学年高二下学期联合质检考试(期中)化学试题安徽省滁州市定远县炉桥中学2021-2022学年高二下学期期末考试化学试卷2019鲁科版高中化学选择性必修2第2章第2节 共价键与分子的空间结构课后习题福建省宁德第一中学2022-2023学年高二下学期3月月考化学试题
名校
9 . 能说明BF3分子的4个原子在同一平面的理由是( )
| A.任意两个B—F键的键角为120° | B.B—F键是非极性键 |
| C.3个B—F键的键能相等 | D.3个B—F键的键长相等 |
您最近半年使用:0次
2019-04-17更新
|
451次组卷
|
15卷引用:云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题
云南省玉溪市易门中学2017-2018学年高二上学期期中考试化学试题云南省盐津县第一中学2018-2019学年高二上学期12月份考试化学试题(已下线)2019年3月6日 《每日一题》人教选修3-键参数——键能、键长与键角【区级联考】上海市徐汇区2019届高三下学期学习能力诊断二模化学试题黑龙江省大庆市三校联考2018-2019学年高二下学期期末考试化学试题沪科版高中化学拓展课程第2章《化学键与晶体结构》检测题云南省玉溪市新平三中2019-2020学年高二上学期12月份月考化学试题云南省陇川县第一中学2019-2020学年高二上学期期末考试化学试题(已下线)练习19 共价键-2020-2021学年【补习教材·寒假作业】高二化学(人教版)(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键 第2课时 共价键的键参数鲁科版2019选择性必修2第2章 微粒间相互作用与物质性质 第1节 共价键模型 第2课时 共价键的键参数(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第1节 共价键模型(人教版2019)选择性必修2 第二章 分子结构与性质 第一节 共价键上海南汇中学2021-2022学年高三下学期阶段考试化学试题2019鲁科版高中化学选择性必修2第2章本章自我评价课后习题



