解题方法
1 . 海洋是元素的摇篮,海水中含有的大量元素在生产、生活、科学研究等多方面具有重要作用。回答下列问题。
(1)写出基态溴原子的价电子排布式_______ ,氟、氯、溴、氧四种元素中,电负性由大到小的顺序为_____ (填元素符号) 。
(2) Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1,二者相差很大的原因是______ 。
(3) X射线衍射测定等发现,I3AsF6中存在I 离子。I
离子。I 离子的几何构型为
离子的几何构型为_____ ,中心原子的杂化类型为_____ 。
(4) C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。

①1mol吡啶分子中含有σ键数目是___________ NA。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因___________ 。
③分子中的大π键可以用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为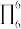 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为___________ 。
(5) CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:
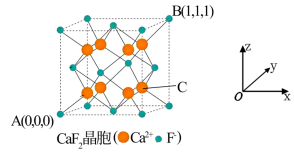
①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(________ ,_______ , )
)
②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为____ g•cm-3 (列出计算式即可) 。
(1)写出基态溴原子的价电子排布式
(2) Mg、Al的氟化物晶格能分别是2957 kJ•mol-1、5492 kJ•mol-1,二者相差很大的原因是
(3) X射线衍射测定等发现,I3AsF6中存在I
 离子。I
离子。I 离子的几何构型为
离子的几何构型为(4) C原子可以形成多种有机物,如图所示是一种吡啶和一种嘌呤的结构,两种分子中所有原子都在一个平面上。

①1mol吡啶分子中含有σ键数目是
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因
③分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为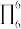 )。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为
)。该吡啶和嘌呤中都含有大π键,则该吡啶中的大π键表示为(5) CaF2可用于冶金、化工和建材等很多行业,为立方晶胞,结构如下图所示:

①“ 原子坐标参数”可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的“原子坐标参数”为(
 )
)②已知晶胞参数为0.5462 nm,阿伏加德罗常数的值为NA,则其密度为
您最近一年使用:0次
解题方法
2 . Cu2O广泛应用于太阳能电池领域。以CuSO4、NaOH和抗坏血酸为原料,可制备Cu2O。
(1)基态Cu原子的外围电子排布式为__ ,其最高能级的电子云为__ 形。
(2)SO 的空间构型为
的空间构型为___ (用文字描述);Cu2+与OH-反应能生成[Cu(OH)4]2-,Cu2+与之间OH-的化学键类型为___ ,[Cu(OH)4]2-中配位数为__ 。
(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为__ ,手性碳原子的数量为___ 个,由其结构推测,抗坏血酸__ 溶于水(填“难”或“易”),请解释原因__ 。

(4)Cu2O的晶胞如图2所示,则Cu原子的配位数为__ 。若NA为阿伏加德罗常数,晶体密度为ρg•cm-3,求Cu2O的晶胞边长a=__ cm。
(1)基态Cu原子的外围电子排布式为
(2)SO
 的空间构型为
的空间构型为(3)抗坏血酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为

(4)Cu2O的晶胞如图2所示,则Cu原子的配位数为
您最近一年使用:0次



