名校
1 . 下列说法中不正确的是
| A.气体单质中,一定有σ键,可能有π键 |
| B.PCl5分子是非极性分子 |
| C.氢键键长一般定义为A-H…B的长度,而不是H…B的长度 |
D. 的VSEPR模型与离子的空间立体构型一致 的VSEPR模型与离子的空间立体构型一致 |
您最近一年使用:0次
2021-07-13更新
|
192次组卷
|
2卷引用:宁夏银川一中2020-2021学年高二下学期期末考试化学试题
名校
解题方法
2 . 根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号______ 。
(2)最外层电子排布为4s24p1的原子的核电荷数为______ 。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4该元素的名称是______ 。
(4)根据VSEPR模型,H3O+的分子立体结构为:______ ,SO2的立体结构为:______ 。
(5)周期表中最活泼的非金属元素原子的轨道表示式为______ 。
(6)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______ 。
(7)某元素核外有三个电子层,最外层电子数是核外电子总数的 ,写出该元素原子的电子排布式是
,写出该元素原子的电子排布式是______ 。
(8)写出铬元素在周期表中的位置______ ,它位于______ 区。
(1)含有8个质子,10个中子的原子的化学符号
(2)最外层电子排布为4s24p1的原子的核电荷数为
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4该元素的名称是
(4)根据VSEPR模型,H3O+的分子立体结构为:
(5)周期表中最活泼的非金属元素原子的轨道表示式为
(6)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为
(7)某元素核外有三个电子层,最外层电子数是核外电子总数的
 ,写出该元素原子的电子排布式是
,写出该元素原子的电子排布式是(8)写出铬元素在周期表中的位置
您最近一年使用:0次
2021-04-03更新
|
96次组卷
|
2卷引用:宁夏青铜峡市高级中学2020-2021学年高二下学期第一次月考化学试题
名校
解题方法
3 . 现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
(1)A基态原子中能量最高的电子,其电子云在空间有______ 个方向,原子轨道呈______ 形。
(2)某同学根据上述信息,所画的B电子排布图如图,违背了__ 原理。

(3)F位于______ 族______ 区,其基态原子有______ 种运动状态。
(4)CD3中心原子的杂化方式为______ ,用价层电子对互斥理论推测其分子空间构型为______ ,检验E元素的方法是______ 。
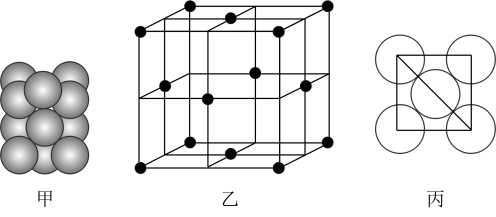
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为______ ,该单质晶体中原子的堆积方式为四种基本堆积方式中的______ 。若已知该金属的原子半径为dcm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______ g·cm-3(用字母表示)。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
(2)某同学根据上述信息,所画的B电子排布图如图,违背了

(3)F位于
(4)CD3中心原子的杂化方式为
(5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为

您最近一年使用:0次
名校
解题方法
4 . 根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是
A.NH3和NO | B.SO3和NO | C.BF3 和ClO | D.H2O和PO |
您最近一年使用:0次
2021-01-24更新
|
265次组卷
|
8卷引用:宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题
宁夏吴忠市吴忠中学2020-2021学年高二3月月考化学试题山西省长治市第二中学校2020-2021学年高二上学期期末考试化学试题(已下线)2.2 分子的空间结构(A级基础练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修2)山东省商河县第一中学2020-2021学年高二下学期开学考试化学试题吉林省长春市第二实验中学2020-2021学年高二下学期4月月考化学试题吉林省延边朝鲜族自治州延边二中北校区2020-2021学年高二下学期第一次月考化学试题河北省石家庄市元氏县第四中学2021-2022学年高二下学期6月月考化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(1-10)
名校
解题方法
5 . 下列中心原子的杂化轨道类型和分子几何构型不正确的是( )
| A.PCl3中P 原子sp3杂化,为三角锥形 |
| B.BC13中B原子sp2杂化, 为平面三角形 |
| C.CS2中C原子sp杂化,为直线形 |
| D.H2S分子中,S为sp杂化,为直线形 |
您最近一年使用:0次
2020-09-02更新
|
601次组卷
|
30卷引用:宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷
宁夏长庆高级中学2020-2021学年高二上学期期中考试化学试卷宁夏回族自治区吴忠市吴忠中学2019-2020学年高二下学期期中考试化学试题(已下线)模块同步卷05 分子的立体构型及分子的性质-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)吉林省松原市乾安县第七中学2020-2021学年高二下学期第五次质量检测化学试题(已下线)考点34 分子结构与性质-备战2022年高考化学一轮复习考点帮(全国通用)宁夏银川市景博中学2021-2022学年高二下学期第二次月考化学试题2014-2015吉林省吉林市第五十五中学高二下学期期中考试化学试卷2014-2015学年吉林省汪清县第六中学高二下学期期末考试化学试卷2015-2016学年福建省四地六校高二下第二次联考化学试卷2015-2016学年吉林东北师大附属实验高二下期末化学试卷2015-2016吉林东北师大附属实验学校净月实验学校高二下期末化学卷甘肃省玉门市第一中学2018-2019学年高二上学期期中考试化学试题河南省开封市兰考县第一高级中学2018-2019学年高二下学期3月月考化学试题【全国百强校】甘肃省兰州市第一中学2018-2019学年高二下学期3月月考化学试题山西省运城市新绛县第二中学2018-2019学年高二下学期期中考试化学试题贵州省毕节纳雍县一中2018-2019学年高二下学期期末考试化学试题云南省金平县第一中学2019-2020学年高二上学期期末考试化学试题四川省绵阳市三台中学实验学校2019-2020学年高二上学期9月月考化学试题吉林省汪清县第六中学2019-2020学年高二下学期期中考试化学试题吉林省通化市通化县综合高级中学2019-2020学年高二下学期期中考试化学试题(已下线)练习14 分子的空间结构-2020-2021学年【补习教材·寒假作业】高二化学(人教版2019)天津市天外大附属北辰光华外国语学校2019-2020学年高二下学期期末测试化学试题(已下线)考点47 分子结构与性质-备战2023年高考化学一轮复习考点帮(全国通用)四川省绵阳第一中学2022-2023学年高二上学期9月教学质量监测理科化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高二下学期6月月考化学试题新疆生产建设兵团第六师芳草湖农场中学2021-2022学年高二上学期期末考试化学试题四川省科学城第一中学2022-2023学年高二上学期期中考试化学试题新疆克拉玛依市高级中学2021-2022学年高二下学期期末考试化学试题(已下线)考点42 分子结构与性质(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省灌南高级中学2023-2024学年高三上学期第一次月考化学试题
名校
解题方法
6 . 下列物质中,分子的立体结构与水分子相似的是 ( )
| A.CO2 | B.H2S | C.PCl3 | D.SiCl4 |
您最近一年使用:0次
2020-05-23更新
|
730次组卷
|
11卷引用:宁夏海原第一中学2020-2021学年高二下学期期末考试化学试题
宁夏海原第一中学2020-2021学年高二下学期期末考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(人教版2019)选择性必修2 第二章 分子结构与性质 章末综合检测卷(鲁科版2019)选择性必修2 第2章 微粒间相互作用与物质性质 第2节 共价键与分子的空间结构(已下线)2.2.1 分子空间结构的理论分析-2020-2021学年高二化学课时同步练(鲁科2019选择性必修2)2016-2017学年河北省张家口一中高二12月月考化学卷广西靖西市第二中学2019-2020学年高二下学期开学考试化学试题山东省淄博市般阳中学2020-2021学年高二上学期期中考试化学试题吉林地区普通高中友好学校联合体2021-2022学年高二下学期期末考试化学试题第二节 分子的空间结构 第1课时 分子结构的测定 多样的分子空间结构 价层电子对互斥模型重庆市荣昌永荣中学校2021-2022学年高二下学期期末考试化学试题
真题
名校
7 . 用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
您最近一年使用:0次
2019-01-30更新
|
2679次组卷
|
77卷引用:宁夏吴忠中学2021-2022学年高三上学期第一次月考化学试题
宁夏吴忠中学2021-2022学年高三上学期第一次月考化学试题2015-2016学年宁夏六盘山高中高二下学期期中化学试卷宁夏青铜峡市高级中学2017-2018学年高二上学期期末考试化学试题(人教版2019)选择性必修2 第二章 分子结构与性质 第二节 分子的空间结构(已下线)模块同步卷11 综合检测卷(基础卷)-《灯塔金卷系列》2020-2021学年高二化学模块同步卷(人教版选修3)山西省晋中市新一双语学校2020-2021学年高二下学期3月月考化学试题山西省太原市2020-2021学年高二下学期期中质量监测理科化学试题吉林省长春市榆树高级中学2020-2021学年高二下学期期中考试化学试题福建省福州市金山中学2020-2021学年高二下期中考试化学试题海南省三亚华侨学校(南新校区)2020-2021学年高二下学期期中考试化学试题(已下线)课时55 分子结构与性质-2022年高考化学一轮复习小题多维练(全国通用)(已下线)第十一单元 物质结构与性质(B卷 真题滚动练)-2022年高考化学一轮复习单元滚动双测卷(新高考地区专用)宁夏青铜峡市宁朔中学2021-2022学年高二3月月考化学试题(已下线)09-10年辽宁大连23中高二下学期期末考试化学卷(已下线)09~10年宝鸡中学高二下学期期末考试化学卷(已下线)09—10年哈三中高二下学期期末考试化学卷2007年普通高等学校招生全国统一考试(海南卷)化学试题(已下线)2010-2011学年山东省兖州市高二下学期期中考试化学试卷(已下线)2011-2012年四川省成都市六校协作体高二上学期期中考试化学试卷(已下线)2011-2012学年福建省厦门六中高二上学期期中考试化学(理)试卷(已下线)2011-2012学年江西省上饶县中学高二第一次月考化学试卷(已下线)2011-2012学年河南省偃师高中高二3月月考化学试卷(已下线)2011-2012年山东济南外国语学校高二下学期期中考试理科化学试卷(已下线)2011-2012学年吉林省长春外国语学校高二下学期期末考试化学试卷(已下线)2012-2013学年福建省福州文博中学高二上学期期末考试化学试卷(已下线)2012-2013学年福建三明泰宁一中高二下第一次阶段考试化学试卷(已下线)2012-2013学年吉林省龙井市三中高二下学期期中考试化学试卷(已下线)2012-2013学年辽宁省沈阳二中高二下学期期中考试化学试卷(已下线)2013-2014河北正定中学第二学期第一次月考高二化学试卷2014-2015黑龙江省哈尔滨六中高二上期末化学试卷2014-2015福建省四地六校高二下学期第一次联考化学试卷2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷2015-2016学年内蒙古元平煤高中高二实验班下期中化学卷2015-2016学年河南省三门峡市灵宝一中高二下第一次月考化学试卷2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷(已下线)同步君 选修3 第二章 第二节 第一课时 价电子互斥理论2016-2017学年山东省滨州市高二下学期第一次阶段性测试化学试卷河北省蠡县中学2016-2017学年高二6月月考化学试题河北省廊坊市第一中学2016-2017学年高二下学期6月月考化学试题广西宾阳县宾阳中学2016-2017学年高二下学期7月期末考试化学试题福建省福州市八县(市)协作校2016-2017学年高二下学期期末考试化学试题陕西省宝鸡中学2016-2017学年高二下学期期末考试化学试题河北省定州中学2018届高三上学期高中毕业班第一次调研化学试题福建省福州市八县协作校2016-2017学年高二下学期期末化学试题高中化学人教版 选修三 第2章 分子结构与性质 价电子对互斥理论人教版2017-2018学年高二化学选修三同步训练:2.2 分子的立体构型(第1课时)河北省石家庄市鹿泉一中2017-2018学年高二3月月考化学试题贵州省遵义育新高级中学2018-2019学年高二上学期11月月考化学试题贵州省安顺市普定县第一中学2018-2019学年高二上学期12月考试化学试题黑龙江省牡丹江市第三高级中学2018-2019学年高二上学期期末考试化学试题福建省晋江市季延中学2018-2019学年高二下学期期中考试化学试题黑龙江省哈尔滨市阿城区第二中学2018-2019学年高二下学期期中考试化学试题新疆兵团八师一四三团一中2018-2019学年高二下学期期中考试化学试题云南省元阳县第三中学2019-2020学年高二上学期期末考试化学试题吉林省延边市长白山第一高级中学2019-2020学年高二下学期验收考试化学试卷山东省泰安市2020年高二下学期化学期中考试(鲁科版)吉林省舒兰市实验中学2019-2020学年高二下学期期中考试化学试题新疆吐蕃市高昌区第二中学2019-2020学年高二下学期期末考试化学试题新疆乌鲁木齐市第四中学2019-2020学年高二下学期期末考试化学试题吉林省长春市实验中学2019-2020高二下学期期中考试化学试题福建省龙岩市武平县第一中学2020-2021学年高二上学期10月月考化学试题四川省阿坝州九寨沟2019-2020学年高二上学期期末考试化学试题(已下线)专题14 分子结构与性质-2023年高考化学一轮复习小题多维练(全国通用)(已下线)易错点16 分子结构与性质-备战2023年高考化学考试易错题黑龙江省友谊县高级中学2022-2023学年高二上学期期末考试(新教材)化学试题贵州省江口中学2022-2023学年高二下学期3月份月考化学试题陕西省西安市铁一中学2022-2023学年高二下学期4月期中考试化学试题四川省资阳中学2022-2023学年高二上学期期末考试化学试题黑龙江省哈尔滨市宾县第二中学2022-2023学年高二下学期第二次月考化学试题湖南省株洲市炎陵县第一中学等2校2022-2023学年高二下学期开学考试化学试题2.2.1分子空间结构的理论分析(课后)-鲁科版选择性必修2河南省周口市西华县第一高级中学2023-2024学年高二上学期月考化学试卷新疆阿克苏市实验中学2022-2023学年高二下学期第一次月考化学试题河南省焦作市2022-2023学年第四中学高二下学期期中考试 化学试卷山西省大同市浑源七中2023-2024学年高二下学期第一次月考化学试题辽宁省本溪市第一中学2023-2024学年高二上学期1月期末化学试题
名校
8 . 用价层电子对互斥理论预测H2S和NH3的立体结构,两个结论都正确的是( )
| A.直线形;三角锥形 | B.V形;三角锥形 |
| C.直线形;平面三角形 | D.V形;平面三角形 |
您最近一年使用:0次
2017-12-12更新
|
224次组卷
|
5卷引用:宁夏青铜峡市高级中学2020-2021学年高二下学期期中考试化学试题
名校
9 . 在以下的分子或离子中,空间结构的几何形状不是三角锥形的是
| A.NF3 | B.CH3- | C.BF3 | D.H3O+ |
您最近一年使用:0次
2016-12-09更新
|
956次组卷
|
4卷引用:宁夏海原第一中学2020-2021学年高二下学期期中考试化学试题
宁夏海原第一中学2020-2021学年高二下学期期中考试化学试题(已下线)2012-2013学年四川省遂宁二中高二上学期期中考试化学试卷(已下线)2014高考化学名师知识点精编 选修3物质结构与性质练习卷吉林省汪清县第六中学2019-2020学年高二下学期期中考试化学试题



