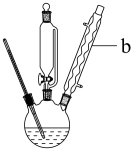
1 . 三颈圆底烧瓶是一种常用的化学玻璃仪器,在有机化学实验中被广泛使用。可以用该仪器来制备苯乙酸铜,以下为实验室合成路线。
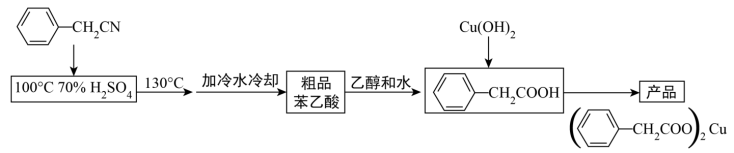
反应的原理为:
 +H2O+H2SO4
+H2O+H2SO4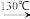
 +NH4HSO4
+NH4HSO4
2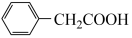 +Cu(OH)2→
+Cu(OH)2→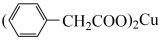 +2 H2O
+2 H2O
(1)在250 mL三颈烧瓶中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是__________________________ 。
(2)仪器b的名称________________ ,其作用是_____________ ;合成苯乙酸时,最合适的加热方法是_____________ 。
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_____________ 。下列仪器中可用于分离苯乙酸粗品的是___________ (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)由于苯乙酸的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是_____ (填字母)。
A. B.
B. C.
C.
(5)在实验中原料用量:5.0 mL苯乙腈,最终称得产品质量为3.2 g,则所得的苯乙酸的产率为_________ %(结果保留三位有效数字)。
(6)将苯乙酸加入到乙醇与水的混合物中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙铜晶体,混合溶剂中乙醇的作用是_________


反应的原理为:
 +H2O+H2SO4
+H2O+H2SO4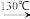
 +NH4HSO4
+NH4HSO42
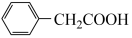 +Cu(OH)2→
+Cu(OH)2→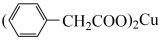 +2 H2O
+2 H2O| 药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(g·cm-3) |
| 苯乙腈 | 117 | -48 | 197 | 微溶于冷水,易溶于乙醇 | 1.08 |
| 苯乙酸 | 136 | 76.5 | 161 | 微溶于冷水,易溶于乙醇 | 1.17 |
(2)仪器b的名称
(3)反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(4)由于苯乙酸的沸点较高,在蒸馏纯化操作中最适宜选用的仪器之一是
A.
 B.
B. C.
C.
(5)在实验中原料用量:5.0 mL苯乙腈,最终称得产品质量为3.2 g,则所得的苯乙酸的产率为
(6)将苯乙酸加入到乙醇与水的混合物中,充分溶解后,加入Cu(OH)2搅拌30 min,过滤,滤液静置一段时间,析出苯乙铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
2021-07-27更新
|
425次组卷
|
3卷引用:天津市蓟州一中、芦台一中、英华国际学校三校2020-2021学年高二下学期期末考试联考化学试题
2 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线如下:

制备苯乙酸的装置示意图如图(加热和夹持装置等略):
已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250mL三口瓶a中加入70mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是_____ 。
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。仪器c的名称是_____ ,其作用是_____ 。反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_____ 。下列仪器中可用于分离苯乙酸粗品的是_____ (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是_____ ,最终得到44g纯品,则苯乙酸的产率是_____ 。
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是_____ 。

制备苯乙酸的装置示意图如图(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250mL三口瓶a中加入70mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是
(2)将a中的溶液加热至100℃,缓缓滴加40g苯乙腈到硫酸溶液中,然后升温至130℃继续反应。仪器c的名称是
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是
(4)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是
您最近一年使用:0次
3 . 一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
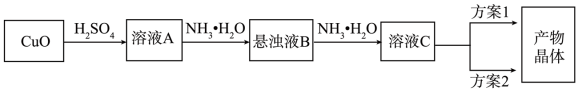
相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+ Cu2++4NH3
Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图
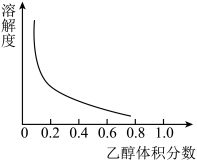
请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是_____ 。
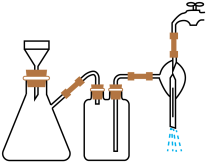
A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有_____ 杂质,产生该杂质的原因是______ 。
(2)方案2的实验步骤为:a.向溶液C中加入适量____ ,b.抽滤,c.洗涤,d.干燥。
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是________ 。
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:____________ 。
③步骤d采用________ 干燥的方法。

相关信息如下:
①[Cu(NH3)2]SO4·H2O在溶液中存在以下电离(解离)过程:
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++SO42-+H2O [Cu(NH3)4]2+
 Cu2++4NH3
Cu2++4NH3②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇、水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如图

请根据以上信息回答下列问题:
(1)方案1的实验步骤为:a.加热蒸发,b.冷却结晶,c.抽滤,d.洗涤,e.干燥。
①步骤1的抽滤装置如图所示,下列有关抽滤操说法作正确的是

A.完毕后的先关闭水龙头,再拔下导管
B.上图装置中只有一处错误
C.抽滤后滤液可以从上口倒出,也可从支管倒出
D.滤纸应比漏斗内径小且能盖住所有小孔
②该方案存在明显缺陷,因为得到的产物晶体中往往含有
(2)方案2的实验步骤为:a.向溶液C中加入适量
①请在上述空格内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是
A.乙醇 B.蒸馏水 C.乙醇和水的混合液 D.饱和硫酸钠溶液
洗涤的具体操作是:
③步骤d采用
您最近一年使用:0次
2019-06-29更新
|
362次组卷
|
2卷引用:浙江省嘉兴市2018-2019学年高二下学期期末考试化学试题
4 . 以废旧锂离子电池正极材料(主要成分为镍钴锰酸锂,还有少量镁铝合金和含铁化合物)为原料,回收 、
、 、
、 的过程可表示为:
的过程可表示为:
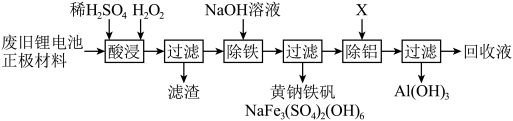
(1)“酸浸”时,三价镍、三价钴、四价锰转化为 、
、 、
、 进入溶液,则在该过程中
进入溶液,则在该过程中 是
是_______ (填“氧化剂”或“还原剂”)。保持其他条件相同,搅拌相同时间,测得60℃时镍、钴、锰的浸出率最大:温度既不能过低也不能过高的可能原因是________ 。
(2)“过滤”时所用到的玻璃仪器有烧杯、________ 。
(3)“除铁”时加入 溶液控制溶液的
溶液控制溶液的 为1.5~1.8,则
为1.5~1.8,则 转化为黄钠铁矾[
转化为黄钠铁矾[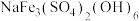 ]沉淀的离子方程式是
]沉淀的离子方程式是________ 。
(4)回收液可用于合成锂离子电池正极材料,合成前需测定其中 等离子的浓度。
等离子的浓度。
测定原理:用过量标准 溶液氧化经预处理的回收液样品中的
溶液氧化经预处理的回收液样品中的 ,再用标准
,再用标准 溶液滴定过量的
溶液滴定过量的 溶液。反应方程式为:
溶液。反应方程式为: 。
。
测定过程:取预处理后的回收液样品20.00mL,向其中加入:20.00mL
 溶液,充分反应;再用
溶液,充分反应;再用
 溶液滴定反应后的溶液,消耗
溶液滴定反应后的溶液,消耗 溶液12.00mL。
溶液12.00mL。
计算预处理后的回收液样品中 的物质的量浓度
的物质的量浓度_______ 。(写出计算过程)
 、
、 、
、 的过程可表示为:
的过程可表示为:
(1)“酸浸”时,三价镍、三价钴、四价锰转化为
 、
、 、
、 进入溶液,则在该过程中
进入溶液,则在该过程中 是
是(2)“过滤”时所用到的玻璃仪器有烧杯、
(3)“除铁”时加入
 溶液控制溶液的
溶液控制溶液的 为1.5~1.8,则
为1.5~1.8,则 转化为黄钠铁矾[
转化为黄钠铁矾[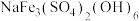 ]沉淀的离子方程式是
]沉淀的离子方程式是(4)回收液可用于合成锂离子电池正极材料,合成前需测定其中
 等离子的浓度。
等离子的浓度。测定原理:用过量标准
 溶液氧化经预处理的回收液样品中的
溶液氧化经预处理的回收液样品中的 ,再用标准
,再用标准 溶液滴定过量的
溶液滴定过量的 溶液。反应方程式为:
溶液。反应方程式为: 。
。测定过程:取预处理后的回收液样品20.00mL,向其中加入:20.00mL

 溶液,充分反应;再用
溶液,充分反应;再用
 溶液滴定反应后的溶液,消耗
溶液滴定反应后的溶液,消耗 溶液12.00mL。
溶液12.00mL。计算预处理后的回收液样品中
 的物质的量浓度
的物质的量浓度
您最近一年使用:0次
5 . 苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一,
可采用苯乙腈为原料在实验室进行合成。请回答:
(1)制备苯乙酸的装置如图(加热和夹持装置等略)。已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。

在250mL三口瓶a中加入70mL质量分数为70%的硫酸,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应:
仪器b的名称是______________ ,其作用是______________ 。反应结束后加适量冷水再分离出苯乙酸粗品,加入冷水的目的是___________________________________ 。
(2)分离出粗苯乙酸的操作名称是______ ,所用到的仪器是(填字母)______ 。
a.漏斗 b.分液漏斗 c.烧杯 d.玻璃棒 e.直形冷凝管
(3)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,写出发生反应的化学方程式__________________ ,混合溶剂中乙醇的作用是________________________________________________________ 。
(4)提纯粗苯乙酸最终得到44g纯品,则苯乙酸的产率是_________ 。
(相对分子质量:苯乙腈 117,苯乙酸 136)
可采用苯乙腈为原料在实验室进行合成。请回答:
(1)制备苯乙酸的装置如图(加热和夹持装置等略)。已知:苯乙酸的熔点为76.5℃,微溶于冷水,溶于乙醇。

在250mL三口瓶a中加入70mL质量分数为70%的硫酸,加热至100℃,再缓缓滴入40g苯乙腈,然后升温至130℃,发生反应:
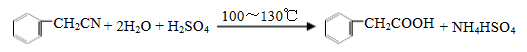
仪器b的名称是
(2)分离出粗苯乙酸的操作名称是
a.漏斗 b.分液漏斗 c.烧杯 d.玻璃棒 e.直形冷凝管
(3)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后加入Cu(OH)2,搅拌30min,过滤,滤液静置一段时间可以析出苯乙酸铜晶体,写出发生反应的化学方程式
(4)提纯粗苯乙酸最终得到44g纯品,则苯乙酸的产率是
(相对分子质量:苯乙腈 117,苯乙酸 136)
您最近一年使用:0次
2017-06-17更新
|
774次组卷
|
2卷引用:【全国百强校】河南省南阳市第一中学2017-2018学年高二下学期期末模拟化学试题



