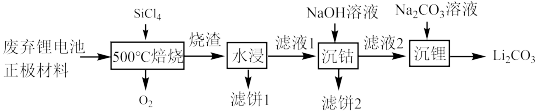
1 . 近几年新能源汽车呈现爆发式增长,对于锂电池的需求量越来越大,而碳酸锂是锂电池的重要原料之一,对废旧锂离子电池进行资源化和无害化处理具有重要的经济和环境效益,利用SiCl4对废弃的锂电池正极材料LiCoO2)进行氧化处理以回收Li等金属的工艺流程如下:
(1)Co在元素周期表的位置是___________ ,Co2+与Co3+的未成对电子数之比为___________ 。
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“ 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为___________ 。
(3)“滤饼2”的主要成分为___________ (填化学式)。利用Li2CO3与CoCO3按n(Li):n(Co)=1:1的比例配合,然后在空气中于 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为___________ 。
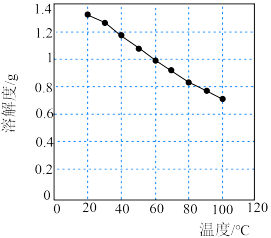
(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和___________ 。得到碳酸锂沉淀的操作为___________ (填标号)。
(5)常温下,取 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为___________ g[已知常温下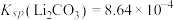 。计算结果保留3位小数。
。计算结果保留3位小数。
(6)由 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。 在晶胞中的位置为
在晶胞中的位置为___________ 。
② 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为___________ nm(列出计算式,阿伏加德罗常数的值为 )。
)。
(1)Co在元素周期表的位置是
(2)“烧渣”是LiCl、CoCl2和SiO2的混合物。“
 焙烧”反应生成的氧化产物与还原产物的物质的量之比为
焙烧”反应生成的氧化产物与还原产物的物质的量之比为(3)“滤饼2”的主要成分为
 烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为
烧结可合成锂电池正极材料LiCoO2,反应的化学方程式为(4)碳酸锂的溶解度随温度变化如图所示。向滤液2中加入Na2CO3溶液,将温度升至90℃是为了提高沉淀反应速率和
(5)常温下,取
 “滤液2”,其中
“滤液2”,其中 ,为使锂元素的回收率不低于
,为使锂元素的回收率不低于 ,则至少应加入
,则至少应加入 固体的质量为
固体的质量为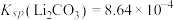 。计算结果保留3位小数。
。计算结果保留3位小数。(6)由
 进一步制得的
进一步制得的 具有反萤石结构,晶胞如图所示。
具有反萤石结构,晶胞如图所示。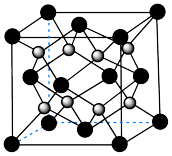
 在晶胞中的位置为
在晶胞中的位置为②
 晶体的密度为
晶体的密度为 ,则晶胞参数(棱长)为
,则晶胞参数(棱长)为 )。
)。
您最近半年使用:0次
解题方法
2 . 高纯硫酸锰作为合成镍钴锰三元聚合物锂电池的正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺流程如下图所示:
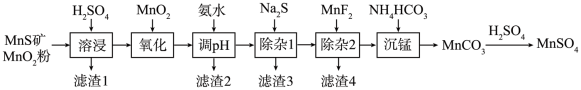
相关金属离子形成氢氧化物沉淀的pH范围如下:
请回答:
(1)“溶浸”步骤中,可加快溶浸速率的措施有___________ (写两条)。
(2)下列有关该工艺流程的叙述正确的是___________。
(3)“除杂2”步骤的目的是生成MgF2沉淀从而除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,请从平衡移动的角度解释其原因___________ 。
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。______
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
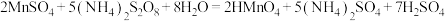
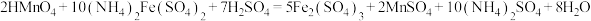 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
用___________ 称量 MnSO4样品0.250g→用100mL容量瓶将MnSO4样品配成100mL溶液→用___________ 取待测液25.00mL于锥形瓶中→加入适量硫磷混合酸和硝酸银,再加入足量过硫酸铵充分反应→加热煮沸除去多余的过硫酸铵→用酸式滴定管盛装0.1000mol/L(NH4)2Fe(SO4)2标准溶液,滴定3次,分别消耗20.04mL、19.30mL、19.96mL。
②根据以上数据计算样品中MnSO4的质量分数___________ 。

相关金属离子形成氢氧化物沉淀的pH范围如下:
| 金属离子 |  |  |  |  |  |  |  |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“溶浸”步骤中,可加快溶浸速率的措施有
(2)下列有关该工艺流程的叙述正确的是___________。
| A.“溶浸”步骤中的“滤渣1”的主要成分是S和SiO2(或不溶性硅酸盐) |
| B.“氧化”步骤中添加的MnO2的作用是催化剂 |
| C.“调pH”步骤中,溶液的pH范围应调节为4.7~6 |
D.“沉锰”步骤的离子方程式为 |
(4) MnCO3加入足量稀硫酸充分溶解后,经过一系列操作可得较纯的MnSO4晶体。这一系列操作是______→______→过滤→______→______→纯净的MnSO4晶体。
(5) Mn2+含量可通过过硫酸铵—硫酸亚铁铵法进行测定。其原理是将试样溶于硫酸中,使溶液中的Mn2+在硫磷混合酸的作用下,以硝酸银为催化剂,用过硫酸铵把Mn2+氧化为高锰酸,然后以标准硫酸亚铁铵溶液滴定高锰酸,根据标准液消耗量计算Mn2+的含量。相关方程式如下:
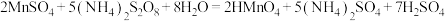
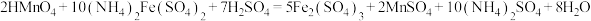 ①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:
①测定操作步骤如下,在横线内填写一件最关键仪器补全步骤:用
②根据以上数据计算样品中MnSO4的质量分数
您最近半年使用:0次
解题方法
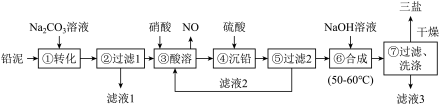
3 . 三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。
已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
(1)步骤①转化的目的是_______ ,滤液1中的溶质为Na2CO3和_______ (填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________ (任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________ 。
(3)滤液2中可循环利用的溶质的化学式为_______ 。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______ mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________ 。
(5)步骤⑥合成三盐的化学方程式为____________ ,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________ 。

已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
| 化合物 | PbSO4 | PbCO3 |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 |
| Ksp | 1.82×10-8 | 1.46×10-13 |
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是
(3)滤液2中可循环利用的溶质的化学式为
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是
(5)步骤⑥合成三盐的化学方程式为
您最近半年使用:0次



