名校
解题方法
1 . 下列关于离子检验的说法错误的是
A.向溶液中加入稀氢氧化钠溶液,若未产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中不含 |
B.向溶液中加入 溶液,产生白色沉淀,再加稀盐酸,沉淀不消失,不能证明原溶液中一定有 溶液,产生白色沉淀,再加稀盐酸,沉淀不消失,不能证明原溶液中一定有 |
C.向溶液中加入盐酸酸化的 溶液,有白色沉淀生成,不能证明原溶液中一定有 溶液,有白色沉淀生成,不能证明原溶液中一定有 |
D.NaOH溶液、 溶液、 溶液、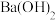 溶液三种无色溶液,用稀 溶液三种无色溶液,用稀 能一次性鉴别出来 能一次性鉴别出来 |
您最近半年使用:0次
2 . 下列方案设计、现象和结论都正确的是
| 选项 | 实验目的 | 方案设计 | 现象和结论 |
| A | 检验溶液中是否含 | 先向某溶液中加入稀盐酸酸化,再加入 溶液 溶液 | 若有白色沉淀,说明含有 |
| B | 探究铁粉在氯气中燃烧所得固体粉末的成分 | 取少量固体粉末,加入2~3mL蒸馏水,振荡,迅速滴入5滴15%KSCN溶液,观察 | 若溶液不显血红色,则固体粉末中无 |
| C | 探究金属钠表面被氧化后固体的成分 | 取少量该钠固体,放入盛有水的烧杯中,观察 | 若无气体生成,则只有 ;若有气体生成,则固体中一定含 ;若有气体生成,则固体中一定含 |
| D | 鉴别 与 与 | 取适量固体于试管,插入温度计,加少量水,温度降低 | 该固体是 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-12-11更新
|
123次组卷
|
2卷引用:浙江省绍兴市第一中学2023-2024学年高一上学期11月期中考试(平行班)化学试题
名校
解题方法
3 . 过硫酸钾(K2S2O8)可用作破胶剂、聚合促进剂、氧化剂、分析试剂等,100℃时分解。实验小组对过硫酸钾进行相关探究,回答下列问题:
(1)K2S2O8中硫元素化合价为___________ 价,K2S2O8可用于检验酸性溶液中的Mn2+,在催化剂的作用下可发生氧化还原反应,溶液变为紫红色,写出该反应的离子方程式___________ 。
(2)小组同学预测过硫酸钾的分解产物有K2SO4、SO3、SO2和O2,并用下图所示装置验证分解产物中含有SO3和SO2 (部分夹持及加热仪器已省略)。
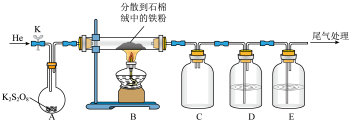
①装置E中盛放的试剂为___________ (填字母)。装置D中有气泡冒出,还观察到的现象是___________ 。
a.品红溶液 b.NaOH溶液 c.BaCl2溶液 d. Ba(NO3)2溶液 e.浓硫酸
②实验时,通入He排尽装置中的空气后,应先加热装置___________ (填“A”或“B”),其中装置A适合的加热方式为___________ 。
③装置B中石棉线的作用为___________ 。
(3)工业上利用K2S2O8能将低价氮氧化为 ,来测定废水中氮元素的含量。取100mL含NH4NO3的废水,用c mol/L的K2S2O8标准溶液滴定(杂质不参加反应),达到滴定终点时消耗标准溶液的体积为VmL,则废水中氮元素的含量为
,来测定废水中氮元素的含量。取100mL含NH4NO3的废水,用c mol/L的K2S2O8标准溶液滴定(杂质不参加反应),达到滴定终点时消耗标准溶液的体积为VmL,则废水中氮元素的含量为___________ mg/L。
(1)K2S2O8中硫元素化合价为
(2)小组同学预测过硫酸钾的分解产物有K2SO4、SO3、SO2和O2,并用下图所示装置验证分解产物中含有SO3和SO2 (部分夹持及加热仪器已省略)。

①装置E中盛放的试剂为
a.品红溶液 b.NaOH溶液 c.BaCl2溶液 d. Ba(NO3)2溶液 e.浓硫酸
②实验时,通入He排尽装置中的空气后,应先加热装置
③装置B中石棉线的作用为
(3)工业上利用K2S2O8能将低价氮氧化为
 ,来测定废水中氮元素的含量。取100mL含NH4NO3的废水,用c mol/L的K2S2O8标准溶液滴定(杂质不参加反应),达到滴定终点时消耗标准溶液的体积为VmL,则废水中氮元素的含量为
,来测定废水中氮元素的含量。取100mL含NH4NO3的废水,用c mol/L的K2S2O8标准溶液滴定(杂质不参加反应),达到滴定终点时消耗标准溶液的体积为VmL,则废水中氮元素的含量为
您最近半年使用:0次
名校
解题方法
4 . 侯氏制碱法又称联合制碱法,实验室模拟侯氏制碱法的工艺流程如图所示。下列说法错误的是

A.向饱和食盐水中通入的气体为氨气和 |
B.该反应利用了 溶解度小的特点 溶解度小的特点 |
C.检验 固体中是否混有 固体中是否混有 可用 可用 溶液 溶液 |
D.由 固体制备纯碱的操作是在坩埚中加热灼烧 固体制备纯碱的操作是在坩埚中加热灼烧 固体 固体 |
您最近半年使用:0次
2023-11-22更新
|
98次组卷
|
2卷引用:安徽省亳州市第二完全中学2023-2024学年高一上学期期中考试化学试题
解题方法
5 . 请分别写出鉴别以下各组固体物质详细的实验操作及现象:
(1)氯化钠和碳酸钠:___________ 。
(2)碳酸钠和碳酸氢钠:___________ 。
(3)氯化钠和氯化钾:___________ 。
(1)氯化钠和碳酸钠:
(2)碳酸钠和碳酸氢钠:
(3)氯化钠和氯化钾:
您最近半年使用:0次
6 . 下列各组物质的鉴别方法错误的是
| 选项 | 物质 | 鉴别方法 |
| A | CO(g)和 | 分别通入澄清石灰水 |
| B |  和 和 | 分别取少许试剂加入金属钠 |
| C | 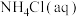 和 和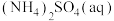 | 分别取少许试剂加入 溶液 溶液 |
| D |  和 和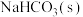 | 分别取少许固体加入盐酸中 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2023-11-10更新
|
155次组卷
|
3卷引用:江西省赣州市部分市县学校2023-2024学年高三上学期期中考试化学试题
7 . 根据所学知识回答下列问题:
(1)关于物质的分类,下列组合中正确的是___________(填标号)。
(2)火法炼锌反应的化学方程式为 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。
(3)铜器在空气中久置会和空气中的水蒸气、CO2、O2作用产生绿锈,该绿锈俗称铜绿,又称孔雀石[主要成分为Cu2(OH)2CO3],铜绿能与酸反应生成铜盐、CO2和H2O。
①上述描述中生成铜绿反应的化学方程式为___________ ,该反应的反应类型为___________ 。
②将少量的铜绿粉末加入足量的稀盐酸中,可观察到的现象为___________ 。
(4)现有KOH、NaHCO3和BaCl2三种无色溶液,仅选用一种试剂把它们鉴别出来,该试剂可能为___________ (填化学式)。
(5)已知:硝酸具有强氧化性,其溶液的质量分数越大,氧化性越强,质量分数越小,氧化性越弱。现将少量铁粉加入质量分数很小的硝酸中,发生的反应为Fe+HNO3→Fe(NO3)3+NH4NO3+H2O,则该反应配平后的化学方程式为___________ 。
(1)关于物质的分类,下列组合中正确的是___________(填标号)。
| 选项 | 酸 | 盐 | 氧化物 | 纯净物 |
| A | HCl | CaSO4 | SO2 | O3 |
| B | HNO3 | FeCl2 | KMnO4 | He |
| C | H3PO4 | CuSO4 | Al2O3 | 纯净的空气 |
| D | H2S | KAl(SO4)2∙12H2O | Fe2O3 | 氢氧化钠溶液 |
| A.A | B.B | C.C | D.D |
 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。| A.常温下,碳的化学性质很活泼 | B.CO用作还原剂时,失去电子 |
| C.ZnCO3中氧元素的质量分数为38.4% | D.该反应中,还原性:C<Zn |
①上述描述中生成铜绿反应的化学方程式为
②将少量的铜绿粉末加入足量的稀盐酸中,可观察到的现象为
(4)现有KOH、NaHCO3和BaCl2三种无色溶液,仅选用一种试剂把它们鉴别出来,该试剂可能为
(5)已知:硝酸具有强氧化性,其溶液的质量分数越大,氧化性越强,质量分数越小,氧化性越弱。现将少量铁粉加入质量分数很小的硝酸中,发生的反应为Fe+HNO3→Fe(NO3)3+NH4NO3+H2O,则该反应配平后的化学方程式为
您最近半年使用:0次
8 . 下列实验中,能达到相应实验目的的是
A.除去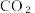 中混有的CO:在足量的氧气中点燃 中混有的CO:在足量的氧气中点燃 |
| B.分离Fe和Cu固体:加足量稀硫酸溶解,过滤、洗涤、干燥 |
C.检验 溶液中混有NaCl:取样,滴加硝酸银溶液,观察是否白色沉淀 溶液中混有NaCl:取样,滴加硝酸银溶液,观察是否白色沉淀 |
D.鉴别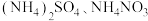 两种氮肥:取样,分别加入 两种氮肥:取样,分别加入 溶液,观察现象 溶液,观察现象 |
您最近半年使用:0次
解题方法
9 . 下列有关物质检验和鉴别的说法错误的是
| A.用焰色试验检验溶液中是否含K元素 |
| B.用湿润的蓝色石蕊试纸可鉴别Cl2和HCl |
| C.用氯化钡溶液可鉴别Na2CO3和Na2SO3粉末 |
| D.用KSCN溶液检验FeSO4是否变质 |
您最近半年使用:0次
名校
解题方法
10 . FeSO4·7H2O 广泛用于医药和工业领域。下面是以工业废铁屑为原料生产FeSO4·7H2O 的流程图。

(1)加适量碳酸钠溶液的目的是___________ ,反应Ⅰ需要加热数分钟,其原因是___________ 。
(2)判断反应Ⅱ完成的现象是___________ 。反应Ⅱ需要 100mL1mol/L 的稀硫酸,用 98.3%,ρ=1.84g/cm3 的浓硫酸配制。所用的仪器除量筒、烧杯、玻璃棒外,还需要玻璃仪器___________ 。
(3)测定 FeSO4·7H2O 产品中 Fe2+含量的方法是用 KMnO4溶液滴定法(5Fe2++MnO +8H+= 5Fe3++Mn2++4H2O),步骤为:
+8H+= 5Fe3++Mn2++4H2O),步骤为:
Ⅰ.称取 2.8500g FeSO4·7H2O 产品,配制成 250mL 溶液;
Ⅱ.量取 25.00mL 待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的 0.0100moL/L KMnO4溶液滴定至终点,消耗 KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的现象是___________ ;
②计算上述样品中 FeSO4·7H2O 的质量分数为___________ (用小数表示,保留三位小数);
(4)已知 FeSO4·7H2O 晶体在加热条件下发生如下反应:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。

①仪器的连接顺序为 a___________ 。
②装置 C 中的 X 为___________ ;该装置中冷水的作用是___________ 。

(1)加适量碳酸钠溶液的目的是
(2)判断反应Ⅱ完成的现象是
(3)测定 FeSO4·7H2O 产品中 Fe2+含量的方法是用 KMnO4溶液滴定法(5Fe2++MnO
 +8H+= 5Fe3++Mn2++4H2O),步骤为:
+8H+= 5Fe3++Mn2++4H2O),步骤为:Ⅰ.称取 2.8500g FeSO4·7H2O 产品,配制成 250mL 溶液;
Ⅱ.量取 25.00mL 待测溶液于锥形瓶中;
Ⅲ.用硫酸酸化的 0.0100moL/L KMnO4溶液滴定至终点,消耗 KMnO4溶液体积的平均值为 20.00mL。
①判断此滴定实验达到终点的现象是
②计算上述样品中 FeSO4·7H2O 的质量分数为
(4)已知 FeSO4·7H2O 晶体在加热条件下发生如下反应:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
Fe2O3+SO2↑+SO3↑+14H2O↑。利用下图装置可检验该反应的气体产物。
①仪器的连接顺序为 a
②装置 C 中的 X 为
您最近半年使用:0次



