名校
解题方法
1 . 下图是某同学设计的木炭和浓硫酸反应并检验所得产物的实验装置。
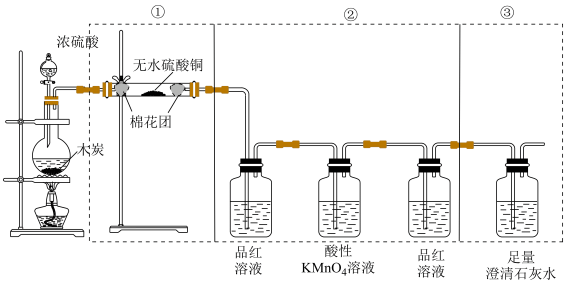
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:___________ 。
(2)②中酸性 溶液的作用是
溶液的作用是___________ ,第二瓶品红溶液的作用是___________ 。
(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是______ ;不能检出的物质是________ 。
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是___________ ;不能检出的物质是___________ 。
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装___________ (填写试剂名称)。

(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(2)②中酸性
 溶液的作用是
溶液的作用是(3)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是
(4)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是
(5)有同学希望通过测量③中装置质量的增加来计算反应的木炭的质量,则在②③之间插入一个洗气瓶,其中装
您最近半年使用:0次
名校
解题方法
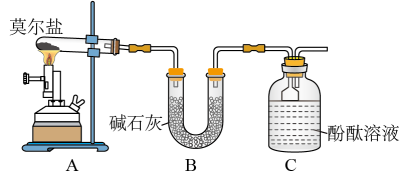
2 . 已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
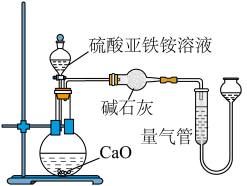
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 |  |  | 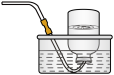 |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近半年使用:0次
2023-01-21更新
|
752次组卷
|
3卷引用:山东省青岛第五十八中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
3 . 摩尔盐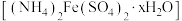 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是___________ 。
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有___________ 。取样品 加热至两次质量恒重为
加热至两次质量恒重为 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为___________ (用含a、b的代数式表示)。
(3)利用摩尔盐分解产生的 ,可制取氯化亚砜
,可制取氯化亚砜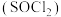 :
: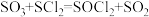 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
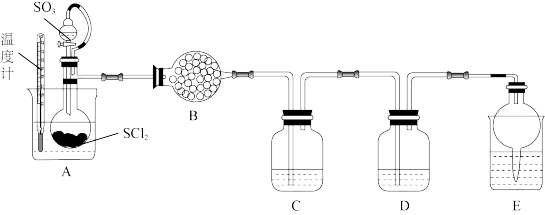
①装置B为无水 ,其作用是
,其作用是___________ 。
②装置C和装置D中的试剂分别是___________ 、___________ (填小写字母)。
a. 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液
(4)利用摩尔盐分解产生的 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
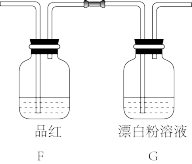
①将少量 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是___________ (用化学反应方程式表示)。
②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是___________ ,其作用是___________ ,通过___________ (填现象)即可证明亚硫酸的酸性强于次氯酸。
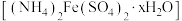 比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:
比一般的亚铁盐更稳定,是一种重要的定量分析化学试剂。回答下列问题:(1)制备摩尔盐采用的方法是先在封闭体系中利用铁和稀硫酸反应制备硫酸亚铁溶液,再用新制的硫酸亚铁溶液和硫酸按饱和溶液反应制得。配制硫酸按饱和溶液的蒸馏水,需经煮沸并迅速冷却后再使用,目的是
(2)可以采用热重分析法测定摩尔盐样品中所含结晶水的个数,加热其晶体需要使用的实验仪器除了玻璃棒、三脚架、泥三角、酒精灯外,还需要的仪器有
 加热至两次质量恒重为
加热至两次质量恒重为 (假设减少的质量仅仅是晶体失水),则x的表达式为
(假设减少的质量仅仅是晶体失水),则x的表达式为(3)利用摩尔盐分解产生的
 ,可制取氯化亚砜
,可制取氯化亚砜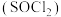 :
: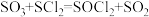 。已知
。已知 是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取
是一种液态化合物,遇水产生白雾和一种刺激性气体。利用如图装置制取 并检验生成的
并检验生成的 。
。
①装置B为无水
 ,其作用是
,其作用是②装置C和装置D中的试剂分别是
a.
 溶液 b.
溶液 b. 和
和 溶液 c.
溶液 c. 溶液 d.饱和的
溶液 d.饱和的 溶液
溶液(4)利用摩尔盐分解产生的
 ,设计实验探究亚硫酸与次氯酸的酸性强弱。
,设计实验探究亚硫酸与次氯酸的酸性强弱。
①将少量
 气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是
气体直接通入装置G中,不能根据装置G中现象判断亚硫酸与次氯酸的酸性强弱,理由是②为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置F中另一种试剂是
您最近半年使用:0次
2022-07-15更新
|
298次组卷
|
2卷引用:河南省开封市五县2021-2022学年高二下学期期末考试化学试题
解题方法
4 . 一种活性氧食器消毒剂的主要成分是过碳酸钠(xNa2CO3·yH2O2)。过碳酸钠具有Na2CO3和H2O2的双重性质,50℃开始分解。某实验小组同学对过碳酸钠的制备、组成与性质进行了探究。
(一)过碳酸钠的制备
实验室用Na2CO3与稳定剂的混合溶液5%的H2O2化合制备过碳酸钠,实验装置如图:
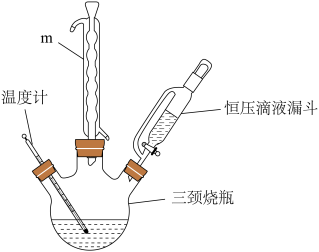
(1)仪器m的名称为___ 。
(2)恒压滴液漏斗盛装的药品是___ 。
(3)下列可用作稳定剂的是__ 。(填选项字母)。
A.FeCl3 B.CH3COOH C.Na3PO4 D.MnO2
(4)为更好的控制反应温度,采用的合适加热方式是___ 。
(二)过碳酸钠(xNa2CO3·yH2O2)组成的测定
(5)采用加热法可测定过碳酸钠(xNa2CO3·yH2O2)的组成。称取ag过碳酸钠固体样品,加热至恒重后,冷却,称量固体质量为bg。通过上述数据计算:y=__ 用含a、b、x的代数式表示)。
(三)过碳酸钠的性质
活性氧食器消毒剂可用于清洗杯温,使用说明如图所示:

(6)使用时,需要使用80°C以上热水的原因为___ 。
(7)使用时会迅速产生大量气泡,实验室检验该气体的方法为___ 。
(一)过碳酸钠的制备
实验室用Na2CO3与稳定剂的混合溶液5%的H2O2化合制备过碳酸钠,实验装置如图:

(1)仪器m的名称为
(2)恒压滴液漏斗盛装的药品是
(3)下列可用作稳定剂的是
A.FeCl3 B.CH3COOH C.Na3PO4 D.MnO2
(4)为更好的控制反应温度,采用的合适加热方式是
(二)过碳酸钠(xNa2CO3·yH2O2)组成的测定
(5)采用加热法可测定过碳酸钠(xNa2CO3·yH2O2)的组成。称取ag过碳酸钠固体样品,加热至恒重后,冷却,称量固体质量为bg。通过上述数据计算:y=
(三)过碳酸钠的性质
活性氧食器消毒剂可用于清洗杯温,使用说明如图所示:

(6)使用时,需要使用80°C以上热水的原因为
(7)使用时会迅速产生大量气泡,实验室检验该气体的方法为
您最近半年使用:0次
名校
解题方法
5 . 某实验课题小组的同学在实验室利用新制备的硫酸亚铁溶液制备硫酸亚铁铵(俗名为莫尔盐)[(NH4)2SO4·FeSO4·6H2O](相对分子质量为392),该晶体比一般亚铁盐稳定,易溶于水,不溶于乙醇。
(一)制备硫酸亚铁溶液(实验步骤如图所示)
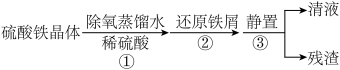
(1)步骤①,加入稀硫酸的目的是_____ 。
(2)步骤②,加入还原铁屑后观察到的现象是___ 。实验前,常用碱溶液洗涤铁屑,其目的是__ 。
(二)制备莫尔盐(硫酸亚铁铵)
(3)在FeSO4溶液中加入稍过量的硫酸铵饱和溶液。从溶液中提取(NH4)2SO4·FeSO4·6H2O的具体操作是____ 、用乙醇洗涤、干燥。
(三)检验莫尔盐加热时的分解产物
莫尔盐受热分解,甲同学认为分解产物可能有以下几种情况:
a. Fe2O3、SO3、NH3、H2O b. FeO、NH3、SO3、H2O
c. FeO、SO2、NH3、H2O d. Fe2O3、NH3、SO2、SO3、H2O
(4)经认真分析,推理即可确定猜想_______ (填序号)不成立。
(5)乙同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,乙同学用下列装置进行实验:

①乙同学的实验中,装置依次连接的合理顺序为A→H→_____ →G 。
②证明分解产物中含有SO3的实验现象是_____ 。
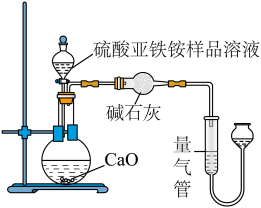
(四)测定实验(二)所得晶体中(NH4)2SO4·FeSO4·6H2O的纯度
称取m g硫酸亚铁铵样品配制成500 mL溶液,取20.00 mL样品溶液进行实验,装置如图所示。
(6)若实验测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵样品的纯度为____ (列出计算式即可)。
(一)制备硫酸亚铁溶液(实验步骤如图所示)

(1)步骤①,加入稀硫酸的目的是
(2)步骤②,加入还原铁屑后观察到的现象是
(二)制备莫尔盐(硫酸亚铁铵)
(3)在FeSO4溶液中加入稍过量的硫酸铵饱和溶液。从溶液中提取(NH4)2SO4·FeSO4·6H2O的具体操作是
(三)检验莫尔盐加热时的分解产物
莫尔盐受热分解,甲同学认为分解产物可能有以下几种情况:
a. Fe2O3、SO3、NH3、H2O b. FeO、NH3、SO3、H2O
c. FeO、SO2、NH3、H2O d. Fe2O3、NH3、SO2、SO3、H2O
(4)经认真分析,推理即可确定猜想
(5)乙同学认为莫尔盐分解的产物中可能含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,乙同学用下列装置进行实验:

①乙同学的实验中,装置依次连接的合理顺序为A→H→
②证明分解产物中含有SO3的实验现象是
(四)测定实验(二)所得晶体中(NH4)2SO4·FeSO4·6H2O的纯度
称取m g硫酸亚铁铵样品配制成500 mL溶液,取20.00 mL样品溶液进行实验,装置如图所示。
(6)若实验测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵样品的纯度为

您最近半年使用:0次
解题方法
6 . 草酸亚铁晶体( )常用于晒制蓝图。某研究性学习小组对其进行了系列探究。
)常用于晒制蓝图。某研究性学习小组对其进行了系列探究。
I.纯净的草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究,小组成员采用如下装置(可重复选用)进行实验:
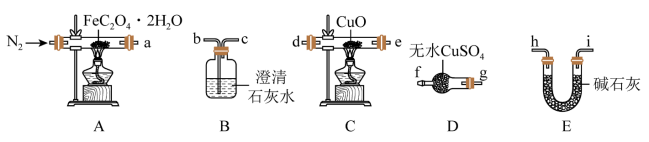
①E中盛装碱石灰的仪器名称为__________________ 。
②按照气流从左到右的方向,上述装置的接口顺序为
___________ 尾气处理装置。
③实验前先通入一段时间 ,其目的是
,其目的是________________________ 。
④实验证明气体产物中含有 ,依据的实验现象为
,依据的实验现象为_________________________________ 。
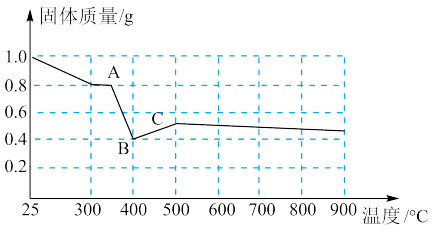
(2) 受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,
受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时, 晶体受热分解的化学方程式
晶体受热分解的化学方程式_________________________ 。
(3)晒制蓝图时,以 溶液为显色剂,写出
溶液为显色剂,写出 与
与 溶液反应的化学方程式
溶液反应的化学方程式____________ 。
Ⅱ.草酸亚铁晶体样品纯度的测定
(4)工业制得的草酸亚铁晶体中常含有 杂质测定其纯度的步骤如下:
杂质测定其纯度的步骤如下:
步骤1:称取 草酸亚铁晶体样品溶于稀
草酸亚铁晶体样品溶于稀 中,配成
中,配成 溶液;
溶液;
步骤2:取上述溶液 ,用
,用 ,标准液滴定至终点消耗标准液
,标准液滴定至终点消耗标准液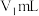 ;
;
步骤3:向反应后溶液中加入适量锌粉充分反应后加入适量稀 ,再用
,再用 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液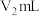
①步骤2中滴定终点的现象为_______________ ,,步骤3中加入锌粉的目的是__________________ 。
②草酸亚铁晶体样品的纯度为_________________ (写出计算表达式)。
 )常用于晒制蓝图。某研究性学习小组对其进行了系列探究。
)常用于晒制蓝图。某研究性学习小组对其进行了系列探究。I.纯净的草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究,小组成员采用如下装置(可重复选用)进行实验:

①E中盛装碱石灰的仪器名称为
②按照气流从左到右的方向,上述装置的接口顺序为
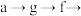
③实验前先通入一段时间
 ,其目的是
,其目的是④实验证明气体产物中含有
 ,依据的实验现象为
,依据的实验现象为(2)
 受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时,
受热分解时,固体质量随温度变化的曲线如下图所示,写出加热到400℃时, 晶体受热分解的化学方程式
晶体受热分解的化学方程式
(3)晒制蓝图时,以
 溶液为显色剂,写出
溶液为显色剂,写出 与
与 溶液反应的化学方程式
溶液反应的化学方程式Ⅱ.草酸亚铁晶体样品纯度的测定
(4)工业制得的草酸亚铁晶体中常含有
 杂质测定其纯度的步骤如下:
杂质测定其纯度的步骤如下:步骤1:称取
 草酸亚铁晶体样品溶于稀
草酸亚铁晶体样品溶于稀 中,配成
中,配成 溶液;
溶液;步骤2:取上述溶液
 ,用
,用 ,标准液滴定至终点消耗标准液
,标准液滴定至终点消耗标准液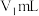 ;
;步骤3:向反应后溶液中加入适量锌粉充分反应后加入适量稀
 ,再用
,再用 标准液滴定至终点,消耗标准液
标准液滴定至终点,消耗标准液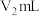
①步骤2中滴定终点的现象为
②草酸亚铁晶体样品的纯度为
您最近半年使用:0次
解题方法
7 . 无水AlCl 3 易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al 2 O 3 和Fe 2 O 3 ,还含有少量的SiO 2 )和石油焦(主要成分是C)为原料制备无水AlCl 3 :2Al 2 O 3 +6Cl 2 ===4AlCl 3 +3O 2
回答以下问题:
(1)Cl-的电子式为________ 。Al在元素周期表最中的位置是________ 。
(2)生产中加入石油焦,其目的是_____________________________________ 。
(3)加入焦炭后的化学反应可表示为Al2O3 +C+Cl2 AlCl3 +X↑,设计实验确定气体X的成分:
AlCl3 +X↑,设计实验确定气体X的成分: ____________________________________ 。
(4)在提纯AlCl3 粗产品时,需加入少量铝粉,可使熔点较低的FeCl3 转化为熔点较高的FeCl2 ,从而避免在AlCl3 中混入铁的氯化物。该反应的化学方程式为___________________________________ 。
(5)为测定制得的无水AlCl3 产品(含FeCl3 杂质)的纯度,称取16.25 g无水AlCl3 样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式__________________________ 、___________ 。
②AlCl3 产品的纯度为__________________________________ 。
(6)以铝土矿为原料可以通过以下途径提纯氧化铝

①写出滤液甲中溶质的化学式______________________________ 。
②写出滤液乙中加入过量氨水得到Al(OH)3 的离子方程式__________________ 。
回答以下问题:
(1)Cl-的电子式为
(2)生产中加入石油焦,其目的是
(3)加入焦炭后的化学反应可表示为Al2O3 +C+Cl2
 AlCl3 +X↑,设计实验确定气体X的成分:
AlCl3 +X↑,设计实验确定气体X的成分: (4)在提纯AlCl3 粗产品时,需加入少量铝粉,可使熔点较低的FeCl3 转化为熔点较高的FeCl2 ,从而避免在AlCl3 中混入铁的氯化物。该反应的化学方程式为
(5)为测定制得的无水AlCl3 产品(含FeCl3 杂质)的纯度,称取16.25 g无水AlCl3 样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式
②AlCl3 产品的纯度为
(6)以铝土矿为原料可以通过以下途径提纯氧化铝

①写出滤液甲中溶质的化学式
②写出滤液乙中加入过量氨水得到Al(OH)3 的离子方程式
您最近半年使用:0次



