名校
解题方法
1 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
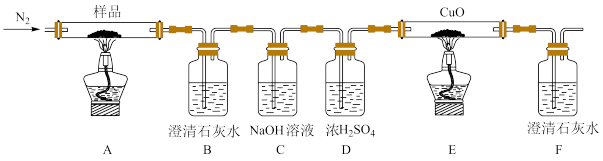
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

①配制溶液:实验中配制100mL1.0
 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。

②测定:称量10.00g晶体样品,加1.0
 溶解后配成100
溶解后配成100 溶液。
溶液。
步骤Ⅰ 取20.00 配制好的溶液于锥形瓶中,滴加0.2000
配制好的溶液于锥形瓶中,滴加0.2000
 溶液至恰好完全反应。该操作的目的是
溶液至恰好完全反应。该操作的目的是_______ 。
步骤Ⅱ 向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用0.2000
酸化,用0.2000
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00
溶液20.00 。
。
该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:


①配制溶液:实验中配制100mL1.0

 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加1.0

 溶解后配成100
溶解后配成100 溶液。
溶液。步骤Ⅰ 取20.00
 配制好的溶液于锥形瓶中,滴加0.2000
配制好的溶液于锥形瓶中,滴加0.2000
 溶液至恰好完全反应。该操作的目的是
溶液至恰好完全反应。该操作的目的是步骤Ⅱ 向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用0.2000
酸化,用0.2000
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00
溶液20.00 。
。该晶体样品中铁的质量分数为
您最近一年使用:0次
名校
解题方法
2 . 盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室必备的重要试剂
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有___________ 性;硝酸应保存在棕色瓶中,这是因为硝酸具有___________ 性。
(2)如图是硫酸试剂瓶标签上的部分内容,该硫酸的浓度是___________ ;实验人员操作时不必需穿戴的安全用具是___________ 。
A.防护手套 B.实验服 C.防毒面具 D.护目镜
(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式_________________ 。
(4)实验室中向烧杯内加入约20g蔗糖,向其中插入玻璃棒,滴加几滴蒸馏水,再加入适量浓硫酸。白色的蔗糖变为疏松多孔的黑色物质,放出大量的热使烧杯壁发烫。验证产生的气体有SO2的方法是___________________ ,验证该气体中还含有CO2的方法是_______________________ 。
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有
(2)如图是硫酸试剂瓶标签上的部分内容,该硫酸的浓度是
| 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数: 98.9% |
(3)在稀硝酸溶液中加入铜片使之充分反应,写出反应的离子方程式
(4)实验室中向烧杯内加入约20g蔗糖,向其中插入玻璃棒,滴加几滴蒸馏水,再加入适量浓硫酸。白色的蔗糖变为疏松多孔的黑色物质,放出大量的热使烧杯壁发烫。验证产生的气体有SO2的方法是
您最近一年使用:0次
2023-04-23更新
|
73次组卷
|
2卷引用:广东省惠州市惠阳区部分学校2022-2023学年高一下学期期中联考化学试题
3 . 蛋白质是生命的物质基础。某学习小组实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是_______ 。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。
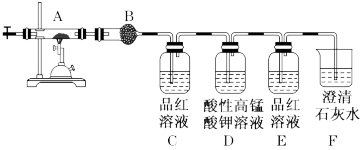
①装置B中的试剂是_______ 。
②装置D的作用是_______ 。
③当装置B、C、E、F依次出现下列现象:_______ ,品红溶液褪色,_______ ,出现白色浑浊;可证明燃烧产物中含有H2O,SO2>CO2,结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2 +I2=
+I2= +2I-
+2I-
(3)写出二氧化硫与碘水反应的化学方程式:_______ 。
(4)滴定终点的现象为_______ 。
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为_______ 。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值_______ (填“偏大*偏小”或“无影响”)。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是
②装置D的作用是
③当装置B、C、E、F依次出现下列现象:
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2
 +I2=
+I2= +2I-
+2I-(3)写出二氧化硫与碘水反应的化学方程式:
(4)滴定终点的现象为
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值
您最近一年使用:0次
解题方法
4 . 某化学小组制备 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):

(1)仪器a的名称是___________ 。
(2)装置A制取 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的___________ 性,___________ (填“能”或“不能”)用浓硝酸代替。
(3)在滴加浓硫酸之前,需先通入一段时间的 ,此操作的目的是
,此操作的目的是___________ 。
(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为___________ 。
(5)装置D验证了 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:___________ 。
(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: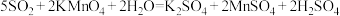 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为___________ 。
 并验证
并验证 的部分性质,装置如图所示(部分夹持装置省略):
的部分性质,装置如图所示(部分夹持装置省略):
(1)仪器a的名称是
(2)装置A制取
 的反应中,利用了浓硫酸的
的反应中,利用了浓硫酸的(3)在滴加浓硫酸之前,需先通入一段时间的
 ,此操作的目的是
,此操作的目的是(4)装置B中的反应生成乳白色浑浊的同时生成了一种强碱,则该反应的化学方程式为
(5)装置D验证了
 的漂白性,为了进一步探究
的漂白性,为了进一步探究 与品红作用的可逆性,请写出有关实验操作及现象:
与品红作用的可逆性,请写出有关实验操作及现象:(6)为测定装置E中收集到的混合气体中二氧化硫的含量,进行如下操作:

当注入标准状况下10mL混合气体时,酸性
 ,溶液恰好褪色,假设混合气体中
,溶液恰好褪色,假设混合气体中 能被
能被 溶液充分吸收。已知:
溶液充分吸收。已知: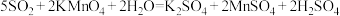 。该混合气体中二氧化硫的体积分数为
。该混合气体中二氧化硫的体积分数为
您最近一年使用:0次
2022-07-04更新
|
280次组卷
|
2卷引用:河南省平顶山市2021-2022学年高一下学期期末调研化学试题
5 . 氮化镁(Mg3N2)可用于核废料的回收,常温下为浅黄色粉末,易水解。某兴趣小组拟在实验室里通过氮气和镁粉反应制取少量氮化镁(Mg3N2),制备装置示意图如下。
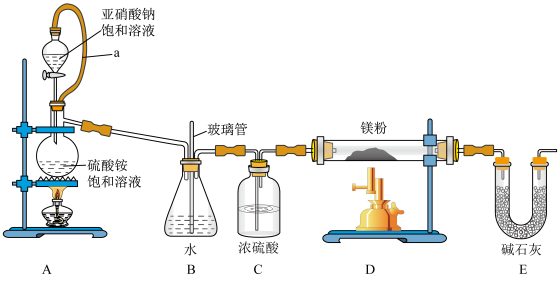
(1)工业上通常通过______________________ 获取氮气。
(2)装置A中橡胶管a的作用是______________________ 。
(3)NaNO2和(NH4)2SO4反应制备氮气的离子方程式______________________ 。
(4)装置B的作用为______________________ 。
(5)检验Mg3N2水解生成气体为NH3的方法为:取适量样品放入试管中,滴加蒸馏水,加热试管,_________________________________ (填操作与现象)。
(6)为测定产物中Mg3N2纯度,该小组称取4.0g样品加入足量10%NaOH溶液并加热,生成的气体全部用100.00mL 0.500mol·L-1的硫酸溶液吸收。将所得溶液稀释到250.00mL,取25.00mL该溶液,用0.2000mol·L-1NaOH标准溶液滴定过剩的硫酸。重复实验平均消耗NaOH溶液25.25mL。样品中Mg3N2的质量分数为___________ (保留一位小数)。滴定过程中若有NaOH溶液溅出,测定结果将___________ (填“偏高”或“偏低”)

(1)工业上通常通过
(2)装置A中橡胶管a的作用是
(3)NaNO2和(NH4)2SO4反应制备氮气的离子方程式
(4)装置B的作用为
(5)检验Mg3N2水解生成气体为NH3的方法为:取适量样品放入试管中,滴加蒸馏水,加热试管,
(6)为测定产物中Mg3N2纯度,该小组称取4.0g样品加入足量10%NaOH溶液并加热,生成的气体全部用100.00mL 0.500mol·L-1的硫酸溶液吸收。将所得溶液稀释到250.00mL,取25.00mL该溶液,用0.2000mol·L-1NaOH标准溶液滴定过剩的硫酸。重复实验平均消耗NaOH溶液25.25mL。样品中Mg3N2的质量分数为
您最近一年使用:0次
6 . 为减少交通事故,新交规明令禁止酒后驾车并对酒后驾车行为予以重罚。为检验驾驶员是否酒后驾车,可采用的检验方法有多种。回答以下问题:
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是_____________ ;Y的化学式是_________ ;
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。
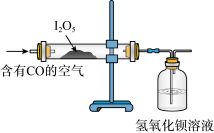
①指出能证明空气中有CO存在的现象:_____________ 。
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是________ 。
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?_________ 。
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是________________ 。
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式________ 。
(1)早期曾经采用五氧化二碘和某种高分子化合物X的混合溶液来检测酒精的存在。理是:I2O5与CH3CH2OH先发生反应(I2O5+5CH3CH2OH=I2+5Y+5H2O),生成的I2与高分子化合物X作用而变蓝。交警依据此原理来检测驾驶员是否饮酒。则:X的化学式是
(2)已知:I2O5是白色固体,可用于检验并定量测定空气中CO;两者在常温条件下发生的反应为5CO+I2O5=5CO2+I2(空气中其余气体不与I2O5反应);某同学设计如图实验装置完成上述目的。

①指出能证明空气中有CO存在的现象:
②将上述反应生成的碘单质用硫代硫酸钠滴定(反应为I2+2Na2S2O3=Na2S4O6+2NaI),即可根据消耗硫代硫酸钠的量来计算空气中CO的含量。若某次实验时测得参与反应的空气体积为a mL(标准状况下),滴定过程中,共消耗vmLcmol·L﹣1Na2S2O3溶液,则该空气样品中CO的体积分数是
③有同学提出只要依据参与反应的空气体积和洗气瓶中白色沉淀的质量也可求得空气中CO。此方案是否可行?
(3)燃料电池酒精检测仪(该电池以硫酸溶液为电解质溶液)也是检测酒精含量的一种方法。总反应是:CH3CH2OH+O2=CH3COOH+H2O。该电池负极电极反应式是
(4)酒精是一种较为环保的燃料,298K时,1g乙醇完全燃烧放出热量qkJ,写出乙醇燃烧的热化学方程式
您最近一年使用:0次
7 . 以下操作或结论正确的是
| A.用试纸检验气体时,必须将湿润的试纸沾在玻璃棒上伸向气体 |
| B.称取10.2gNaOH时,将10g的砝码放在右盘,并将游码移到0.2g的位置 |
| C.将铂丝放在稀硫酸中洗涤并灼烧后,再蘸取待检物进行焰色反应 |
| D.将20ml质量分数1%的H2SO4蒸发浓缩至10ml,其质量分数小于2% |
您最近一年使用:0次



