名校
1 . (NH4)2Fe(SO4)2•6H2O(莫尔盐,浅绿色,式量392)在定量分析中常用作标定高锰酸钾、重铬酸钾等溶液的标准物质,还用作化学试剂、医药以及用于冶金、电镀等。
回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是_______ ;
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
①K2Cr2O7溶液应该放在_______ 式滴定管中。
②写出滴定过程中反应的离子方程式:_______ ;
③所测K2Cr2O7溶液的物质的量浓度为_______ mol/L(用含M的代数式表示)
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:_______ ;
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有_______ ;C装置中红色褪去,说明气体产物中含有_______ ;C装置后应连接尾气吸收装置D,D中盛有的试剂可以是_______ (写一种即可)。
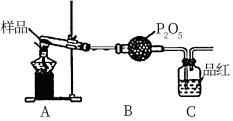
③丙同学想利用上述装置证明分解产物中含有氨气。只需更换B,C中的试剂即可,则更换后的试剂为B_______ 、C_______ ;
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、_______ 。

回答下列问题:
(1)莫尔盐在空气中比硫酸亚铁稳定,但长期露置于空气中也会变质,检验莫尔盐是否变质的试剂是
(2)准确称取mg纯净的莫尔盐,在锥形瓶中加入20mL水充分溶解,用某酸性K2Cr2O7溶液滴定至终点。重复进行3次,测得有关数据如下:
| 实验序号 | 起始读数/mL | 终点读数/mL |
| I | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
①K2Cr2O7溶液应该放在
②写出滴定过程中反应的离子方程式:
③所测K2Cr2O7溶液的物质的量浓度为
(3)某课题组通过实验检验莫尔盐晶体加热时的分解产物。
①甲同学提出猜想:分解产物可能是N2、Fe2O3,SO3、H2O四种物质。你是否同意并说明理由:
②乙同学设计了如图装置,其中A装置中的固体变为红棕色,则固体产物中含有

③丙同学想利用上述装置证明分解产物中含有氨气。只需更换B,C中的试剂即可,则更换后的试剂为B
④丁同学认为莫尔盐分解可能会生成N2,SO3,拟从下列装置如图2中选择必要的装置加以证明。则正确的连接顺序从左到右依次是A、

您最近一年使用:0次
2016-12-09更新
|
95次组卷
|
2卷引用:2015-2016学年河北省武邑中学高二下期末化学试卷
名校
解题方法
2 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
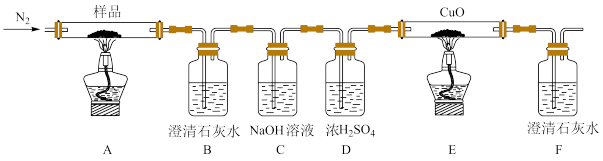
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

①配制溶液:实验中配制100mL1.0
 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。

②测定:称量10.00g晶体样品,加1.0
 溶解后配成100
溶解后配成100 溶液。
溶液。
步骤Ⅰ 取20.00 配制好的溶液于锥形瓶中,滴加0.2000
配制好的溶液于锥形瓶中,滴加0.2000
 溶液至恰好完全反应。该操作的目的是
溶液至恰好完全反应。该操作的目的是_______ 。
步骤Ⅱ 向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用0.2000
酸化,用0.2000
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00
溶液20.00 。
。
该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:


①配制溶液:实验中配制100mL1.0

 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加1.0

 溶解后配成100
溶解后配成100 溶液。
溶液。步骤Ⅰ 取20.00
 配制好的溶液于锥形瓶中,滴加0.2000
配制好的溶液于锥形瓶中,滴加0.2000
 溶液至恰好完全反应。该操作的目的是
溶液至恰好完全反应。该操作的目的是步骤Ⅱ 向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用0.2000
酸化,用0.2000
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00
溶液20.00 。
。该晶体样品中铁的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 已知硫酸亚铁铵[ ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是_______ ,由此可知分解产物中有_______ (填化学式)。
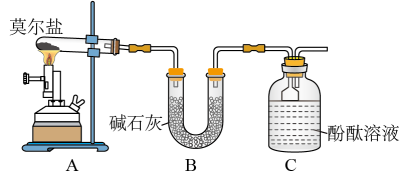
(2)乙同学认为莫尔盐晶体分解的产物中还可能含有 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。
①乙同学的实验中,装置依次连按的合理顺序为:A→H→→→→G。_______
②证明含有 的实验现象是
的实验现象是_______ 。
Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。
甲方案:取 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。
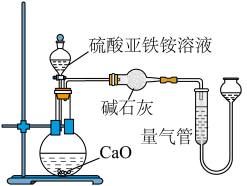
乙方案(通过 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是_______ 。
a. 水 b. 饱和 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液
(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是_______ 。
(5)若测得 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为_______ (列出计算式)。
 ](俗称莫尔盐)可溶于水,在
](俗称莫尔盐)可溶于水,在 时分解,其探究其化学性质,甲、乙两同学设计了如下实验。
时分解,其探究其化学性质,甲、乙两同学设计了如下实验。Ⅰ. 探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如图所示的装置进行实验。装置C中可观察到的现象是

(2)乙同学认为莫尔盐晶体分解的产物中还可能含有
 、
、 及
及 。为验证产物的存在,用下列装置进行实验。
。为验证产物的存在,用下列装置进行实验。 |  |  |  |  |
| D. 品红溶液 | E.  溶液 溶液 | F.  溶液和足量盐酸 溶液和足量盐酸 | G. 排水集气法 | H.安全瓶 |
②证明含有
 的实验现象是
的实验现象是Ⅱ. 为测定硫酸亚铁铵纯度,称取mg莫尔盐样品,配成
 溶液。甲、乙两位同学设计了如下两个实验方案。
溶液。甲、乙两位同学设计了如下两个实验方案。甲方案:取
 样品溶液用
样品溶液用 的酸性
的酸性 溶液分三次进行测定。
溶液分三次进行测定。乙方案(通过
 测定):实验设计装置如图所示。取
测定):实验设计装置如图所示。取 样品溶液进行该实验。
样品溶液进行该实验。
请回答:
(3)乙方案中量气管中最佳试剂是
a. 水 b. 饱和
 溶液 c.
溶液 c.  d. 饱和
d. 饱和 溶液
溶液(4)乙方案中收集完气体并恢复至室温,为了减小实验误差,读数前应进行的操作是
(5)若测得
 为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
为VL(已折算为标准状况下),则硫酸亚铁铵纯度为
您最近一年使用:0次
2023-01-21更新
|
757次组卷
|
3卷引用:山东省青岛第五十八中学2022-2023学年高一上学期期末考试化学试题
4 . 蛋白质是生命的物质基础。某学习小组实验探究一种蛋白质的元素组成。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是_______ 。
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。
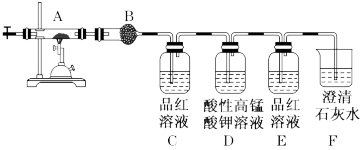
①装置B中的试剂是_______ 。
②装置D的作用是_______ 。
③当装置B、C、E、F依次出现下列现象:_______ ,品红溶液褪色,_______ ,出现白色浑浊;可证明燃烧产物中含有H2O,SO2>CO2,结论:该蛋白质中含碳、氢、硫、氮等元素。
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2 +I2=
+I2= +2I-
+2I-
(3)写出二氧化硫与碘水反应的化学方程式:_______ 。
(4)滴定终点的现象为_______ 。
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为_______ 。
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值_______ (填“偏大*偏小”或“无影响”)。
I.确定该蛋白质中的某些组成元素
(1)为确定该蛋白质中含氮元素,将样品中有机氮转化成铵盐,能证明铵盐存在的实验方法是
(2)为确定该蛋白质中含碳、氢、硫三种元素,采用如图装置进行探究,通入氧气使样品在装置A中 充分燃烧,并使其产物依次缓缓通过其余装置。

①装置B中的试剂是
②装置D的作用是
③当装置B、C、E、F依次出现下列现象:
II.为测定该蛋白质中硫元素的质量分数,小组取蛋白质样品充分燃烧,先用足量碘水吸收二氧化硫, 再取吸收液,以淀粉为指示剂,用硫代硫酸钠溶液滴定过量的碘。已知:2
 +I2=
+I2= +2I-
+2I-(3)写出二氧化硫与碘水反应的化学方程式:
(4)滴定终点的现象为
(5)取蛋白质样品m g进行测定,采用c1 mol·L-1的碘水V1 mL进行吸收,滴定过量的碘样时消耗c2 mol·L-1硫代硫酸钠溶液V2mL。该蛋白质中的硫元素的质量分数为
(6)若燃烧时过量氧气进入吸收液中,可能会导致该蛋白质中的硫元素的质量分数测定值
您最近一年使用:0次
名校
解题方法
5 . 某小组为探究K3[Fe(C2O4)3·3H2O(三草酸合铁酸钾晶体)的热分解产物,按如图所示装置进行实验。下列有关叙述错误的是
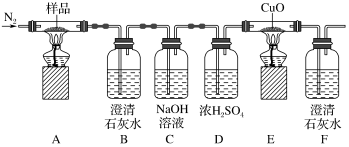

| A.通入氮气的目的有;隔绝空气、使反应产生的气体全部进入后续装置 |
| B.实验中观察到装置F中澄清石灰水变浑浊,装置E中固体变为红色,由此可判断热分解产物中一定含有CO2和CO |
| C.为防止倒吸,停止实验时应进行的操作是:先熄灭装置A、E的酒精灯,冷却后停止通入氮气 |
D.样品完全分解后,取少许装置A中残留物于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,可证明残留物中含有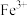 |
您最近一年使用:0次
2020-01-12更新
|
1481次组卷
|
8卷引用:山东省日照一中2020届高三新高考3月份自测化学试题
山东省日照一中2020届高三新高考3月份自测化学试题(已下线)《2020年新高考政策解读与配套资源》2020年山东新高考化学全真模拟卷(二)山东省潍坊昌乐县第二中学2020届高三下学期3月阶段测试化学试题北京市第一七一中学 2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】绍兴qw78【省级联考】湖北省2020年第五届高考测评活动高三元月调考(一模)理综化学试题福建省厦门双十中学2022-2023学年高一上学期第二次月考化学试题福建省三明第一中学2023-2024学年高一上学期12月月考化学试题
6 . Co(CH3COO)2(乙酸钴)可用作酯交换反应的催化剂并可用于制备高质量锂电池电极。在氮气氛围中,乙酸钴受热分解生成CO、CO2和C2H6等产物。某研究小组利用下列装置检验乙酸钴热分解的部分产物。
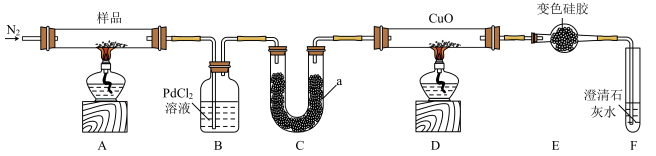
已知:①CO+PdCl2+H2O==CO2+Pd↓(黑色)+2HCl;
②变色硅胶为深蓝色,吸水后变为粉红色。
回答下列问题:
(1)B装置的作用是____ ,要检验乙酸钴分解产物中的CO2,对以上装置的改进方案是______ 。
(2)仪器a中的试剂是_______ ,其作用是_______ 。
(3)能证明乙酸钴的分解产物含有C2H6的实验现象是______ 。
(4)装置D中C2H6被CuO完全氧化的化学方程式是________ 。
(5)另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·nH2O]在空气中加热,样品的固体残留率(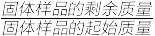 ×100%)随温度的变化如图所示(样品在200 ℃时已完全失去结晶水,350 ℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式:
×100%)随温度的变化如图所示(样品在200 ℃时已完全失去结晶水,350 ℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式:_____ 。

已知:①CO+PdCl2+H2O==CO2+Pd↓(黑色)+2HCl;
②变色硅胶为深蓝色,吸水后变为粉红色。
回答下列问题:
(1)B装置的作用是
(2)仪器a中的试剂是
(3)能证明乙酸钴的分解产物含有C2H6的实验现象是
(4)装置D中C2H6被CuO完全氧化的化学方程式是
(5)另取一定量乙酸钴结晶水合物样品[Co(CH3COO)2·nH2O]在空气中加热,样品的固体残留率(
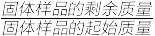 ×100%)随温度的变化如图所示(样品在200 ℃时已完全失去结晶水,350 ℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式:
×100%)随温度的变化如图所示(样品在200 ℃时已完全失去结晶水,350 ℃以上残留固体为金属氧化物)。根据以上实验数据列出残留氧化物CoxOy中x∶y的计算式: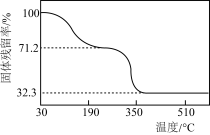
您最近一年使用:0次
7 . 氮化镁(Mg3N2)可用于核废料的回收,常温下为浅黄色粉末,易水解。某兴趣小组拟在实验室里通过氮气和镁粉反应制取少量氮化镁(Mg3N2),制备装置示意图如下。
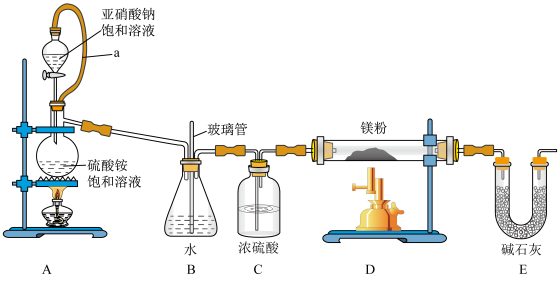
(1)工业上通常通过______________________ 获取氮气。
(2)装置A中橡胶管a的作用是______________________ 。
(3)NaNO2和(NH4)2SO4反应制备氮气的离子方程式______________________ 。
(4)装置B的作用为______________________ 。
(5)检验Mg3N2水解生成气体为NH3的方法为:取适量样品放入试管中,滴加蒸馏水,加热试管,_________________________________ (填操作与现象)。
(6)为测定产物中Mg3N2纯度,该小组称取4.0g样品加入足量10%NaOH溶液并加热,生成的气体全部用100.00mL 0.500mol·L-1的硫酸溶液吸收。将所得溶液稀释到250.00mL,取25.00mL该溶液,用0.2000mol·L-1NaOH标准溶液滴定过剩的硫酸。重复实验平均消耗NaOH溶液25.25mL。样品中Mg3N2的质量分数为___________ (保留一位小数)。滴定过程中若有NaOH溶液溅出,测定结果将___________ (填“偏高”或“偏低”)

(1)工业上通常通过
(2)装置A中橡胶管a的作用是
(3)NaNO2和(NH4)2SO4反应制备氮气的离子方程式
(4)装置B的作用为
(5)检验Mg3N2水解生成气体为NH3的方法为:取适量样品放入试管中,滴加蒸馏水,加热试管,
(6)为测定产物中Mg3N2纯度,该小组称取4.0g样品加入足量10%NaOH溶液并加热,生成的气体全部用100.00mL 0.500mol·L-1的硫酸溶液吸收。将所得溶液稀释到250.00mL,取25.00mL该溶液,用0.2000mol·L-1NaOH标准溶液滴定过剩的硫酸。重复实验平均消耗NaOH溶液25.25mL。样品中Mg3N2的质量分数为
您最近一年使用:0次



