名校
1 . 研究小组用下图装置制取 ,证明产生的气体中含有HCl。
,证明产生的气体中含有HCl。
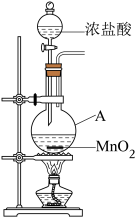
(1)仪器A的名称为____ ;A中反应的离子方程式为_____ 。
(2)甲同学将A中产生的气体通入下列溶液:
①实验a中的现象为_____ 。
②不能证明产生的气体中含有 的实验是
的实验是____ (填字母序号).
(3)已知将 气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有
气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有 ,结合化学用语解释其原因:
,结合化学用语解释其原因:_____ 。
(4)已知: 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有
。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有 。
。
Ⅰ.测定X中溶解的 .取
.取 溶液X,加入过量KI溶液,然后用
溶液X,加入过量KI溶液,然后用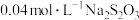 ,溶液滴定生成的
,溶液滴定生成的 ,达滴定终点时消耗
,达滴定终点时消耗 溶液
溶液 。
。
Ⅱ.测定X中 元素总量.另取
元素总量.另取 溶液X,选用适当的还原剂将溶解的
溶液X,选用适当的还原剂将溶解的 全部还原为
全部还原为 ,再用
,再用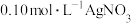 溶液滴定所得溶液中的
溶液滴定所得溶液中的 。
。
由Ⅰ、Ⅱ中实验数据可证明A中产生的气体中含有 ,则Ⅱ中消耗
,则Ⅱ中消耗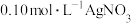 溶液的体积应大于
溶液的体积应大于___ mL(用含V的代数式表示)。
 ,证明产生的气体中含有HCl。
,证明产生的气体中含有HCl。
(1)仪器A的名称为
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | ___________ |
| b |  溶液 溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有
 的实验是
的实验是(3)已知将
 气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有
气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有 ,结合化学用语解释其原因:
,结合化学用语解释其原因:(4)已知:
 。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有
。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有 。
。Ⅰ.测定X中溶解的
 .取
.取 溶液X,加入过量KI溶液,然后用
溶液X,加入过量KI溶液,然后用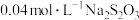 ,溶液滴定生成的
,溶液滴定生成的 ,达滴定终点时消耗
,达滴定终点时消耗 溶液
溶液 。
。Ⅱ.测定X中
 元素总量.另取
元素总量.另取 溶液X,选用适当的还原剂将溶解的
溶液X,选用适当的还原剂将溶解的 全部还原为
全部还原为 ,再用
,再用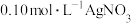 溶液滴定所得溶液中的
溶液滴定所得溶液中的 。
。由Ⅰ、Ⅱ中实验数据可证明A中产生的气体中含有
 ,则Ⅱ中消耗
,则Ⅱ中消耗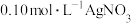 溶液的体积应大于
溶液的体积应大于
您最近一年使用:0次
2 . PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。
(1)仪器乙的名称是________ ;其中,与自来水进水管连接的接口编号是________ 。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________ 。实验过程中,为减少PCl5的生成,应控制____________ 。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________ 。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________ 。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________ 。若滴定终点时俯视读数,则PCl3的质量分数________ (填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________ 。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
| 熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
| 黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量)  2PCl3;2P+5Cl2(过量) 2PCl3;2P+5Cl2(过量)  2PCl5 2PCl5 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
如图是实验室制备PCl3的装置(部分仪器已省略)。
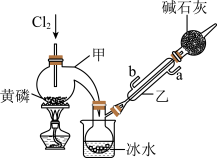
(1)仪器乙的名称是
(2)实验室制备Cl2的离子方程式
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为
(三)探究
(6)设计实验证明PCl3具有还原性:
您最近一年使用:0次
2019-10-02更新
|
129次组卷
|
2卷引用:河北省大名县第一中学(清北班,一)2020届高三9月月考化学试题
名校
3 . 甲酸(HCOOH)是还原性酸,又称作蚁酸,常用于橡胶、医药、染料、皮革等工业生产。某化学兴趣小组在分析甲酸的组成和结构后,对甲酸的某些性质进行了探究。请回答下列问题。
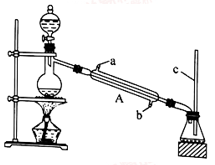
I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
(1)装置中,仪器A的名称是_________________ ,长玻璃管c的作用是__________________________ 。
(2)甲酸和甲醇进行酯化反应的化学方程式为____________________________________________ 。
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为__________________________________ 。
II.甲酸能脱水制取一氧化碳
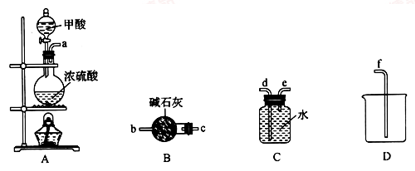
(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→__________ (按气流方向从左到右,用小写字母表示)。
(2)装置B的作用是__________________________________ 。
(3)一定条件下,CO能与NaOH 固体发生反应:CO+NaOH HCOONa。
HCOONa。
①为了证明“CO与NaOH 固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,___________ 。
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0 g配制成100 mL溶液,量取20.00 mL该溶液于锥形瓶中,再加入___________ 作指示剂,用1.5 mol/L的盐酸标准溶液滴定剩余的NaOH,平行滴定三次,平均消耗盐酸的体积为5.05 mL,则产物中甲酸钠的质量分数为_______ (计算结果精确到0.1%)。

I.甲酸能与醇发生酯化反应
该兴趣小组用如上图所示装置进行甲酸(HCOOH)与甲醇(CH3OH)的酯化反应实验:
有关物质的性质如下:
| 沸点/℃ | 密度(g·cm-3) | 水中溶解性 | |
| 甲醇 | 64.5 | 0.79 | 易溶 |
| 甲酸 | 100.7 | 1.22 | 易溶 |
| 甲酸甲酯 | 31.5 | 0.98 | 易溶 |
(2)甲酸和甲醇进行酯化反应的化学方程式为
(3)要从锥形瓶内所得的混合物中提取甲酸甲酯,可采用的方法为
II.甲酸能脱水制取一氧化碳

(1)利用上图装置制备并收集CO气体,其正确的连接顺序为a→
(2)装置B的作用是
(3)一定条件下,CO能与NaOH 固体发生反应:CO+NaOH
 HCOONa。
HCOONa。①为了证明“CO与NaOH 固体发生了反应”,设计下列定性实验方案:取固体产物,配成溶液,
②测定产物中甲酸钠(HCOONa)的纯度:准确称取固体产物8,0 g配制成100 mL溶液,量取20.00 mL该溶液于锥形瓶中,再加入
您最近一年使用:0次
2018-03-15更新
|
803次组卷
|
2卷引用:河北省衡水中学2018年高三下学期期初考试(3月)理综化学试题
4 . 某化学学习小组在帮助老师整理实验室的化学试剂时,发现一盛无色盐溶液的试剂瓶,标签破损如右图,该小组根据已掌握的知识,对药品作出猜想,并设计实验验证。

(1)该实验药品为中学化学常用试剂,推测它的阳离子化合价为______________________ 。
(2)同学们做出以下三种推测。
猜想1:Na2SO4
实验设计: 进行……,.证明是Na2SO4溶液;
猜想2: K2SO4
实验设计:____________________________ ,证明是K2SO4溶液;
猜想3; (NH4)2SO4
实验设计:____________________________ ,证明是(NH4)2SO4溶液。
(3)通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物。(夹持和加热装置略)
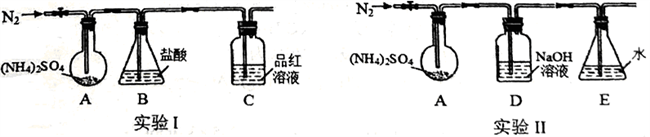
实验I:装置B 盛0.5000mol/L盐酸50.00mL,通入N2排尽空气后,将装置A 加热至260℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.1000mol/LNaOH溶液滴定剩余盐酸,消耗NaOH 溶液50.00mL。经检验滴定后的溶液中无SO42-。
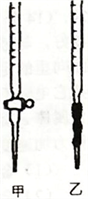
①请从右图选择盛放0.1000mol/LNaOH 溶液的滴定管____________ (填“甲”或“乙”)。
②装置B 内溶液吸收气体的物质的量是_____________________ mol。
实验Ⅱ:通入N2排尽空气后,将装置A 加热到400℃,至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。
①装置E 的作用是____________________________ 。
②A、D之间的导气管内的少量白色固体是____________________________ 。
③有同学提出在AD之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是____________________________ 。
④进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400℃分解的化学方程式是_______________________________ 。

(1)该实验药品为中学化学常用试剂,推测它的阳离子化合价为
(2)同学们做出以下三种推测。
猜想1:Na2SO4
实验设计: 进行……,.证明是Na2SO4溶液;
猜想2: K2SO4
实验设计:
猜想3; (NH4)2SO4
实验设计:
(3)通过实验发现“猜想3”成立,已知(NH4)2SO4受热易分解,该小组拟用下图所示装置探究其分解产物。(夹持和加热装置略)

实验I:装置B 盛0.5000mol/L盐酸50.00mL,通入N2排尽空气后,将装置A 加热至260℃一段时间,停止加热,停止通入N2,品红溶液不褪色,取下装置B,用0.1000mol/LNaOH溶液滴定剩余盐酸,消耗NaOH 溶液50.00mL。经检验滴定后的溶液中无SO42-。

①请从右图选择盛放0.1000mol/LNaOH 溶液的滴定管
②装置B 内溶液吸收气体的物质的量是
实验Ⅱ:通入N2排尽空气后,将装置A 加热到400℃,至固体无残留,停止加热,停止通入N2,观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。
①装置E 的作用是
②A、D之间的导气管内的少量白色固体是
③有同学提出在AD之间需要增加一个防倒吸的安全瓶,老师说不需要,原因是
④进一步研究发现,气体产物中无氮氧化物,则(NH4)2SO4在400℃分解的化学方程式是
您最近一年使用:0次
名校
5 . 亚硝酸钠NaNO2是一种工业盐,人若误食会引起中毒。某课外活动小组拟采用高锰酸钾滴定法测定某样品中NaNO2的质量分数:称取1.0g该样品于锥形瓶中,加入适量水溶解,然后用0.1000mol/L的KMnO4溶液(适量稀H2SO4酸化)进行测定,并重复上述操作2-3次。回答下列问题:
(1)滴定过程中反应的离子方程式为_____________ 。
(2)滴定终点的判断方法是______________ 。
(3)若滴定终点时平均消耗20.00mL标准溶液,该样品中NaNO2的质量分数为___________ 。
(4)下列操作中可能使测定结果偏高的是______________ 。
A.滴定结束后,滴定管尖嘴处有一悬挂液滴
B.滴定管尖嘴部分滴定前有气泡,滴定终了无气泡
C.滴定前仰视滴定管刻度线,滴定终点平视刻度线
D.锥形瓶用蒸馏水洗涤后,直接加入待测液进行滴定
(5)该小组还想设计实验证明:酸性条件下NaNO2具有氧化性,实验操作为___________ 。
(1)滴定过程中反应的离子方程式为
(2)滴定终点的判断方法是
(3)若滴定终点时平均消耗20.00mL标准溶液,该样品中NaNO2的质量分数为
(4)下列操作中可能使测定结果偏高的是
A.滴定结束后,滴定管尖嘴处有一悬挂液滴
B.滴定管尖嘴部分滴定前有气泡,滴定终了无气泡
C.滴定前仰视滴定管刻度线,滴定终点平视刻度线
D.锥形瓶用蒸馏水洗涤后,直接加入待测液进行滴定
(5)该小组还想设计实验证明:酸性条件下NaNO2具有氧化性,实验操作为
您最近一年使用:0次
2017-11-05更新
|
224次组卷
|
3卷引用:河北省定州中学2017-2018学年高二(承智班)上学期期中考试化学试题
名校
6 . 碘对动植物的生命是极其重要的,海水里的碘化物和碘酸盐参与大多数海生物的新陈代谢。在高级哺乳动物中,碘以碘化氨基酸的形式集中在甲状腺内,缺乏碘会引起甲状腺肿大。
I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I)。设计如图一所示的实验过程:

(1)为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有___________ 性。
(2)将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、_____ 、_____ ,在操作②中必须用到下列所示的部分仪器或装置,这些仪器和装置是________________ (填标号)。

(3)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。写出其中发生反应的离子方程式________________ ;Cl2不能过量,因为过量的Cl2将I2氧化为IO3-,写出该反应的离子方程式__________ 。
II.油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用cmol/L Na2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液V mL(滴定反应为:2Na2S2O3+I2=Na2S4O6+2NaI)。回答下列问题:
(1)下列有关滴定的说法不正确的是________ (填标号)。
A.标准Na2S2O3溶液应盛装在碱式滴定管中
B.滴定时眼睛只要注视滴定管中溶液体积的变化
C. 滴定终点时,俯视读数,导致测定结果偏低
D.滴定到溶液由无色变蓝色时应该立即停止滴定
(2)用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是_______________________________________________ 。
(3)该油脂的碘值为_____ g(列式表示)。
I.现要从工业含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I)。设计如图一所示的实验过程:

(1)为了将含碘废液中的I2完全转化为I—而进入水层,向含碘废液中加入了稍过量的A溶液,则A应该具有
(2)将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,操作②包含多步操作,操作名称分别为萃取、

(3)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。写出其中发生反应的离子方程式
II.油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用cmol/L Na2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液V mL(滴定反应为:2Na2S2O3+I2=Na2S4O6+2NaI)。回答下列问题:
(1)下列有关滴定的说法不正确的是
A.标准Na2S2O3溶液应盛装在碱式滴定管中
B.滴定时眼睛只要注视滴定管中溶液体积的变化
C. 滴定终点时,俯视读数,导致测定结果偏低
D.滴定到溶液由无色变蓝色时应该立即停止滴定
(2)用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是
(3)该油脂的碘值为
您最近一年使用:0次
2018-05-04更新
|
364次组卷
|
3卷引用:河北省2020届高三高考模拟理综化学试题



