名校
1 . (1)实验室有一瓶久置的亚硫酸钠溶液,同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。
【提出问题】该溶液中溶质成分是什么?该溶液中亚硫酸钠的物质的量浓度是多少?
【查阅资料】 有较强还原性,在空气中易被氧气氧化
有较强还原性,在空气中易被氧气氧化
【作出猜想】猜想 :没有变质,成分是
:没有变质,成分是
猜想 :完全变质,成分是
:完全变质,成分是
猜想 :部分变质,成分是
:部分变质,成分是 和
和
【实验探究Ⅰ】
(1)甲组设计实验探究溶液是否变质
甲组 | 实验操作 | 现象 | 结论 |
步骤 | 取少量样品于试管中加入过量稀盐酸 | 产生气泡 | 溶液中含有 |
步骤 | 另取样品于试管中,滴加足量氯化钡溶液,再滴加足量稀盐酸 | 溶液中含有 |
实验结论:样品部分变质。样品在空气中变质的化学方程式:
【实验探究Ⅱ】
(2)乙组设计如下实验测定
 溶液物质的量浓度。
溶液物质的量浓度。①连好装置并检查装置气密性,在锥形瓶中放入 该样品,通入
该样品,通入 。
。
②称量C装置的质量为 。
。
③关闭活塞 ,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
,用注射器推入浓硫酸至不再产生气泡,注射器可以换为
④打开活塞 ,再缓缓鼓入一定量的
,再缓缓鼓入一定量的 ,继续通入
,继续通入 的作用是
的作用是
⑤再次称量C装置的质量为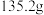 。
。

⑥计算出原溶液中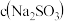 =
= 装置,实验结果将
装置,实验结果将 填“偏大”“不变”或“偏小”
填“偏大”“不变”或“偏小” 。
。
您最近一年使用:0次
名校
2 . 回答下列问题:
(1)实验室用浓盐酸与二氧化化锰制氯气的反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)实验室制取氨气的化学方程式为___________ 。
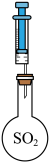
(3)用下图装置来,制备纯净的SO2装置的连接顺序为:a→___________ (按气流方向,用小写字母表示)。

(4)用如图装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、酸性KMnO4溶液、淀粉-KI溶液、新制H2S溶液。
(5)已知NaNO2在空气中会氧化变质(部分转化为NaNO3),取部分变质后的固体样品10g与20mL2molL-1的酸性KMnO4溶液恰好完全反应(Mn全部转化为Mn2+),则样品中NaNO2的纯度为___________ 。
(1)实验室用浓盐酸与二氧化化锰制氯气的反应中氧化剂与还原剂的物质的量之比为
(2)实验室制取氨气的化学方程式为
(3)用下图装置来,制备纯净的SO2装置的连接顺序为:a→

(4)用如图装置探究SO2的性质。限选试剂:NaOH溶液、稀H2SO4、H2O2溶液、酸性KMnO4溶液、淀粉-KI溶液、新制H2S溶液。

| 操作步骤 | 实验现象 | 解释原因 |
| 用注射器将新制H2S溶液注入充满SO2的烧瓶中 | 产生淡黄色浑浊 | 该反应中+4价S体现了 |
| 用注射器将少量的 | +4价S具有还原性,反应的离子方程式为 |
您最近一年使用:0次
3 . 过氧化钙(CaO2)广泛应用于水产养殖、污水处理,是优良的供氧剂。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:______________ 。
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是_______________________ 。
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②____________________________ ;③视线和凹液面最低处保持水平再读数。
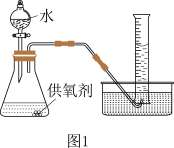
(4)用此装置测得的含量会偏大,原因是________________ ,为了避免此误差可将发生装置换成图2中的装置B或C。
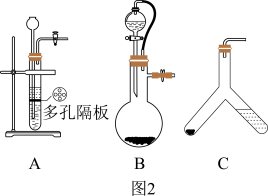
方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。
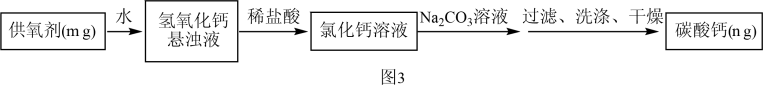
(5)滴加的Na2CO3溶液要过量的原因是_________________________ 。
实验探究一:过氧化钙与水反应除生成氧气外,还生成什么物质?
(1)进行实验:取适量过氧化钙放入试管中加适量水,向试管中滴加酚酞溶液,液体变成红色,说明生成了Ca(OH)2,写出该反应的化学方程式:
(2)此供氧剂长期暴露在空气中,会变质生成CaCO3,为检验此供氧剂是否变质,可向其中加入稀盐酸,若观察到有气泡生成,则判断此供氧剂已变质。有同学不认同上述方案的理由是
实验探究二:测定久置过氧化钙纯度。
方案一:通过测定产生氧气的体积,最终计算出供氧剂中过氧化钙的含量。
(3)取一定质量的供氧剂溶于水,按照图1装置进行装配。读出体积时要注意:①该反应为放热反应,待气体恢复至室温再读数;②

(4)用此装置测得的含量会偏大,原因是

方案二:把样品中的过氧化钙转化为碳酸钙,通过测定碳酸钙沉淀的质量,根据钙元素守恒,求得过氧化钙的质量,具体流程如图3。

(5)滴加的Na2CO3溶液要过量的原因是
您最近一年使用:0次
2023-08-17更新
|
395次组卷
|
2卷引用:广东省珠海市斗门区第一中学2023-2024学年高三上学期阶段性考试化学试题
4 . 食用二氧化硫漂白过的食品,对人体的肝、肾脏等有严重损害。某科研小组设计实验检验二氧化硫的漂白性。回答下列问题:
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫:
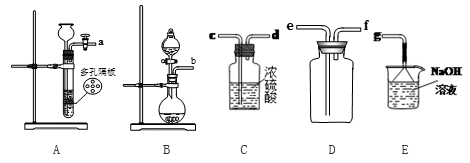
(1)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:________ (按气流方向,用小写字母表示)。
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。
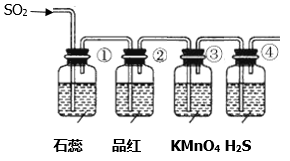
(2)根据上述实验,回答下列问题:
(3)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0g Na2SO3样品,配成250mL溶液,取25.00mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00mL。达到滴定终点时锥形瓶中溶液颜色变化是________________________ ,样品中Na2SO3质量分数是_______ 。
(一)二氧化硫的制备
实验室一般采用亚硫酸钠与硫酸(浓硫酸与水1:1混合)反应制取二氧化硫:

(1)欲收集一瓶干燥的二氧化硫,选择上图中的装置,其最佳连接顺序为:
(二)二氧化硫性质的检验
将上述收集到的SO2通入下列装置中,在一定温度下按图示装置进行实验。

(2)根据上述实验,回答下列问题:
| 序号 | 实验现象 | 解释原因 |
| ① | ||
| ② | 品红试液褪色 | SO2具有漂白性 |
| ③ | 反应的离子方程式 | |
| ④ | 溶液变浑浊,有黄色沉淀生成 | SO2+2H2S=3S↓+2H2O |
您最近一年使用:0次
名校
5 . 某化学实验小组为了探究氨气的性质设计了如图实验装置:
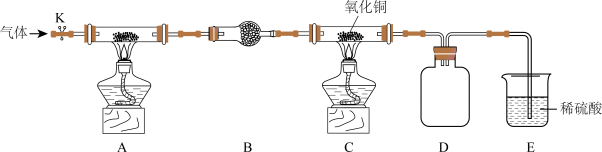
已知:CuO在高温时不稳定,会分解得到Cu2O,Cu2O粉末呈红色。
(1)实验前需先通入一段时间某气体,该气体可以是____ (填字母)。
a.空气b.氩气c.氢气
装置A用于制备氨气,选择的试剂通常是____ (填化学式)。
(2)装置D、E的作用分别是____ 、____ 。
(3)经实验测定NH3和CuO反应的产物有N2和Cu,则NH3和CuO反应的化学方程式为____ 。
(4)实验结束后装置c中黑色粉末变成红色,该红色粉末的成分能否确定?____ (填“能”或“否”)。请通过检验其他产物证明NH3和CuO发生了反应,简述实验方案:____ 。
(5)加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。
①写出氨气与铝反应的化学方程式:____ 。
②称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为____ %(保留一位小数)。

已知:CuO在高温时不稳定,会分解得到Cu2O,Cu2O粉末呈红色。
(1)实验前需先通入一段时间某气体,该气体可以是
a.空气b.氩气c.氢气
装置A用于制备氨气,选择的试剂通常是
(2)装置D、E的作用分别是
(3)经实验测定NH3和CuO反应的产物有N2和Cu,则NH3和CuO反应的化学方程式为
(4)实验结束后装置c中黑色粉末变成红色,该红色粉末的成分能否确定?
(5)加热条件下,氨气可以与铝发生置换反应生成AlN;AlN性质稳定,加热时溶于浓碱溶液且可产生氨气。
①写出氨气与铝反应的化学方程式:
②称取AlN样品23.2g(假设杂质只含Al),将其放入足量浓碱溶液中加热,若所产生的气体全部逸出并收集,测得其体积为14.56L(标准状况),则样品中AlN的质量分数为
您最近一年使用:0次
2022-07-12更新
|
401次组卷
|
3卷引用:广东省江门市第一中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
6 . 某学习小组设计如图装置,验证黄铜矿(主要成分CuFeS2)在空气中的氧化产物(杂质不参与反应)。
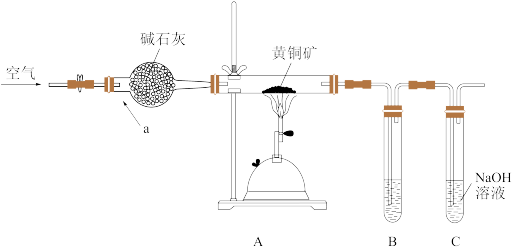
回答下列问题。
(1)仪器a的名称______ ,碱石灰的作用______ 。
(2)为检验灼烧黄铜矿产生的气体,B中可选______
a.HNO3溶液b.品红溶液c.BaCl2溶液d.溴水e.酸性KMnO4溶液
(3)C中NaOH的作用______ 。
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀硫酸反应生成Cu和CuSO4。
①设计实验验证泡铜中含有Cu2O:取少量泡铜置于试管中,________ ,若________ ,说明泡铜中含有Cu2O。
②用泡铜与CO反应来制取粗铜,再经精炼可得纯铜。将一定量的纯铜投入到2L1mol/L的稀硝酸中充分反应,请写出该反应的离子方程式_______ 。若铜全部溶解并得到标况下4.48LNO,要使溶液中的Cu2+恰好沉淀,需要向反应后的溶液中加入5mol/L的NaOH溶液____ L

回答下列问题。
(1)仪器a的名称
(2)为检验灼烧黄铜矿产生的气体,B中可选
a.HNO3溶液b.品红溶液c.BaCl2溶液d.溴水e.酸性KMnO4溶液
(3)C中NaOH的作用
(4)样品经煅烧后的固体中铜元素以泡铜(Cu、Cu2O)形式存在,其中Cu2O能与稀硫酸反应生成Cu和CuSO4。
①设计实验验证泡铜中含有Cu2O:取少量泡铜置于试管中,
②用泡铜与CO反应来制取粗铜,再经精炼可得纯铜。将一定量的纯铜投入到2L1mol/L的稀硝酸中充分反应,请写出该反应的离子方程式
您最近一年使用:0次
2020-07-01更新
|
210次组卷
|
2卷引用:广东省深圳市宝安中学高中部2020-2021学年高一下学期期中考试化学试卷
7 . FeC2O4·2H2O是一种淡黄色粉末,加热分解生成FeO、CO、CO2 和H2O。某小组拟探究其分解部分产物并测定其纯度。
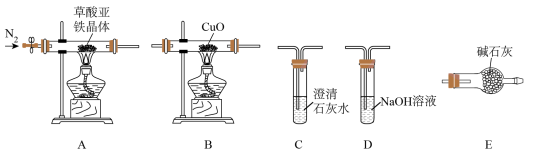
回答下列问题:
(1)按气流方向从左至右,装置连接顺序为A、___________ C( 填字母,装置可重复使用)。
(2)点燃酒精灯之前,向装置内通入一段时间N2,其目的是__________________ 。
(3)B中黑色粉末变红色,最后连接的C中产生白色沉淀,表明A中分解产物有_________ 。
(4)判断A中固体已完全反应的现象是_____________ 。设计简单实验检验A中残留固体是否含铁粉:________ 。
(5)根据上述装置设计实验存在的明显缺陷是________________________________ 。
(6)测定FeC2O4·2H2O样品纯度(FeC2O4·2H2O相对分子质量为M):准确称取w g FeC2O4·2H2O样品溶于稍过量的稀硫酸中并配成250mL溶液,准确量取25.00mL所配制溶液于锥形瓶,用c mol ·L—1标准KMnO4溶液滴定至终点,消耗V mL滴定液。滴定反应为FeC2O4+ KMnO4+ H2SO4→K2SO4+MnSO4 +Fe2(SO4)3+CO2↑+ H2O(未配平)。则该样品纯度为_______ % (用代数式表示)。若滴定前仰视读数,滴定终点俯视读数,测得结果_____ (填“偏高”“偏低”或“无影响”)。

回答下列问题:
(1)按气流方向从左至右,装置连接顺序为A、
(2)点燃酒精灯之前,向装置内通入一段时间N2,其目的是
(3)B中黑色粉末变红色,最后连接的C中产生白色沉淀,表明A中分解产物有
(4)判断A中固体已完全反应的现象是
(5)根据上述装置设计实验存在的明显缺陷是
(6)测定FeC2O4·2H2O样品纯度(FeC2O4·2H2O相对分子质量为M):准确称取w g FeC2O4·2H2O样品溶于稍过量的稀硫酸中并配成250mL溶液,准确量取25.00mL所配制溶液于锥形瓶,用c mol ·L—1标准KMnO4溶液滴定至终点,消耗V mL滴定液。滴定反应为FeC2O4+ KMnO4+ H2SO4→K2SO4+MnSO4 +Fe2(SO4)3+CO2↑+ H2O(未配平)。则该样品纯度为
您最近一年使用:0次
解题方法
8 . 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质。
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
①铜屑与稀硝酸反应的化学反应方程式为____________________ ;
②可能导致的两个不利因素是_____________ 、________________ 。
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是_____ 、______ 、过滤、晾干。
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
Ⅰ、他们先把铜粉放在空气中灼烧,再与稀硝酸反应制取硝酸铜。
(1)如果直接用铜屑与稀硝酸反应来制取硝酸铜:
①铜屑与稀硝酸反应的化学反应方程式为
②可能导致的两个不利因素是
(2)实验中,欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤按顺序是
Ⅱ、为了探究Cu(NO3)2在酸性条件下跟铁单质的反应。他们取一支试管,加入Cu(NO3)2溶液,滴入适量稀硫酸酸化,再加入一定量铁粉,实验后没有固体残留物质。
(3)该探究小组对反应后溶液中铁元素的价态进行探究,他们设计了实验方案,并进行实验。请按下表格式补充写出实验操作步骤、预期现象与结论。
| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色,① |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | ② |
| 步骤3:③另取少量溶液,滴加KSCN溶 | ③ |
您最近一年使用:0次



