解题方法
1 . 某校化学兴趣小组用下图所示装置探究 的性质。请回答:
的性质。请回答:
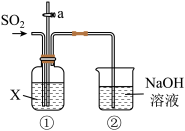
(1)装置②中发生反应的化学方程式是_______ 。
(2)若X为品红溶液,可观察到装置①中溶液_______ ,说明 具有
具有_______ 性。
(3)若X为紫色石蕊溶液,可观察到装置①中溶液_______ ,说明 的水溶液显
的水溶液显_______ (填“酸性”或“碱性”)。
(4)若X为 溶液,可观察到装置①中
溶液,可观察到装置①中_______ (填“有”或“无”)明显现象。打开活塞a,通入氧气,有白色沉淀生成,说明 最终被氧化为
最终被氧化为 ,由此可知
,由此可知 具有
具有_______ (填“氧化性”或“还原性”)。
(5)若X为 溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明
溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明 具有
具有_______ (填“氧化性”或“还原性”)。写出相应的化学方程式:_______ 。
 的性质。请回答:
的性质。请回答:
(1)装置②中发生反应的化学方程式是
(2)若X为品红溶液,可观察到装置①中溶液
 具有
具有(3)若X为紫色石蕊溶液,可观察到装置①中溶液
 的水溶液显
的水溶液显(4)若X为
 溶液,可观察到装置①中
溶液,可观察到装置①中 最终被氧化为
最终被氧化为 ,由此可知
,由此可知 具有
具有(5)若X为
 溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明
溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明 具有
具有
您最近一年使用:0次
名校
解题方法
2 . 某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。【制取氨气的反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3+2H2O,部分夹持仪器已略去】
CaCl2+2NH3+2H2O,部分夹持仪器已略去】
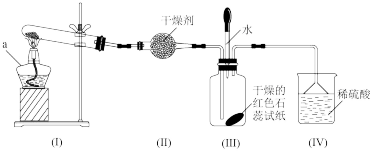
【实验探究】(1)装置(I)中仪器a的名称是_____ 。
(2)装置(Ⅱ)中可用_________ (填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___ (填“白色”或“蓝色”)原因是氨水呈____ (填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______ (填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________ 。
(5)装置(IV)中稀硫酸的作用是___________ 。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____ mol。
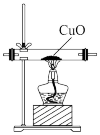
【实验拓展】(7)已知:2NH3+3CuO 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____ (填“白色”或“红色”),在这过程中NH3表现出__ (填“还原性”或“氧化性”)。
【知识应用】(8)氨气是一种重要的化工原料。写出它的一种用途:__________ 。
 CaCl2+2NH3+2H2O,部分夹持仪器已略去】
CaCl2+2NH3+2H2O,部分夹持仪器已略去】
【实验探究】(1)装置(I)中仪器a的名称是
(2)装置(Ⅱ)中可用
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满
(5)装置(IV)中稀硫酸的作用是
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是
【实验拓展】(7)已知:2NH3+3CuO
 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
【知识应用】(8)氨气是一种重要的化工原料。写出它的一种用途:
您最近一年使用:0次
2020-07-17更新
|
433次组卷
|
4卷引用:2020年6月福建省普通高中学业水平合格性考试化学试题
2020年6月福建省普通高中学业水平合格性考试化学试题(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编福建省泉州市第七中学 2020--2021 学年高二上学期期末化学学业水平合格性测试二福建省莆田第七中学2021-2022学年高一下学期期中考试化学试题
3 . “鱼浮灵”又称固态双氧水,主要成分为2Na2CO3·3H2O2,是水产品运输过程中常用的化学增氧剂。某小组为探究溶液酸碱性对H2O2溶液中溶解氧含量的影响,进行了如下实验。
[查阅资料]
i.Na2SO4 溶液显中性。
ii.pH<7时, pH越小,溶液的酸性越强; pH>7时,pH越大,溶液的碱性越强。
[进行实验]
向3个均盛有80 mL 4% H2O2溶液的烧杯中,依次加入20 mL的稀硫酸、Na2SO4 溶液、NaOH溶液,分别测定溶液的pH和溶解氧含量。实验记录如下表。
[分析解释]
(1)H2O2发生分解反应的产物是___________ 。
(2)由实验②可知,H2O2 溶液显___________ ( 填字母)。
a.酸性 b.碱性
(3)综合上述实验数据,可以得出的结论是____________ 。
[应用实践]
(4)结合上述实验分析,“鱼浮灵”可以提高水中溶解氧含量的可能原因有___________ 。
[查阅资料]
i.Na2SO4 溶液显中性。
ii.pH<7时, pH越小,溶液的酸性越强; pH>7时,pH越大,溶液的碱性越强。
[进行实验]
向3个均盛有80 mL 4% H2O2溶液的烧杯中,依次加入20 mL的稀硫酸、Na2SO4 溶液、NaOH溶液,分别测定溶液的pH和溶解氧含量。实验记录如下表。
| 实验编号 | ① | ② | ③ |
| 加入的试剂 | 稀硫酸 | Na2SO4溶液 | NaOH溶液 |
| pH | 0.44 | 5.97 | 11.74 |
| 溶解氧含量/ (mg·L-1) | 5.9 | 6.5 | 13.1 |
[分析解释]
(1)H2O2发生分解反应的产物是
(2)由实验②可知,H2O2 溶液显
a.酸性 b.碱性
(3)综合上述实验数据,可以得出的结论是
[应用实践]
(4)结合上述实验分析,“鱼浮灵”可以提高水中溶解氧含量的可能原因有
您最近一年使用:0次
解题方法
4 . 戴口罩是新冠肺炎疫情常态化防控的措施之一。一次性医用口罩绒布的主要成分是聚丙烯[(C3H6)n],随意丢弃易引起白色污染。某兴趣小组尝试用焚烧法对口罩绒布进行处理,并将燃烧产物用氢氧化钠溶液吸收。
(1)聚丙烯完全燃烧的化学方程式为:2(C3H6)n+9nO2 6nCO2+6nX,X的化学式为
6nCO2+6nX,X的化学式为________ 。
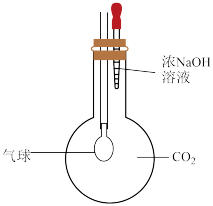
(2)为“看见”CO2与NaOH的反应,甲同学设计了如图所示的实验方案,当观察到______ 现象时,说明两者发生反应。
(3)将完全燃烧后的产物全部通入一定量的氢氧化钠溶液中,得到吸收液。乙同学对吸收液的成分产生兴趣,进行如下探究:
【提出问题】
吸收液中溶质的成分是什么?
【查阅资料】
①Na2CO3、NaHCO3的溶液均呈碱性;CaCl2溶液呈中性。
②NaOH与NaHCO3能反应
③Na2CO3+CaCl2=CaCO3↓+2NaCl
2NaHCO3+CaCl2=CaCO3↓+2NaCl+H2O+CO2↑
【猜想假设】
猜想一:NaOH、Na2CO3
猜想二:________
猜想三:Na2CO3、NaHCO3
猜想四:NaHCO3
【实验探究】
【交流反思】
实验结束后,为了对吸收液进行无害化处理,丙同学向吸收液中加入稀盐酸至不再产生气泡为止。写出其中一个反应的化学方程式:________ 。
(1)聚丙烯完全燃烧的化学方程式为:2(C3H6)n+9nO2
 6nCO2+6nX,X的化学式为
6nCO2+6nX,X的化学式为(2)为“看见”CO2与NaOH的反应,甲同学设计了如图所示的实验方案,当观察到

(3)将完全燃烧后的产物全部通入一定量的氢氧化钠溶液中,得到吸收液。乙同学对吸收液的成分产生兴趣,进行如下探究:
【提出问题】
吸收液中溶质的成分是什么?
【查阅资料】
①Na2CO3、NaHCO3的溶液均呈碱性;CaCl2溶液呈中性。
②NaOH与NaHCO3能反应
③Na2CO3+CaCl2=CaCO3↓+2NaCl
2NaHCO3+CaCl2=CaCO3↓+2NaCl+H2O+CO2↑
【猜想假设】
猜想一:NaOH、Na2CO3
猜想二:
猜想三:Na2CO3、NaHCO3
猜想四:NaHCO3
【实验探究】
| 步骤 | 实验操作 | 实验现象 | 实验结论 |
| 1 | 取吸收液少许于试管中,滴加2~3滴无色酚酞溶液 | 溶液呈碱性 | |
| 2 | 向步骤1所得溶液中加入过量的CaCl2溶液 | 产生白色沉淀,溶液为红色 | 猜想 |
实验结束后,为了对吸收液进行无害化处理,丙同学向吸收液中加入稀盐酸至不再产生气泡为止。写出其中一个反应的化学方程式:
您最近一年使用:0次
5 . 某学习小组设计实验,探究二氧化硫的漂白性和还原性。
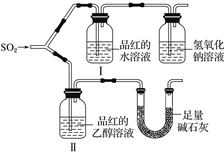
(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
①甲同学作对照实验的目的是_________________________________________ 。
②足量碱石灰的作用是_____________________________________________ 。
甲同学由此得出的实验结论是_________________________________________ 。
(2)还原性
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是____________________ ,检验该反应所得含氧酸根离子的方法是___________________________________________________________ 。
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3 溶液形成的混合色。 则②中红棕色变为浅绿色的原因是_________________________________________________________ 。
乙同学得出的实验结论是二氧化硫可还原三氯化铁。

(1)漂白性
甲同学用如图所示装置(气密性良好)进行实验,观察到如下现象:Ⅰ中红色褪去,Ⅱ中无变化。
①甲同学作对照实验的目的是
②足量碱石灰的作用是
甲同学由此得出的实验结论是
(2)还原性
乙同学将SO2通入FeCl3溶液中,使其充分反应。
①SO2与FeCl3反应的离子方程式是
②实验中观察到溶液由黄色变为红棕色,静置一段时间,变为浅绿色。资料显示:红棕色为FeSO3 (墨绿色难溶物)与FeCl3 溶液形成的混合色。 则②中红棕色变为浅绿色的原因是
乙同学得出的实验结论是二氧化硫可还原三氯化铁。
您最近一年使用:0次
名校
6 . 实验小组探究某补铁口服液中铁元素的价态。
【查阅资料】
KSCN中的硫元素为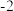 价,易被氧化为
价,易被氧化为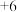 价。
价。
【实验过程】
【分析与解释】
(1)由实验Ⅰ可得出的结论是___________ 。
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是___________ ;小组同学为证实自己的猜想,设计如下对照实验:向1mL 0.1 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到___________ ,证实了小组同学的猜想是正确的。
【查阅资料】
KSCN中的硫元素为
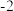 价,易被氧化为
价,易被氧化为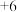 价。
价。【实验过程】
| 编号 | 实验操作 | 实验现象 |
| 实验Ⅰ |  | 无明显变化 |
| 实验Ⅱ |  | 溶液变红 |
(1)由实验Ⅰ可得出的结论是
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为
 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是
 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到
您最近一年使用:0次
2021-06-20更新
|
611次组卷
|
5卷引用:北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题
北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题(已下线)周末培优4 金属及其化合物的实验题和工艺流程题-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)北京市第十一中学2021-2022学年高一下学期6月月考化学试题(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
名校
7 . 某校化学探究小组利用以下装置制取并探究氨气的性质。[已知生石灰与水反应生成Ca(OH)2并放出热量,实验室利用此原理往生石灰中滴加浓氨水,可以快速制取氨气。部分夹持仪器已略去]

[实验探究]
(1)装置(Ⅰ)中生石灰的化学式为_______ ,仪器a的名称是_______ 。
(2)装置(Ⅱ)中的干燥剂可选用_______ (填“碱石灰”或“浓硫酸”)。
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口_______ (填“b”或“c”)通入集气瓶中。

(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的_______ (填“白烟”或“白雾”);写出NH3与HCl反应的化学方程式:_______ 。
(5)装置(Ⅴ)中仪器d的作用是_______ 。取装置(Ⅴ)中的少量溶液于试管中,滴入1~2滴酚酞试液,溶液显_______ (填“无色”或“红色”),其原因是_______ 。
[知识应用]
(6)液氨用作制冷剂是由于液氨汽化时_______ (填“吸收”或“放出”)大量的热,使周围环境的温度降低。
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+ 5O2 4NO + 6H2O,在该反应中氨气表现出
4NO + 6H2O,在该反应中氨气表现出_______ (填“氧化性”或“还原性”),若NO 接触空气,观察到的现象是_______ 。

[实验探究]
(1)装置(Ⅰ)中生石灰的化学式为
(2)装置(Ⅱ)中的干燥剂可选用
(3)在装置(Ⅲ)连接如图所示的装置,用于收集氨气(已知氨气的密度小于空气),氨气应从导管口

(4)当实验进行一段时间后,挤压装置(Ⅳ)中的胶头滴管,滴入1~2滴浓盐酸,可观察到瓶内产生大量的
(5)装置(Ⅴ)中仪器d的作用是
[知识应用]
(6)液氨用作制冷剂是由于液氨汽化时
(7)氨气是工业制硝酸的原料,其第一步反应为4NH3+ 5O2
 4NO + 6H2O,在该反应中氨气表现出
4NO + 6H2O,在该反应中氨气表现出
您最近一年使用:0次
8 . 某同学用下图所示装置探究SO2的性质。请回答:
(1)装置②中发生反应的离子方程式是_______ ;
(2)若X为品红溶液,可观察到装置①中溶液褪色,说明SO2具有_______ 性;
(3)若X为紫色石蕊溶液,可观察到装置①中溶液变红,说明SO2的水溶液显_______ (填标号);
a.酸性 b.碱性
(4)若X为_______ (填化学式)溶液,可观察到装置①中无明显现象。打开活塞a,通入氧气,有白色沉淀生成,说明SO2最终被氧化为SO ,由此可知SO2具有
,由此可知SO2具有_______ 性。

(1)装置②中发生反应的离子方程式是
(2)若X为品红溶液,可观察到装置①中溶液褪色,说明SO2具有
(3)若X为紫色石蕊溶液,可观察到装置①中溶液变红,说明SO2的水溶液显
a.酸性 b.碱性
(4)若X为
 ,由此可知SO2具有
,由此可知SO2具有
您最近一年使用:0次
名校
解题方法
9 . 某同学利用下图所示装置探究SO2的性质。

请回答下列问题:
(1)若X为品红溶液,则可观察到装置①中溶液褪色,说明SO2具有___________ 性;装置②中发生反应的离子方程式是___________ 。
(2)若X为紫色石蕊溶液,则可观察到装置①中溶液变红,说明SO2的水溶液显___________ (填字母代号)。
a.酸性 b.碱性
若X为___________ (填字母代号)溶液,则可观察到装置①中无明显现象。打开活塞a,通入氧气,有白色沉淀生成,说明SO2最终被氧化为SO ,可说明SO2具有
,可说明SO2具有___________ 性。
a.氯化钠 b氯化钡

请回答下列问题:
(1)若X为品红溶液,则可观察到装置①中溶液褪色,说明SO2具有
(2)若X为紫色石蕊溶液,则可观察到装置①中溶液变红,说明SO2的水溶液显
a.酸性 b.碱性
若X为
 ,可说明SO2具有
,可说明SO2具有a.氯化钠 b氯化钡
您最近一年使用:0次
名校
解题方法
10 . 实验小组利用传感器探究Na2CO3和NaHCO3的性质。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
【分析与解释】
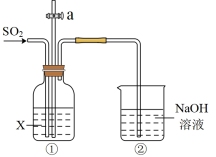
(1)实验I中,溶解时吸收热量的物质是_______ 。
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为_______ ,OH-未参与该反应的实验证据是_______ 。
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有_______ (填写离子符号)参与反应。
【查阅资料】pH越小,c(OH-)越小,溶液碱性越弱
【实验过程】
| 编号 | 实验操作 | 实验数据 |
| 实验I | 测量下述实验过程的温度变化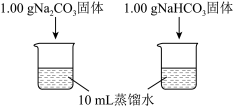 |  |
| 实验II | 测量下述实验过程的pH变化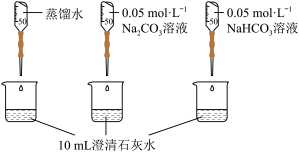 |  |
(1)实验I中,溶解时吸收热量的物质是
(2)实验II中,Na2CO3溶液和澄清石灰水反应的离子方程式为
(3)实验II中,滴加NaHCO3溶液的pH变化与滴加Na2CO3溶液的有明显差异,造成这种差异是由于滴加NaHCO3溶液的烧杯中有
您最近一年使用:0次
2022-11-30更新
|
361次组卷
|
13卷引用:北京市2020年普通高中学业水平合格性模拟考试化学试题
北京市2020年普通高中学业水平合格性模拟考试化学试题2020年北京市第一次普通高中学业水平合格性考试化学试题高一必修第一册(苏教2019)专题3 第二单元 金属钠及钠的化合物4北京市回民学校2020-2021学年高一上学期期中考试化学试题北京市第三十一中学2020—2021学年度高一下学期期中考试化学试题北京第七中学2020-2021学年高一下学期期中考试化学试题天津市红桥区2020-2021学年高一下学期期末考试化学试题(已下线)北京市第四中学2022-2023学年高一上学期期中考试化学试题北京市第四十三中学2022-2023学年高一上学期期中考试化学试题北京市第八中学2022-2023学年高一下学期期末考试化学试题(已下线)专题八 钠及其化合物北京市第十一中学2023-2024学年高一上学期期中考试化学试题北京市月坛中学2023-2024学年高一上学期期中考试化学试题



