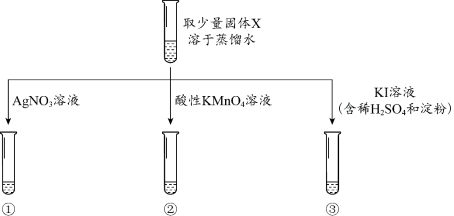
1 . 某实验小组欲通过加热蒸发KNO3溶液的方法获得KNO3固体。已知KNO3固体在一定温度下能够发生反应:2KNO3 2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体
ⅱ.KNO2能在酸性条件下与KI反应,生成I2
【实验过程】
(1)实验①中,观察到有少量白色沉淀生成,该白色沉淀是_______ 。
(2)实验②中,观察到酸性KMnO4溶液紫红色褪去,利用对比实验排除了稀释对溶液颜色变化的影响。补全该反应的离子方程式:2MnO + 5NO
+ 5NO + 6H+ = 2Mn2+ +
+ 6H+ = 2Mn2+ +_______ + 3H2O
(3)实验③中,观察到溶液变为蓝色。实验③中选择KI溶液的依据是_______ (填字母)。
a.KNO2具有氧化性,KI具有还原性
b.KNO2具有还原性,KI具有氧化性
【反思评价】
(4)综合上述实验,甲同学认为,实验①、②、③均可以证明固体X中含有KNO2;乙同学认为,通过实验③不能证明固体X中含有KNO2。乙同学的理由是_______ 。
 2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。
2KNO2 + O2↑。为了探究加热蒸发所得固体X中是否含有KNO2,小组同学分别设计并完成了以下实验。【查阅资料】
ⅰ.AgNO2是微溶于水的白色(略带黄色)固体
ⅱ.KNO2能在酸性条件下与KI反应,生成I2
【实验过程】
(1)实验①中,观察到有少量白色沉淀生成,该白色沉淀是
(2)实验②中,观察到酸性KMnO4溶液紫红色褪去,利用对比实验排除了稀释对溶液颜色变化的影响。补全该反应的离子方程式:2MnO
 + 5NO
+ 5NO + 6H+ = 2Mn2+ +
+ 6H+ = 2Mn2+ +(3)实验③中,观察到溶液变为蓝色。实验③中选择KI溶液的依据是
a.KNO2具有氧化性,KI具有还原性
b.KNO2具有还原性,KI具有氧化性
【反思评价】
(4)综合上述实验,甲同学认为,实验①、②、③均可以证明固体X中含有KNO2;乙同学认为,通过实验③不能证明固体X中含有KNO2。乙同学的理由是
您最近一年使用:0次
2022-04-15更新
|
297次组卷
|
2卷引用:北京市2021-2022学年高三年级下学期合格考(第一次)化学试题
名校
解题方法
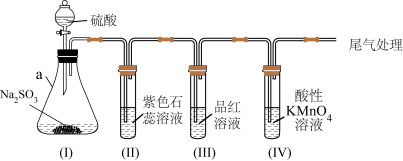
2 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
【实验探究】
(1)装置(I)仪器a的名称是___________ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为___________ ,写出相关的化学方程式___________ 。
②装置(III)中品红溶液________ ,原因是________ ,加热后,溶液又恢复_________ ,可用于检验SO2。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___________ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式___________ 。
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___________ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2___________ +4H+=3S↓+2H2O。
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和___________ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用NaOH溶液吸收,写出该反应的离子方程式
(4)用25.2gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现浑浊,补充完整该反应的离子方程式:SO2+2
【知识应用】
(6)二氧化硫可作为食品添加剂。
查阅资料:国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g∙kg-1 | 0.25g∙kg-1 | 1g∙kg-1 |
您最近一年使用:0次
名校
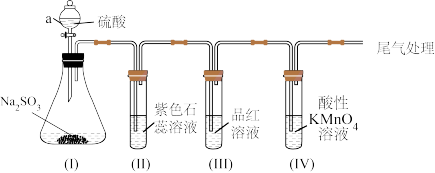
3 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
【实验探究】
(1)装置(I)仪器a的名称是___ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为____ ,原因是SO2和水反应生成____ (填“H2SO3”或“H2SO4”)。
②装置(III)中品红溶液褪色,原因是____ 。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用____ (填“NaOH溶液”或“稀硫酸”)吸收。
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现____ (填“白色”或“淡黄色”)浑浊,补充完整下面的离子方程式:____ 。
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和____ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液褪色,原因是
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g•kg-1 | 0.25g•kg-1 | 1g•kg-1 |
您最近一年使用:0次
2022-07-11更新
|
416次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
解题方法
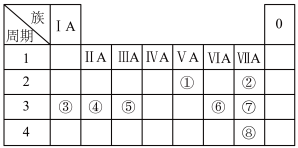
4 . 下表列出了①~⑧八种元素在周期表中的位置。
(1)元素①的原子结构示意图:________ 。
(2)元素③与⑥组成的化合物的电子式:_______ 。
(3)元素②、③的离子中,半径较大的是_______ (填化学式)。
(4)元素④的单质与盐酸反应的离子方程式:________ 。
(5)元素⑤的最高价氧化物是______ (填“酸性”“碱性”或“两性”)氧化物。
(6)元素⑦、⑧形成单质的氧化性较弱的是______ (填化学式),从实验证据的角度列举能证明其氧化性强弱关系的反应:_______ (填化学方程式)。
(7)已知硒(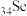 )与⑥同主族,请根据硒元素在元素周期表中的位置,推测硒及其化合物可能具有的性质:
)与⑥同主族,请根据硒元素在元素周期表中的位置,推测硒及其化合物可能具有的性质:_______ (填序号)。
a.Se的最低负化合价为-2价 b. 既有氧化性又有还原性
既有氧化性又有还原性
c.Se的气态氢化物的稳定性比⑥的强 d.最高价氧化物对应的水化物为
(1)元素①的原子结构示意图:
(2)元素③与⑥组成的化合物的电子式:
(3)元素②、③的离子中,半径较大的是
(4)元素④的单质与盐酸反应的离子方程式:
(5)元素⑤的最高价氧化物是
(6)元素⑦、⑧形成单质的氧化性较弱的是
(7)已知硒(
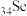 )与⑥同主族,请根据硒元素在元素周期表中的位置,推测硒及其化合物可能具有的性质:
)与⑥同主族,请根据硒元素在元素周期表中的位置,推测硒及其化合物可能具有的性质:a.Se的最低负化合价为-2价 b.
 既有氧化性又有还原性
既有氧化性又有还原性c.Se的气态氢化物的稳定性比⑥的强 d.最高价氧化物对应的水化物为

您最近一年使用:0次
解题方法
5 . 某校化学兴趣小组用下图所示装置探究 的性质。请回答:
的性质。请回答:_______ 。
(2)若X为品红溶液,可观察到装置①中溶液_______ ,说明 具有
具有_______ 性。
(3)若X为紫色石蕊溶液,可观察到装置①中溶液_______ ,说明 的水溶液显
的水溶液显_______ (填“酸性”或“碱性”)。
(4)若X为 溶液,可观察到装置①中
溶液,可观察到装置①中_______ (填“有”或“无”)明显现象。打开活塞a,通入氧气,有白色沉淀生成,说明 最终被氧化为
最终被氧化为 ,由此可知
,由此可知 具有
具有_______ (填“氧化性”或“还原性”)。
(5)若X为 溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明
溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明 具有
具有_______ (填“氧化性”或“还原性”)。写出相应的化学方程式:_______ 。
 的性质。请回答:
的性质。请回答:
(2)若X为品红溶液,可观察到装置①中溶液
 具有
具有(3)若X为紫色石蕊溶液,可观察到装置①中溶液
 的水溶液显
的水溶液显(4)若X为
 溶液,可观察到装置①中
溶液,可观察到装置①中 最终被氧化为
最终被氧化为 ,由此可知
,由此可知 具有
具有(5)若X为
 溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明
溶液,可观察到装置①中产生浅黄色沉淀(单质硫),说明 具有
具有
您最近一年使用:0次
2023-03-15更新
|
370次组卷
|
2卷引用:云南省2022-2023学年高二下学期普通高中学业水平考试化学试题
名校
6 . 下表列出了①-⑤五种元素在周期表中的位置:
按要求回答下列问题:
(1)元素⑥的最高正化合价是___________ ,最低负化合价是___________ 。
(2)元素⑤在周期表中的位置是___________ 。
(3)元素②和元素③的非金属性强弱关系是②___________ ③(选“>”或“<”);表中所列六种元素的单质,常温下为有色气体的是___________ (填化学式)。
(4)①~⑥六种元素中原子半径最大的是___________ (填元素符号)。②③两种元素的最简单氢化物中最稳定 的是___________ (填化学式)
(5)元素③与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:___________ 。
(6)CH4与NH3相比,热稳定性较强的是___________ ;Cl2和N2氧化性较强的是___________ 。
(7)碳的一种氢化物结构式为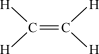 ,其分子式是
,其分子式是___________ ,其中碳元素与氢元素的质量比m(C):m(H)___________ 。(相对原子质量:C-12,C-H)
(8)下列各项性质的比较,符合相关性质递变规律的是___________(填标号)。
族 周期 | IA | 0 | ||||||
| 1 | ① | IIA | ⅢA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ |
(1)元素⑥的最高正化合价是
(2)元素⑤在周期表中的位置是
(3)元素②和元素③的非金属性强弱关系是②
(4)①~⑥六种元素中原子半径最大的是
(5)元素③与元素④能形成原子个数比为1:1的化合物Y,Y在常温下为固态,焰色反应为黄色,常用与呼吸面具中做供氧剂。写出Y与水反应的化学方程式:
(6)CH4与NH3相比,热稳定性较强的是
(7)碳的一种氢化物结构式为
 ,其分子式是
,其分子式是(8)下列各项性质的比较,符合相关性质递变规律的是___________(填标号)。
| A.还原性:Na<Mg | B.非金属性:O>S |
| C.酸性:H2S>HCl | D.碱性:NaOH>Al(OH)3 |
您最近一年使用:0次
2022-06-09更新
|
342次组卷
|
3卷引用:福建省三明市第二中学2021-2022学年高一下学期会考模拟卷(一)化学试题
名校
解题方法
7 . 某化学兴趣小组为制取NH3并探究其性质,按下图装置进行实验。【制取氨气的反应原理:2NH4Cl+Ca(OH)2 CaCl2+2NH3+2H2O,部分夹持仪器已略去】
CaCl2+2NH3+2H2O,部分夹持仪器已略去】_____ 。
(2)装置(Ⅱ)中可用_________ (填“碱石灰”或“食盐”)作干燥剂。
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为___ (填“白色”或“蓝色”)原因是氨水呈____ (填“碱性”或“酸性”)。
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满_______ (填“白烟”或“白雾”),写出NH3与HCl反应生成NH4Cl的化学方程式:_________ 。
(5)装置(IV)中稀硫酸的作用是___________ 。
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是____ mol。
【实验拓展】(7)已知:2NH3+3CuO 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为____ (填“白色”或“红色”),在这过程中NH3表现出__ (填“还原性”或“氧化性”)。__________ 。
 CaCl2+2NH3+2H2O,部分夹持仪器已略去】
CaCl2+2NH3+2H2O,部分夹持仪器已略去】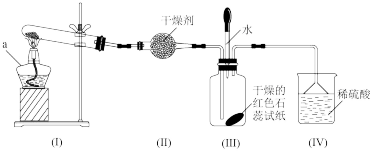
(2)装置(Ⅱ)中可用
(3)实验进行一段时间后,装置(Ⅲ)中干燥的红色石蕊试纸不变色,然后滴加水,观察到试纸颜色变为
(4)装置(Ⅲ)中胶头滴管若改装浓盐酸,实验进行一段时间后,滴加浓盐酸,观察到瓶内充满
(5)装置(IV)中稀硫酸的作用是
(6)用0.1 mol NH4Cl与足量Ca(OH)2反应,理论上可生成NH3的物质的量是
【实验拓展】(7)已知:2NH3+3CuO
 3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为
3Cu+N2+3H2O,若把装置(Ⅲ)换为如图装置,当实验进行一段时间后,观察到黑色固体变为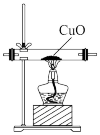
您最近一年使用:0次
2020-07-17更新
|
452次组卷
|
6卷引用:2020年6月福建省普通高中学业水平合格性考试化学试题
2020年6月福建省普通高中学业水平合格性考试化学试题(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编福建省泉州市第七中学 2020--2021 学年高二上学期期末化学学业水平合格性测试二福建省莆田第七中学2021-2022学年高一下学期期中考试化学试题河南省信阳高级中学2023-2024学年高一下学期7月月考化学试卷 河南省信阳高级中学2023-2024学年高一下学期7月月考化学试卷
解题方法
8 . 高锰酸钾分别在酸性、中性、碱性条件下发生的反应如下:
MnO +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2O
MnO +3e-+2H2O===MnO2↓+4OH-
+3e-+2H2O===MnO2↓+4OH-
MnO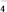 +e-===MnO
+e-===MnO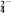 (溶液呈绿色)
(溶液呈绿色)
(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的_______ 影响。
(2)将SO2通入高锰酸钾溶液中,发生氧化还原反应的离子方程式为______________ 。
(3)将PbO2投入酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是________ (填字母)。
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.MnSO4溶液可以用盐酸酸化
MnO
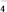 +5e-+8H+===Mn2++4H2O
+5e-+8H+===Mn2++4H2OMnO
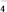 +3e-+2H2O===MnO2↓+4OH-
+3e-+2H2O===MnO2↓+4OH-MnO
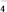 +e-===MnO
+e-===MnO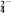 (溶液呈绿色)
(溶液呈绿色)(1)从上述三个半反应中可以看出高锰酸根离子被还原的产物受溶液的
(2)将SO2通入高锰酸钾溶液中,发生氧化还原反应的离子方程式为
(3)将PbO2投入酸性MnSO4溶液中搅拌,溶液变为紫红色。下列说法正确的是
a.氧化性:PbO2>KMnO4
b.还原性:PbO2>KMnO4
c.MnSO4溶液可以用盐酸酸化
您最近一年使用:0次
11-12高二·辽宁·期末
名校
9 . 维生素C 又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+ 转变为易吸收的Fe2+ ,这说明维生素C具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
2016-12-09更新
|
400次组卷
|
7卷引用:2021年天津市普通高中学业水平考试化学试题
10 . “鱼浮灵”又称固态双氧水,主要成分为2Na2CO3·3H2O2,是水产品运输过程中常用的化学增氧剂。某小组为探究溶液酸碱性对H2O2溶液中溶解氧含量的影响,进行了如下实验。
[查阅资料]
i.Na2SO4 溶液显中性。
ii.pH<7时, pH越小,溶液的酸性越强; pH>7时,pH越大,溶液的碱性越强。
[进行实验]
向3个均盛有80 mL 4% H2O2溶液的烧杯中,依次加入20 mL的稀硫酸、Na2SO4 溶液、NaOH溶液,分别测定溶液的pH和溶解氧含量。实验记录如下表。
[分析解释]
(1)H2O2发生分解反应的产物是___________ 。
(2)由实验②可知,H2O2 溶液显___________ ( 填字母)。
a.酸性 b.碱性
(3)综合上述实验数据,可以得出的结论是____________ 。
[应用实践]
(4)结合上述实验分析,“鱼浮灵”可以提高水中溶解氧含量的可能原因有___________ 。
[查阅资料]
i.Na2SO4 溶液显中性。
ii.pH<7时, pH越小,溶液的酸性越强; pH>7时,pH越大,溶液的碱性越强。
[进行实验]
向3个均盛有80 mL 4% H2O2溶液的烧杯中,依次加入20 mL的稀硫酸、Na2SO4 溶液、NaOH溶液,分别测定溶液的pH和溶解氧含量。实验记录如下表。
| 实验编号 | ① | ② | ③ |
| 加入的试剂 | 稀硫酸 | Na2SO4溶液 | NaOH溶液 |
| pH | 0.44 | 5.97 | 11.74 |
| 溶解氧含量/ (mg·L-1) | 5.9 | 6.5 | 13.1 |
[分析解释]
(1)H2O2发生分解反应的产物是
(2)由实验②可知,H2O2 溶液显
a.酸性 b.碱性
(3)综合上述实验数据,可以得出的结论是
[应用实践]
(4)结合上述实验分析,“鱼浮灵”可以提高水中溶解氧含量的可能原因有
您最近一年使用:0次



