1 . 为探究浓硫酸的性质,某兴趣小组进行如下实验:取2g蔗糖(C12H22O11)放入大试管中,加入2~3滴水,再加入约3mL浓硫酸,迅速搅拌。实验中可以观察到试管内的固体由白色变为黑色,后体积迅速膨胀,同时闻到刺激性气味,试管壁摸起来发烫。
⑴试管内的黑色物质是:______ 。该物质的生成表现了浓硫酸的______ 性。
⑵滴加浓硫酸之前加入2~3滴水的目的是______ 。写出黑色物质与浓硫酸反应的化学方程式:______ 。
⑶兴趣小组设计用如图所示的装置检验反应中生成的气体。

①X、Y分别是______ 和______ 。
②已知酸性KMnO4溶液具有强氧化性,图中所示装置中酸性KMnO4溶液的作用是______ 。
⑴试管内的黑色物质是:
⑵滴加浓硫酸之前加入2~3滴水的目的是
⑶兴趣小组设计用如图所示的装置检验反应中生成的气体。

①X、Y分别是
②已知酸性KMnO4溶液具有强氧化性,图中所示装置中酸性KMnO4溶液的作用是
您最近一年使用:0次
2 . 过二硫酸钠( )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: 。
。
(1)写出装置中生成 的反应的化学方程式:
的反应的化学方程式:___________ 。
(2)盛装NaOH溶液的仪器名称为___________ ,持续通入氮气的目的是___________ 。
(3)装置中硫酸的作用是___________ 。
(4)某兴趣小组设计实验探究不同环境下 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
①在___________ (填“中性”“酸性”或“碱性”)条件下, 的氧化能力最强。
的氧化能力最强。
②若用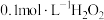 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为___________ ;达到滴定终点时,消耗 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中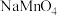 的质量为
的质量为___________ g(用含 的代数式表示,
的代数式表示,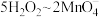 )
)
 )也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用
)也叫高硫酸钠,可用于废气处理及有害物质的氧化降解。用 溶液和一定浓度的NaOH溶液混合可制得
溶液和一定浓度的NaOH溶液混合可制得 晶体。实验室制备
晶体。实验室制备 晶体的装置如下图所示:
晶体的装置如下图所示: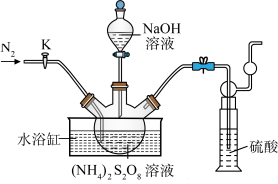
 。
。(1)写出装置中生成
 的反应的化学方程式:
的反应的化学方程式:(2)盛装NaOH溶液的仪器名称为
(3)装置中硫酸的作用是
(4)某兴趣小组设计实验探究不同环境下
 氧化性的强弱。将
氧化性的强弱。将 (1.69g)与过量
(1.69g)与过量 (10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。
(10g)溶于水中形成的混合溶液煮沸3min,观察并记录加入试剂时和加热过程中的现象(如下表所示)。| 环境 | 调节溶液氧化环境时的现象 | 加热煮沸3min期间产生的现象 |
| 中性 | 加入VmL蒸馏水,无明显现象 | 30s时开始有大量气泡冒出,3min后溶液变为深棕色,溶液中有悬浮小颗粒 |
| 碱性 | 加入VmL某浓度的NaOH溶液,瞬间变为棕色( ) ) | 10s后溶液逐渐变为深紫色( ),没有明显冒气泡现象 ),没有明显冒气泡现象 |
| 酸性 | 加入VmL稀硫酸无明显现象 | 煮沸3min后,有气泡冒出 |
 的氧化能力最强。
的氧化能力最强。②若用
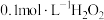 溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为
溶液滴定碱性氧化反应后的溶液(先将溶液调至酸性再滴定),滴定终点时的现象为 溶液的体积为
溶液的体积为 。则碱性氧化后的溶液中
。则碱性氧化后的溶液中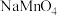 的质量为
的质量为 的代数式表示,
的代数式表示,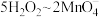 )
)
您最近一年使用:0次
3 . A、B、C、D四种物质之间有下图所示的转化关系。
已知:A是气体单质,C 是红棕色气体。
回答下列问题:
(1)写出C的化学式:________ ;
(2)在上图D→B的过程中,D表现出强_____ (填“氧化性”或“还原性”);
(3)写出C→D转化的化学方程式_________ 。
已知:A是气体单质,C 是红棕色气体。
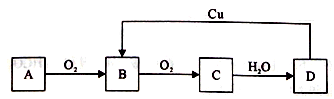
回答下列问题:
(1)写出C的化学式:
(2)在上图D→B的过程中,D表现出强
(3)写出C→D转化的化学方程式
您最近一年使用:0次
2017-05-15更新
|
343次组卷
|
2卷引用:湖南省邵阳市2016-2017学年高二普通高中学业水平考试模拟试卷化学试题
名校
4 . 已知;还原性HSO3->I-,氧化性IO3->I2。在含3 mol NaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出的I2的物质的量的关系曲线如图。下列说法正确的是


| A.反应过程中的氧化产物均为Na2SO4 |
| B.a 点时消耗NaHSO3的物质的量为1.0mol |
| C.0~b间的反应可用如下离子方程式表示:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O |
| D.当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为1.1mol |
您最近一年使用:0次
2016-12-09更新
|
244次组卷
|
4卷引用:2018届高三一轮复习化学:考点14-氧化还原反应的计算
5 . 高铁酸钾(K2FeO4)是一种高效多功能水处理剂,具有极强的氧化性。
(1)(2016·衡阳一中高三3月月考)高铁酸钾有以下几种常见制备方法:
干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
电解法 制备中间产物Na2FeO4,再与KOH溶液反应
①干法制备K2FeO4的化学方程式为_____________________________________ ,
氧化剂与还原剂的物质的量之比为____________ 。
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:______________________________________ 。
(2)(2016·青岛高三上学期期末)工业上常采用NaClO氧化法生产高铁酸钾,反应原理为
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为_________________________________________________________________ 。
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH===K2FeO4+2NaOH,K2FeO4在水溶液中易水解:4FeO +10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用________ 溶液(填序号)。
A.水 B.NH4Cl、异丙醇
C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
(1)(2016·衡阳一中高三3月月考)高铁酸钾有以下几种常见制备方法:
干法 Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
湿法 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
电解法 制备中间产物Na2FeO4,再与KOH溶液反应
①干法制备K2FeO4的化学方程式为
氧化剂与还原剂的物质的量之比为
②湿法制备中,若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式:
(2)(2016·青岛高三上学期期末)工业上常采用NaClO氧化法生产高铁酸钾,反应原理为
①在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为
②Na2FeO4与KOH反应生成K2FeO4:Na2FeO4+2KOH===K2FeO4+2NaOH,K2FeO4在水溶液中易水解:4FeO
 +10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
+10H2O4Fe(OH)3+8OH-+3O2,在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用A.水 B.NH4Cl、异丙醇
C.Fe(NO3)3、异丙醇 D.CH3COONa、异丙醇
您最近一年使用:0次
名校
解题方法
6 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
 两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是
两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法正确的是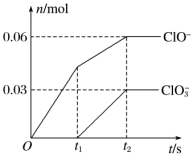
| A.苛性钾溶液中KOH的质量是4.94g |
B.氧化性ClO-<ClO |
| C.反应中转移电子的物质的量是0.21mol |
D.在酸性条件下ClO-和ClO 可生成Cl2 可生成Cl2 |
您最近一年使用:0次
2023-01-13更新
|
398次组卷
|
2卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷
7 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺如下:
(1) “合成”步骤可以得到ClO2,其反应的化学方程式为_____________________________ 。
(2) “电解”步骤阳极会生成一种气体,其化学式为____________ 。
(3) 反应生成的ClO2可用于高效脱除烟气中的SO2。以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如右图所示。pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低。而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为_____________________________________ 。
(4) 国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00 g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200 mL,取出20.00 mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00 ml。该样品可达________ 试剂纯度。(写出计算过程)
已知:ClO +4I-+4H+===2H2O+2I2+Cl-,I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-,I2+2S2O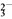 ===2I-+S4O
===2I-+S4O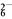
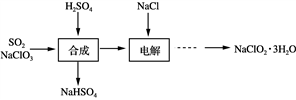
(1) “合成”步骤可以得到ClO2,其反应的化学方程式为
(2) “电解”步骤阳极会生成一种气体,其化学式为
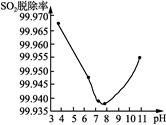
(3) 反应生成的ClO2可用于高效脱除烟气中的SO2。以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如右图所示。pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低。而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为
(4) 国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00 g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200 mL,取出20.00 mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00 ml。该样品可达
已知:ClO
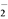 +4I-+4H+===2H2O+2I2+Cl-,I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-,I2+2S2O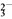 ===2I-+S4O
===2I-+S4O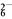
您最近一年使用:0次
解题方法
8 . 本题为《化学反应原理(选修4)》
(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2(g) 2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
① 从反应开始到化学平衡状态,生成SO3的平均反应速率为_____ ;此时反应物O2的转化率是___________ ;
② 下列叙述能证明该反应已达到化学平衡状态的是______ (填标号,下同);
A.容器内压强不再发生变化
B. SO2的体积分数不再发生变化
C. 容器内气体原子总数不再发生变化
D. 相同时间内消耗2nmol SO2的同时消耗n molO2
③t℃时,若将4mol SO2和2mol O2的混合气体通入上述恒温恒容密闭容器中,反应重新达到平衡时SO2的转化率与① 比较_______ (填“增大”、“不变”或“减小”)。
(2)今有常温下的下列溶液:
①0.1mol/LFeC13 溶液呈_______ (填“酸性”、“中性”或“碱性”);
② 实验测得0.1mol/LNaHCO3溶液pH>7,则NaHCO3的电离程度_______ 水解程度(填“大于”、“等于”或“小于”)。
③ 在0.10mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分反应有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_________ (已知Ksp[Cu(OH)2]=2.2×10-2O)。
(3)①事实证明,原电池中发生的反应通常是放热反应。利用下列反应可以设计为原电池的是_________ ;
A. C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=H2O(l)△H<0
② 以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极反应式是________ ;
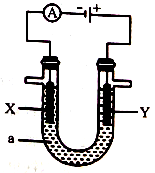
③ 电解原理在工业上有着广泛的应用。下图所示电解池中,a为CuSO4溶液,X和Y为惰性电极,则Y电极附近溶液的pH变化是_______ (填“增大”“不变”或“减小”)。
(1)t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2 (g)+O2(g)
 2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:
2SO3(g),△H=-196.6kJ·mol-1。2min时反应达到化学平衡状态,此时测得反应物O2还剩余0.8mol,填写下列空白:① 从反应开始到化学平衡状态,生成SO3的平均反应速率为
② 下列叙述能证明该反应已达到化学平衡状态的是
A.容器内压强不再发生变化
B. SO2的体积分数不再发生变化
C. 容器内气体原子总数不再发生变化
D. 相同时间内消耗2nmol SO2的同时消耗n molO2
③t℃时,若将4mol SO2和2mol O2的混合气体通入上述恒温恒容密闭容器中,反应重新达到平衡时SO2的转化率与① 比较
(2)今有常温下的下列溶液:
①0.1mol/LFeC13 溶液呈
② 实验测得0.1mol/LNaHCO3溶液pH>7,则NaHCO3的电离程度
③ 在0.10mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分反应有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=
(3)①事实证明,原电池中发生的反应通常是放热反应。利用下列反应可以设计为原电池的是
A. C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H<0
C.2H2(g)+O2(g)=H2O(l)△H<0
② 以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极反应式是
③ 电解原理在工业上有着广泛的应用。下图所示电解池中,a为CuSO4溶液,X和Y为惰性电极,则Y电极附近溶液的pH变化是
您最近一年使用:0次
名校
9 . 下列实验方案设计正确的是
| 编号 | 目的 | 方案设计 |
| A | 检验固体试样中有 | 在某固体试样加水后的溶液中,滴加NaOH溶液,没有产生使湿润红色石蕊试纸变蓝的气体,该固体试样中不可能存在 |
| B | 探究S与Cl的金属性强弱 | 向NaHS溶液中滴入稀盐酸,观察是否有生成臭鸡蛋气味气体( )。 )。 |
| C | 探究浓度对化学反应速率的影响 | 向两支试管分别加入 和 和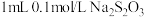 溶液,向盛有 溶液,向盛有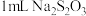 溶液试管中加入 溶液试管中加入 蒸馏水,再同时向两支试管中加 蒸馏水,再同时向两支试管中加 ,收集生成的 ,收集生成的 气体,比较生成气体的多少 气体,比较生成气体的多少 |
| D | 探究 的还原性 的还原性 | 在试管中加入少量酸性 溶液,然后向试管中逐滴加入 溶液,然后向试管中逐滴加入 溶液,观察溶液颜色变化 溶液,观察溶液颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-06-12更新
|
894次组卷
|
3卷引用:2023年6月浙江省学业水平适应性考试化学学科试题
名校
解题方法
10 . 已知:还原性 ,某溶液中含有等物质的量的
,某溶液中含有等物质的量的 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,为了确定其组成,某同学进行了如下实验:
中的几种离子,为了确定其组成,某同学进行了如下实验:
①取少量溶液,滴入酸性高锰酸钾溶液,发现高锰酸钾溶液褪色
②取①中溶液,加入KSCN溶液,溶液呈红色;加入氢氧化钠固体并加热,产生能使湿润的红色石蕊试纸变蓝的气体
③取少量溶液,加入足量盐酸酸化的氯化钡溶液,产生白色沉淀
下列说法不正确的是
 ,某溶液中含有等物质的量的
,某溶液中含有等物质的量的 、
、 、
、 、
、 、
、 、
、 、
、 、
、 中的几种离子,为了确定其组成,某同学进行了如下实验:
中的几种离子,为了确定其组成,某同学进行了如下实验:①取少量溶液,滴入酸性高锰酸钾溶液,发现高锰酸钾溶液褪色
②取①中溶液,加入KSCN溶液,溶液呈红色;加入氢氧化钠固体并加热,产生能使湿润的红色石蕊试纸变蓝的气体
③取少量溶液,加入足量盐酸酸化的氯化钡溶液,产生白色沉淀
下列说法不正确的是
A.溶液中肯定存在 、 、 、 、 |
B.溶液中不可能同时存在 、 、 |
C.溶液中可能同时存在 、 、 |
D.溶液中可能存在 、 、 |
您最近一年使用:0次
2022-06-26更新
|
1343次组卷
|
5卷引用:浙江省宁波市效实中学2023-2024学年高一下学期学业水平模拟考试化学试卷



