名校
1 . 某实验小组从电极反应角度探究银镜反应中物质氧化性和还原性的变化。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式_______ 。
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、_______ 。
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:_______ 。(碱性条件下)
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
乙同学认为实验Ⅲ不能证明“随c(Ag+)降低,Ag+氧化性减弱”,理由是_______ 。
(3)设计实验进一步验证。
①乙同学认为通过实验Ⅳ能证明“随c(Ag+)降低,Ag+氧化性减弱”,你认为是否合理并说明原因_______ 。
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是_______ 。
(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因_______ 。
资料:ⅰ.[Ag(NH3)2]+⇌ [Ag(NH3)]++NH3K1=10−3.81
[Ag(NH3)]+⇌ Ag++NH3K2=10−3.24
ⅱ.AgOH不稳定,极易分解为黑色Ag2O,Ag2O溶于氨水
(1)实验发现:乙醛和AgNO3溶液水浴加热无明显现象;银氨溶液水浴加热无明显现象;滴加乙醛的银氨溶液水浴加热,试管壁逐渐出现一层光亮的银镜。
①有研究表明:配制银氨溶液时,AgNO3和氨水生成Ag(NH3)2NO3,写出生成Ag(NH3)2NO3的化学方程式
②从氧化还原角度分析:发生银镜反应时,氧化性微粒可能是Ag+、
(2)甲同学查阅资料:银镜反应时,Ag+被还原成Ag。
①电极反应式:
ⅰ.还原反应:Ag++e−=Ag
ⅱ.氧化反应:
②从电极反应角度分析物质氧化性和还原性的变化:
ⅰ.随c(Ag+)降低,Ag+氧化性减弱。
ⅱ.随c(OH−)增大,乙醛还原性增强。
③补充实验验证②中的分析。
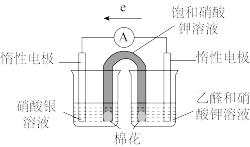
| 实验操作及现象: 实验Ⅰ.插入“饱和KNO3溶液”盐桥,电流表指针偏转; 实验Ⅱ.电流稳定后向右侧烧杯滴加NaOH溶液,指针偏转幅度增大; 实验Ⅲ.电流再次稳定后向左侧烧杯滴加氨水,指针偏转幅度减小 |
(3)设计实验进一步验证。
| 实验 | 实验操作 | 实验现象 |
| Ⅳ | 往盛有银氨溶液的试管中滴加浓氨水,无明显现象,加入3滴乙醛,振荡,水浴加热 | 闻到刺激性气味,溶液略显灰色,试管壁未见银镜 |
| Ⅴ | 往盛有银氨溶液的试管中滴加较浓的NaOH溶液至pH与实验Ⅳ相同,振荡,溶液变浑浊,加入3滴乙醛,振荡,水浴加热 | 试管壁 |
②分析实验Ⅴ中“立即出现银镜的原因”,提出假设:随c(OH−)增大,可能是
 也参与了还原
也参与了还原 。经检验该假设成立,实验方案及现象是
。经检验该假设成立,实验方案及现象是(4)总结:ⅰ.银氨溶液和乙醛发生银镜反应时,氧化剂主要是Ag+,还原剂主要是乙醛;ⅱ.银氨溶液中滴加较浓的NaOH溶液能促进银镜反应的发生,此法不适用于检验醛基,请解释原因
您最近一年使用:0次
2022-04-02更新
|
1061次组卷
|
7卷引用:湖南省常德市第一中学2022-2023学年高三下学期5月月考化学试题
2 . FeSO4溶液放置在空气中容易变质,因此为了方便使用Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一种浅蓝绿色的晶体。
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
①请用离子方程式解释FeSO4溶液产生淡黄色浑浊的原因___________________ 。
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:__________________________________________________ 。
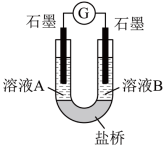
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式_________________ 。
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为______ 。
③对比实验_____ 和_____ 还可得出在一定 pH范围内,溶液酸碱性变化是对O2氧化性强弱的影响因素。
④对【资料3】实验事实的解释为____________________ 。
I.某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都经过煮沸、冷却后再使用。向FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作
II.实验探究影响溶液中Fe2+稳定性的因素
(1)配制0.8 mol/L的FeSO4溶液(pH=4.5)和0.8 mol/L的(NH4)2Fe(SO4)2溶液(pH=4.0),各取2 mL上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加2滴0.01mol/L的KSCN溶液,15min后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液,FeSO4溶液则出现淡黄色浑浊。
【资料1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 pH | 7.6 | 2.7 |
| 完全沉淀 pH | 9.6 | 3.7 |
②讨论影响Fe2+稳定性的因素,小组同学提出以下3种假设:
假设1:其他条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中Fe2+稳定性较好。
假设2:其他条件相同时,在一定 pH范围内,溶液 pH越小Fe2+稳定性越好。
假设3:
(2)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分别控制溶液A(0.2 mol/L NaCl)和溶液B(0.1mol/L FeSO4)为不同的 pH,观察记录电流计读数,对假设2进行实验研究,实验结果如下表所示。
| 序号 | A 0.2mol/LNaCl | B 0.1mol/LFeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |

【资料2】原电池装置中,其他条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原电池的电流越大。
【资料3】常温下,0.1mol/LpH=1的FeSO4溶液比pH=5的FeSO4溶液稳定性更好。
根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U型管中左池的电极反应式
②对比实验1和2(或3和4),在一定pH范围内,可得出的结论为
③对比实验
④对【资料3】实验事实的解释为
您最近一年使用:0次
2020-04-02更新
|
346次组卷
|
4卷引用:山东省2020届高三模拟考试化学试题
山东省2020届高三模拟考试化学试题北京市门头沟区2020届高三3月综合练习化学试题(已下线)北京市2019-2020学年高三各区一模化学考试分类汇编:科学探究江苏省昆山中学2022-2023学年高一下学期期中考试化学试题
名校
解题方法
3 . FeSO4溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)2•6H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______ 。向 FeSO4溶液中加入饱和(NH4)2SO4溶液,经过操作_______ 、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
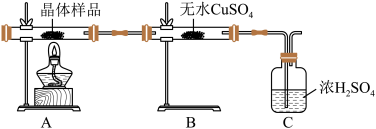
①如图所示实验的目的是_______ ,C 装置的作用是_______ 。
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
【资料 1】
①请用离子方程式解释 FeSO4溶液产生淡黄色浑浊的原因_______ 。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______ 。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,
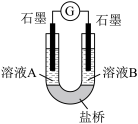
观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
【资料 2】原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
【资料 3】常温下,0.1mol/L pH=1 的 FeSO4溶液比 pH=5 的 FeSO4溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 形管中左池的电极反应式____________ 。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________ 。
③对比实验____________ 和____________ ,还可得出在一定pH 范围内溶液酸碱性变化对 O2氧化性强弱的影响因素。
④ 对【资料 3】实验事实的解释为____________ 。
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是

取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
【资料 1】
| 沉淀 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.6 | 2.7 |
| 完全沉淀pH | 9.6 | 3.7 |
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,

观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
| 序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
| 实验1 | pH=1 | pH=5 | 8.4 |
| 实验2 | pH=1 | pH=1 | 6.5 |
| 实验3 | pH=6 | pH=5 | 7.8 |
| 实验4 | pH=6 | pH=1 | 5.5 |
【资料 3】常温下,0.1mol/L pH=1 的 FeSO4溶液比 pH=5 的 FeSO4溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 形管中左池的电极反应式
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为
③对比实验
④ 对【资料 3】实验事实的解释为
您最近一年使用:0次
2020-04-16更新
|
458次组卷
|
2卷引用:山东省济宁市嘉祥县第一中学2020届高三下学期第三次质量检测化学试题
解题方法
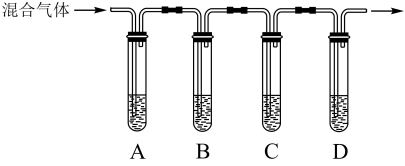
4 . 某化学小组在实验室中对SO2进行探究。回答下列问题:
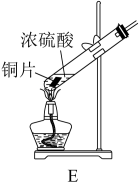
(1)①学生甲用如图E装置制备SO2。写出该反应的化学方程式___________ ,该反应中,硫酸体现的的性质有___________
A.氧化性 B.还原性 C.酸性 D.碱性
②学生乙以 粉末和
粉末和 为原料制取SO2,反应的化学方程式是:
为原料制取SO2,反应的化学方程式是:___________
③现欲收集一瓶干燥的SO2,选用下图中的A、B、C、D装置,其连接顺序(按气流方向,用小写字母表示,可重复选用)为:___________
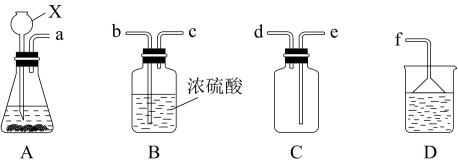
(2)学生丙用浓H2SO4和蔗糖反应,得到的气体中含有SO2、CO2。现选择下图中的装置,验证混合气体中存在CO2和SO2,A和C中盛放的是品红溶液,B中盛放的是酸性高锰酸钾溶液。其中,能证明存在CO2的现象是___________ 。
(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
①黑色固体可能含有CuO、CuS、 。
。
②CuS和 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
③向含微量 的溶液中滴加
的溶液中滴加 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。
现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加 溶液,未见红褐色沉淀,由此所得结论是
溶液,未见红褐色沉淀,由此所得结论是___________ 。另取少量黑色沉淀,加入足量稀硝酸并加热,发现黑色固体最终完全溶解,溶液变为蓝色,有无色气泡生成,管口处出现红棕色。试写出CuS溶于足量稀硝酸的离子方程式:___________
为测定黑色沉淀中 的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应:
的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应: ,
,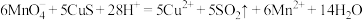 ,恰好用去KMnO4溶液23.50mL。则混合物中
,恰好用去KMnO4溶液23.50mL。则混合物中 的质量分数为
的质量分数为___________
(1)①学生甲用如图E装置制备SO2。写出该反应的化学方程式

A.氧化性 B.还原性 C.酸性 D.碱性
②学生乙以
 粉末和
粉末和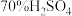 为原料制取SO2,反应的化学方程式是:
为原料制取SO2,反应的化学方程式是:③现欲收集一瓶干燥的SO2,选用下图中的A、B、C、D装置,其连接顺序(按气流方向,用小写字母表示,可重复选用)为:

(2)学生丙用浓H2SO4和蔗糖反应,得到的气体中含有SO2、CO2。现选择下图中的装置,验证混合气体中存在CO2和SO2,A和C中盛放的是品红溶液,B中盛放的是酸性高锰酸钾溶液。其中,能证明存在CO2的现象是

(3)学生甲实验中,大试管内产生了大量黑色固体。查阅资料知:
①黑色固体可能含有CuO、CuS、
 。
。②CuS和
 不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。
不溶于稀盐酸、稀硫酸,但加热下可溶于稀硝酸。③向含微量
 的溶液中滴加
的溶液中滴加 溶液,能产生红褐色沉淀。
溶液,能产生红褐色沉淀。现取少量黑色沉淀,加入稀硫酸,充分振荡以后,再滴加
 溶液,未见红褐色沉淀,由此所得结论是
溶液,未见红褐色沉淀,由此所得结论是为测定黑色沉淀中
 的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应:
的百分含量,取0.2000g黑色沉淀,在酸性溶液中用0.1000mol/LKMnO4溶液处理,发生反应: ,
,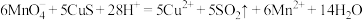 ,恰好用去KMnO4溶液23.50mL。则混合物中
,恰好用去KMnO4溶液23.50mL。则混合物中 的质量分数为
的质量分数为
您最近一年使用:0次
2021-05-20更新
|
359次组卷
|
2卷引用:江苏省无锡先锋高级中2020-2021学年高一下学期第一次月考化学试题
5 . 亚硫酸钠(Na2SO3)是一种重要的化工产品,常用作防腐剂、漂白剂、脱氯剂等。为探究 Na2SO3的性质,进行了如下实验。
【性质预测】
(1)Na2SO3中硫元素的化合价是_______ ,属于S元素的中间价态,既具有氧化性,又具有还原性。
【实验验证】
资料:酸性条件下,KMnO4 被还原为无色的 Mn2+。
【分析解释】
(2)实验ⅰ中,反应的离子方程式是_______ 。
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是_______ 。
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO 具有氧化性,可产生 S;
具有氧化性,可产生 S;
假设 b:空气中存在 O2,在酸性条件下,由于_______ (用离子方程式表示),可产生 S;
假设 c:酸性溶液中的 SO 具有氧化性,可产生 S。
具有氧化性,可产生 S。
②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入_______ (填试剂名称),产生有臭鸡蛋气味的气体,离子方程式为_______ ,溶液未变浑浊。
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:_______ 。
【性质预测】
(1)Na2SO3中硫元素的化合价是
【实验验证】
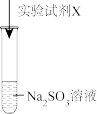 | 实验序号 | 实验试剂X | 实验现象 |
| ⅰ | KMnO4溶液、稀硫酸 | 紫色褪去,变为无色 | |
| ⅱ | Na2S 溶液、稀硫酸 | 加入Na2S溶液,无明显现象;再加入稀硫酸,产生淡黄色浑浊。 |
【分析解释】
(2)实验ⅰ中,反应的离子方程式是
(3)实验ⅱ中,能说明 Na2S 在酸性条件下被氧化的实验现象是
【继续探究】
(4)甲同学认为实验ⅱ的现象不能直接得出“Na2SO3 具有氧化性”。
①对淡黄色浑浊产生的原因作出如下假设:
假设 a:酸性溶液中的 SO
 具有氧化性,可产生 S;
具有氧化性,可产生 S;假设 b:空气中存在 O2,在酸性条件下,由于
假设 c:酸性溶液中的 SO
 具有氧化性,可产生 S。
具有氧化性,可产生 S。②设计实验 iii 证实了假设 a和b不是产生 S 的主要原因。
实验 iii:向 Na2S溶液中加入
(5)结合实验 ii 和 iii,用离子方程式解释实验ⅱ中产生淡黄色浑浊的原因:
您最近一年使用:0次
名校
解题方法
6 . 在学习氧化还原反应时,某同学提出 具有较强氧化性,
具有较强氧化性, 具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
(1)研究 溶液与
溶液与 溶液反应产物。向盛有
溶液反应产物。向盛有 溶液的试管中加入
溶液的试管中加入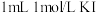 溶液,振荡试管,向其中加入
溶液,振荡试管,向其中加入______ ,溶液无明显变化。
(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证 的氧化性。将光亮的铁丝伸入
的氧化性。将光亮的铁丝伸入 溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的
溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的 除尽后,进行了如下实验。可选用试剂:①
除尽后,进行了如下实验。可选用试剂:① 溶液 ②
溶液 ② 溶液 ③酸性
溶液 ③酸性 溶液 ④
溶液 ④ 溶液。
溶液。
请完成下表:
(实验结论)铁的氧化产物为 和
和 ,则
,则 氧化性强于
氧化性强于 ,已知
,已知 氧化性强于
氧化性强于 ,则
,则 可与
可与 发生氧化还原反应。
发生氧化还原反应。
另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是______ 。
(3)通过原电池原理探究 与
与 之间的氧化还原反应
之间的氧化还原反应

按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近,根据下表数据,盐桥中应选择______ 作为电解质。
实验开始后,电流表指针发生偏转,正极电极表面有光亮的银析出,则该原电池的负极反应方程式为______ 。
(实验结论)______ 。
(4)查阅资料可知常温反应: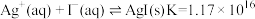 ;
;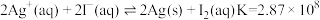 。试从速率与平衡两个角度解释
。试从速率与平衡两个角度解释 溶液与
溶液与 溶液反应混合只发生沉淀反应而无明显氧化还原反应的可能原因
溶液反应混合只发生沉淀反应而无明显氧化还原反应的可能原因______ 。
 具有较强氧化性,
具有较强氧化性, 具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。
具有较强还原性,二者也可发生氧化还原反应。为验证这个问题,该学生设计了系列实验。(1)研究
 溶液与
溶液与 溶液反应产物。向盛有
溶液反应产物。向盛有 溶液的试管中加入
溶液的试管中加入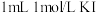 溶液,振荡试管,向其中加入
溶液,振荡试管,向其中加入(实验结论)二者混合只发生沉淀反应,无明显氧化还原反应。
(2)验证
 的氧化性。将光亮的铁丝伸入
的氧化性。将光亮的铁丝伸入 溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的
溶液中,一段时间后将铁丝取出。为检验溶液中铁的氧化产物,将溶液中的 除尽后,进行了如下实验。可选用试剂:①
除尽后,进行了如下实验。可选用试剂:① 溶液 ②
溶液 ② 溶液 ③酸性
溶液 ③酸性 溶液 ④
溶液 ④ 溶液。
溶液。请完成下表:
| 操作 | 现象 | 结论 |
取少量除尽 后的溶液于试管中,加入 后的溶液于试管中,加入 溶液,振荡 溶液,振荡 | 存在 | |
取少量除尽 后的溶液于试管中,加入1~2滴 后的溶液于试管中,加入1~2滴 | 存在 |
 和
和 ,则
,则 氧化性强于
氧化性强于 ,已知
,已知 氧化性强于
氧化性强于 ,则
,则 可与
可与 发生氧化还原反应。
发生氧化还原反应。另一同学用pH计测得常温该硝酸银溶液的pH为5.50,于是该同学对实验结论提出质疑。你认为他提出质疑的理由可能是
(3)通过原电池原理探究
 与
与 之间的氧化还原反应
之间的氧化还原反应
按图设计原电池。电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近,根据下表数据,盐桥中应选择
| 阳离子 | 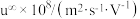 | 阴离子 | 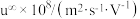 |
 | 4.07 |  | 4.61 |
 | 5.19 |  | 7.40 |
 | 6.59 |  | 7.91 |
 | 7.62 |  | 8.27 |
(实验结论)
(4)查阅资料可知常温反应:
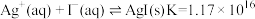 ;
;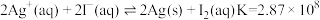 。试从速率与平衡两个角度解释
。试从速率与平衡两个角度解释 溶液与
溶液与 溶液反应混合只发生沉淀反应而无明显氧化还原反应的可能原因
溶液反应混合只发生沉淀反应而无明显氧化还原反应的可能原因
您最近一年使用:0次
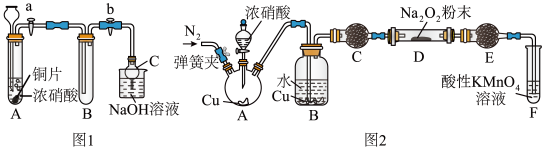
7 . 某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;
假设2:NO2氧化Na2O2。
(1)甲同学设计如图1装置进行实验:
①试管A中反应的离子方程式是_________________________________________ 。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为___________________ 。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设1正确,则NO2和Na2O2反应的化学方程式是_______________________ 。
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O;酸性条件下,NO能与 反应生成
反应生成 和Mn2+。
和Mn2+。
(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是_________________ 。
②B中不能观察到的现象是____________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色b.有红棕色气泡产生c.有无色气泡产生
③C、E中所盛装的试剂不能是________ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_____________ 。
⑤充分反应后,检验D装置中产物的方法是:______________ ,则产物是NaNO2。

Ⅰ.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;
假设2:NO2氧化Na2O2。
(1)甲同学设计如图1装置进行实验:
①试管A中反应的离子方程式是
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B;向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2=2NaNO2;2NaNO2+2HCl=2NaCl+NO2↑+NO↑+H2O;酸性条件下,NO能与
 反应生成
反应生成 和Mn2+。
和Mn2+。(3)丙同学用图2所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①在反应前,打开弹簧夹,通入一段时间N2,目的是
②B中不能观察到的现象是
a.铜片逐渐溶解,溶液变为蓝色b.有红棕色气泡产生c.有无色气泡产生
③C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为
⑤充分反应后,检验D装置中产物的方法是:
您最近一年使用:0次
8 . 某小组同学探究Cu和H2O2的反应。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:________ 。
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
(2)实验ⅱ中:溶液变蓝的原因是________ (用化学用语解释);经检验产生的气体为氧气,产生氧气的原因是________ 。
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。
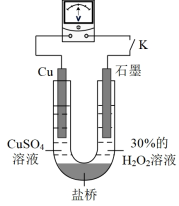
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:_________ 。利用该方法也可证明酸性增强可提高H2O2的氧化性,导致Cu溶解速率加快。
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是_______ 。
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:________ 。
(6)基于以上实验,影响Cu与H2O2反应速率的因素有________ 。
【猜想预测】
猜想1:Cu与H2O2不发生反应;
猜想2:Cu与H2O2可能发生氧化还原反应,H2O2作氧化剂。
【实验探究】
实验ⅰ:向装有0.5 g Cu的烧杯中加入20 mL 30% H2O2溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)通过该实验证明了猜想2成立,写出该反应的化学方程式:
【继续探究】
针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
资料:Cu2++ 4NH3⇌[ Cu(NH3)4]2+,[ Cu(NH3)4]2+为深蓝色;Cu(OH)2可溶于氨水形成深蓝色溶液。
| 装置 | 序号 | 试剂a | 现象 |
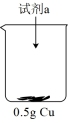 | ⅱ | 20 mL 30% H2O2与4 mL 5 mol/L H2SO4混合液 | Cu表面很快生产少量气泡,溶液逐渐变蓝,产生较多气泡 |
| ⅲ | 20 mL 30% H2O2与4 mL5 mol/L氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(2)实验ⅱ中:溶液变蓝的原因是
(3)对比实验ⅰ和ⅲ,为探究氨水对Cu的还原性或H2O2氧化性的影响,该同学利用如图装置继续实验。

已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U形管右侧溶液中滴加氨水后,电压不变。
c.继续向U形管左侧溶液中滴加氨水后,电压增大了y。
该实验的结论:
(4)对比实验ⅱ和ⅲ,实验ⅲ中产生氧气速率明显更快,可能的原因是
(5)实验ⅲ有少量蓝色不溶物,小组同学加入少量NH4Cl可使其溶解,结合文字和化学用语解释不溶物溶解的原因:
(6)基于以上实验,影响Cu与H2O2反应速率的因素有
您最近一年使用:0次
2020-06-06更新
|
339次组卷
|
3卷引用:北京市中央民族大学附属中学2021-2022学年高三上学期12月月考化学试题
名校
解题方法
9 . 实验小组探究 溶液与
溶液与 溶液的反应:
溶液的反应:
【资料】① 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;
② 可与
可与 发生反应:
发生反应:
③在溶液中 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色
Ⅰ.实验小组设计了下列实验验证了 溶液与
溶液与 溶液的反应:
溶液的反应:
(1)实验1-1的目的是_______ 。
(2)请用离子方程式表示实验1-2中的化学反应_______ 。
Ⅱ.实验小组发现, 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
猜想1:其他条件相同时, 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)
猜想2:其他条件相同时, 与
与 不反应。
不反应。 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。
(3)请补全猜想1:_______ 与猜想2:_______ 。
(4)根据资料2可知 的还原性
的还原性_______ (填“强于”或“弱于”) ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为_______ (填“猜想1”或“猜想2”)的依据。
Ⅲ.为了进一步研究 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
(5)请补全表格中①_______ 与②_______
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是_______ 。
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
(8)结合实验2-2的数据,计算 内的
内的 消耗的速率
消耗的速率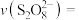
_______ 
 溶液与
溶液与 溶液的反应:
溶液的反应:【资料】①
 是强电解质,具有强氧化性。
是强电解质,具有强氧化性。 易被还原为
易被还原为 ;
;②
 可与
可与 发生反应:
发生反应:
③在溶液中
 淀粉复合物必须有足够的浓度才能显示明显的蓝色
淀粉复合物必须有足够的浓度才能显示明显的蓝色Ⅰ.实验小组设计了下列实验验证了
 溶液与
溶液与 溶液的反应:
溶液的反应:编号 | 1-1 | 1-2 |
实验操作 |
|
|
现象 | 无明显现象 | 溶液立即变蓝 |
(2)请用离子方程式表示实验1-2中的化学反应
Ⅱ.实验小组发现,
 溶液中若含有
溶液中若含有 ,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:
,溶液并不会立刻变蓝,而会等待一段时间后再变蓝。为了解释这一现象,甲同学对此提出两种猜想:猜想1:其他条件相同时,
 与
与 反应速率_______
反应速率_______ 与
与 的反应速率,使溶液中
的反应速率,使溶液中 浓度降低,化学反应速率变慢。(填“
浓度降低,化学反应速率变慢。(填“ ”或“
”或“ ”)
”)猜想2:其他条件相同时,
 与
与 不反应。
不反应。 与
与 反应速率_______
反应速率_______ 与
与 的反应速率(填“
的反应速率(填“ ”或“
”或“ ”)。
”)。(3)请补全猜想1:
(4)根据资料2可知
 的还原性
的还原性 ,甲同学认为,该事实可以用来作为
,甲同学认为,该事实可以用来作为Ⅲ.为了进一步研究
 的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。
的作用,小组同学分别向两支试管中依次加入下列试剂,并记录变他时间,如下表所示。编号 |
|
| 淀粉 溶液 |
| ① | 变色时间 |
2-1 |
|
| 2滴 |
| ② | 立即 |
2-2 |
|
| 2滴 |
|
|
|
(6)乙同学根据现有数据证明Ⅱ中猜想1不成立,理由是
Ⅳ.查阅文献表明Ⅱ中猜想2成立:
(7)下列说法正确的是_______(填字母)。
A.增加溶液中 浓度, 浓度, 的初始反应速率会增加 的初始反应速率会增加 |
B.增加溶液中 浓度,溶液变蓝时间可能增加 浓度,溶液变蓝时间可能增加 |
C.增加溶液中 浓度,溶液可能无法变蓝 浓度,溶液可能无法变蓝 |
| D.升高溶液温度,溶液开始变蓝时间可能增加 |
 内的
内的 消耗的速率
消耗的速率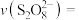

您最近一年使用:0次
名校
10 . 某化学兴趣小组同学在查阅资料的基础上对乙醛与新制氢氧化铜的反应进行了探究。
(1)乙醛与新制氢氧化铜反应的化学方程式为___ 。
【查阅资料】i.乙醛在碱性条件下可发生缩合等反应生成有色物质;
ii.溶液的酸碱性可能会影响物质的氧化性、还原性。
【初步探究】
(2)实验Ⅰ的目的是 ___ 。
(3)甲同学为了检验实验Ⅱ中红色固体的成分进行了如下实验:取少量红色固体于试管中加入适量稀HNO3,振荡,观察到红色固体完全溶解,得蓝色溶液。
甲同学认为,该实验现象说明实验Ⅱ中反应生成了Cu。
乙同学认为甲的观点不正确,理由是Cu2O也可能被硝酸氧化,产生上述现象。该反应的离子方程式为___ 。
【深入探究】乙同学对比实验Ⅱ和实验Ⅲ,对实验Ⅱ能够发生反应的原因提出了猜想:
乙醛的还原性随着溶液碱性的增强而增强,并利用实验Ⅳ进行验证。
(4)实验IV-1中,Na2SO4溶液的作用是使B池溶液具有 ___ ;同时保证中性环境,与实验IV-2对比。
(5)实验IV-2中,B池中的试剂是___ 。
(6)根据实验现象,乙同学认为其猜想成立。乙同学观察到的实验现象是___ 。
(7)综合上述实验,小组同学经过深入讨论,认为除了乙同学的猜想外,与实验Ⅲ相比,实验Ⅱ能够发生反应的原因还可能有___ 和 ___ 。
(1)乙醛与新制氢氧化铜反应的化学方程式为
【查阅资料】i.乙醛在碱性条件下可发生缩合等反应生成有色物质;
ii.溶液的酸碱性可能会影响物质的氧化性、还原性。
【初步探究】
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 向试管中加入4mL10%NaOH溶液,滴入0.5mL水,加入0.5mL 40%乙醛溶液,振荡,在酒精灯上加热至沸腾后保持沸腾 | 无色溶液逐渐变黄并变浑浊加热后得黄色浊液之后无明显变化 |
| Ⅱ | 向试管中加入4mL10%NaOH溶液,滴入0.5mL 2mLCuSO4溶液,振荡,加入0.5%mL 40%乙醛溶液,振荡;在酒精灯上加热至沸腾后保持沸腾 | 蓝色浊液依次呈绿色、黄色、橙色最终生成红色固体之后无明显变化 |
| Ⅲ | 向试管中加入4mL水,滴入0.5mL 2mLCuSO4溶液,振荡,加入0.5mL 40%乙醛溶液,振荡,在酒精灯上加热至沸腾后保持沸腾 | 蓝色溶液无明显变化 |
(3)甲同学为了检验实验Ⅱ中红色固体的成分进行了如下实验:取少量红色固体于试管中加入适量稀HNO3,振荡,观察到红色固体完全溶解,得蓝色溶液。
甲同学认为,该实验现象说明实验Ⅱ中反应生成了Cu。
乙同学认为甲的观点不正确,理由是Cu2O也可能被硝酸氧化,产生上述现象。该反应的离子方程式为
【深入探究】乙同学对比实验Ⅱ和实验Ⅲ,对实验Ⅱ能够发生反应的原因提出了猜想:
乙醛的还原性随着溶液碱性的增强而增强,并利用实验Ⅳ进行验证。
| 实验装置 | 序号 | A池试剂 | B池试剂 | 实验现象 |
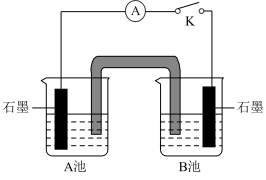 | Ⅳ-1 | 0.2% CuSO4溶液 | NaSO4溶液和40%乙醛溶液按体积比9:1混合 | 指针不偏转,A、B池中均无明显变化 |
| Ⅳ-2 | 0.2% CuSO4溶液 | —— | —— |
(5)实验IV-2中,B池中的试剂是
(6)根据实验现象,乙同学认为其猜想成立。乙同学观察到的实验现象是
(7)综合上述实验,小组同学经过深入讨论,认为除了乙同学的猜想外,与实验Ⅲ相比,实验Ⅱ能够发生反应的原因还可能有
您最近一年使用:0次