名校
1 . 某小组同学制备碘酸盐( )并探究其性质。
)并探究其性质。
资料:① 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。
②碘酸钙 [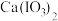 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。
③ 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。
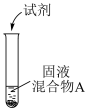
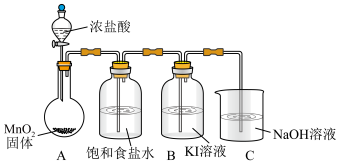
实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热圆底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。
(1)A装置发生的化学方程式为___________ 。
(2)C装置发生的离子方程式为___________ 。
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。
①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为___________ 。
原因二:___________ (填化学式)在酸性条件下将溶液中的 氧化。
氧化。
②为了进一步证明在酸性条件下 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:
ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
ⅱ.向无色溶液X,加入与(3)等量的盐酸和 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。
ⅲ.取少量洗涤后的沉淀Y加入稀 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。
ⅳ.……
a.由实验ⅰ、ⅱ得出结论:___________ 。
b.由实验ⅲ和ⅳ得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象___________ 。
(4)根据实验ⅲ得出:氧化性
___________  (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是___________ 。
(5)查阅资料发现,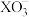 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因___________ 。
 )并探究其性质。
)并探究其性质。资料:①
 可与
可与 溶液反应生成
溶液反应生成 和
和 。
。②碘酸钙 [
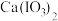 ]为难溶于水、能溶于硝酸的白色固体。
]为难溶于水、能溶于硝酸的白色固体。③
 的氧化性,
的氧化性, 的还原性与溶液的酸碱性无关:
的还原性与溶液的酸碱性无关: 与氧化性随溶液酸性增强而增强(X为
与氧化性随溶液酸性增强而增强(X为 、
、 或I)。
或I)。实验装置如图(加热与夹持装置略)
I.打开A中分液漏斗活塞,加热圆底烧瓶;一段时间后,B中溶液由无色变为棕黄色。
II.将B中棕黄色溶液倒入烧杯中,再加入
 溶液,烧杯中溶液由棕黄色变为无色。
溶液,烧杯中溶液由棕黄色变为无色。(1)A装置发生的化学方程式为
(2)C装置发生的离子方程式为
(3)取少量步骤Ⅱ后所得无色溶液,加入过量盐酸和
 ,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下
,振荡后静置,溶液分层,上层呈浅黄色,下层呈紫色。甲同学得出结论:在酸性条件下 可以氧化
可以氧化 为
为 。
。①乙同学认为上述结论不合理,可能原因如下:
原因一:空气中
 在酸性条件下将溶液中的
在酸性条件下将溶液中的 氧化,离子方程式为
氧化,离子方程式为原因二:
 氧化。
氧化。②为了进一步证明在酸性条件下
 可氧化
可氧化 为
为 ,完成如下实验:
,完成如下实验:ⅰ.另取与(3)等量的步骤Ⅱ后所得无色溶液,加入稍过量
 固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。
固体,振荡,充分反应后过滤得到无色溶液X和沉淀Y。ⅱ.向无色溶液X,加入与(3)等量的盐酸和
 ,振荡后静置,溶液分层,上、下层均几乎无色。
,振荡后静置,溶液分层,上、下层均几乎无色。ⅲ.取少量洗涤后的沉淀Y加入稀
 ,固体溶解,继续加入少量KI溶液,溶液呈黄色。
,固体溶解,继续加入少量KI溶液,溶液呈黄色。ⅳ.……
a.由实验ⅰ、ⅱ得出结论:
b.由实验ⅲ和ⅳ得出结论:在酸性条件下
 可以氧化
可以氧化 为
为 。补全实验ⅳ的操作和现象
。补全实验ⅳ的操作和现象(4)根据实验ⅲ得出:氧化性

 (填“
(填“ ”或“
”或“ ”),而实验ⅰ表明
”),而实验ⅰ表明 和
和 的氧化性强弱关系相反,原因是
的氧化性强弱关系相反,原因是(5)查阅资料发现,
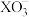 与相应的
与相应的 (
( ,
, )均有类似上述反应。浓度相同时,氧化性
)均有类似上述反应。浓度相同时,氧化性 ,但浓度均为
,但浓度均为 的
的 和
和 开始发生反应时的pH为1,而浓度均为
开始发生反应时的pH为1,而浓度均为 的
的 和
和 开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
开始发生反应的pH为5。试从原子结构的角度解释两个反应开始发生时pH不同的原因
您最近一年使用:0次
2023-05-01更新
|
855次组卷
|
3卷引用:重庆市万州第二高级中学2023-2024学年高三上学期7月月考化学试题
解题方法
2 . 某小组对Cu和 的反应进行相关实验探究。
的反应进行相关实验探究。
【实验探究】实验i:向装有0.5gCu的烧杯中加入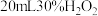 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
(1)写出该反应的化学方程式:___________ 。
【继续探究】针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
(2)实验ii中:溶液变蓝的原因是___________ (用离子反应方程式表示);经检验产生的气体为氧气,产生氧气先慢后快的原因是___________ 。(不考虑温度的影响)。
(3)对比实验i和iii,为探究氨水对Cu的还原性或 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
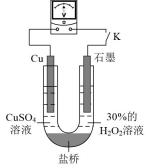
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①解释步骤c中电压增大的原因:___________ 。
②若向U型管左侧溶液中滴加硫酸后,电压不变,继续向U型管右侧溶液中滴加硫酸后,电压增大了z。则可以得出的结论是:___________ 。
(4)基于以上实验,影响Cu与 反应的因素有
反应的因素有___________ 。(任写一条)
(5)结合上述实验,下列说法正确的是___________ 。
A.电化学是研究物质氧化性、还原性的重要手段之一
B.实验ii中发生的反应中, 只体现氧化性
只体现氧化性
C.在还原反应(氧化反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强
 的反应进行相关实验探究。
的反应进行相关实验探究。【实验探究】实验i:向装有0.5gCu的烧杯中加入
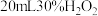 溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。
溶液,一段时间内无明显现象,10小时后,溶液中有少量蓝色浑浊,Cu片表面附着少量蓝色固体。(1)写出该反应的化学方程式:
【继续探究】针对该反应速率较慢,小组同学查阅资料,设计并完成了下列实验。
| 装置 | 序号 | 试剂a | 现象 |
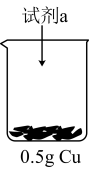 | ii | 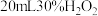 与 与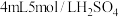 混合液 混合液 | Cu表面产生少量气泡,溶液逐渐变蓝,后产生较多气泡 |
| iii | 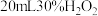 与 与 氨水混合液 氨水混合液 | 溶液立即变为深蓝色,产生大量气泡,Cu表面有少量蓝色不溶物 |
(3)对比实验i和iii,为探究氨水对Cu的还原性或
 氧化性的影响,该同学利用如图装置继续实验。
氧化性的影响,该同学利用如图装置继续实验。
已知:电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大。
a.K闭合时,电压为x。
b.向U型管右侧溶液中滴加氨水后,电压不变
c.继续向U型管左侧溶液中滴加氨水后,电压增大了y。
①解释步骤c中电压增大的原因:
②若向U型管左侧溶液中滴加硫酸后,电压不变,继续向U型管右侧溶液中滴加硫酸后,电压增大了z。则可以得出的结论是:
(4)基于以上实验,影响Cu与
 反应的因素有
反应的因素有(5)结合上述实验,下列说法正确的是
A.电化学是研究物质氧化性、还原性的重要手段之一
B.实验ii中发生的反应中,
 只体现氧化性
只体现氧化性C.在还原反应(氧化反应)中,增大反应物浓度或降低生成物浓度,氧化剂(还原剂)的氧化性(还原性)增强
您最近一年使用:0次
解题方法
3 . 某研究性学习小组学生根据氧化还原反应规律,探究NO2、NO与Na2O2反应的情况,提出假设并进行相关实验。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:
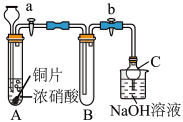
①试管A中反应的离子方程式是___________ 。
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为__________ 。
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是________________ 。乙同学用改进后的装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;带火星的木条未复燃,得出结论:假设正确。则NO2和Na2O2反应的化学方程式是_______________ 。
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是____________________ 。
②B中观察到的主要现象的是_________ (填字母编号)。
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是______ (填字母编号)。
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为_________________ 。
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,__________________ ,则产物是NaNO2。
I.从理论上分析Na2O2和NO2都既有氧化性又有还原性,于是提出如下假设:
假设1:Na2O2氧化NO2;假设2:NO2氧化Na2O2。
(1)甲同学设计如图装置进行实验:

①试管A中反应的离子方程式是
②待试管B中充满红棕色气体,关闭旋塞a和b;取下试管B,向其中加入适量Na2O2粉末,塞上塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将带火星的木条迅速伸进试管内,木条复燃。
③仪器C兼有防倒吸的作用,仪器C的名称为
结论:甲同学认为假设2正确。
(2)乙同学认为甲同学设计的实验存在缺陷,为达到实验目的,在A、B之间应增加一个装置,该装置的作用是
Ⅱ.该研究性学习小组同学还认为NO易与O2发生反应,应该更易被Na2O2氧化。查阅资料:2NO+Na2O2==2NaNO2;2NaNO2+2HCl==2NaCl+NO2↑+NO↑+H2O:酸性条件下,NO能与MnO4-反应生成NO3-和Mn2+。
(3)丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。

①在反应前,打开弹簧夹,通入一段时间N2,目的是
②B中观察到的主要现象的是
a.铜片逐渐溶解,溶液变为蓝色
b.有红棕色气泡产生
c.有无色气泡产生
③C、E中所盛装的试剂不能是
a.无水硫酸铜 b.无水氯化钙 c.碱石灰 d.生石灰
④F中发生反应的氧化剂与还原剂的物质的量之比为
⑤充分反应后,检验D装置中产物的方法是:取D装置中产物少许,
您最近一年使用:0次
名校
解题方法
4 . Ⅰ.铁黄是一种重要的化工产品。由生产钛白粉废渣制备铁黄的过程如下。
i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4
iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
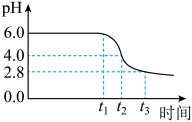
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。___________ 。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)___________ 0.1mol·L−1(填“>”“=”或“<”)。
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:___________ 。
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:___________ 。
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:___________ 。
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,___________ 。
③补充实验证实了②中的分析。
a是___________ ,b是___________ 。
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________ ,从原子结构角度说明理由___________ 。
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是___________ 。
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:___________ 。
(6)总结:物质氧化性和还原性变化的一般规律是___________ 。

i.钛白粉废渣成分:主要为FeSO4·H2O,含少量TiOSO4和不溶物
ii.TiOSO4+(x+1)H2O
 TiO2·xH2O↓+H2SO4
TiO2·xH2O↓+H2SO4iii.0.1mol·L−1Fe2+生成Fe(OH)2,开始沉淀时pH=6.3,完全沉淀时pH=8.3
0.1mol·L−1Fe3+生成FeOOH,开始沉淀时pH=1.5,完全沉淀时pH=2.8
(一)纯化:加入过量铁粉,充分反应后,分离混合物
(二)制备晶种
为制备高品质铁黄产品,需先制备少量铁黄晶种。过程及现象是:向一定浓度FeSO4溶液中加入氨水,产生白色沉淀,并很快变成灰绿色。滴加氨水至pH为6.0时开始通空气并记录pH变化(如下图)。
②产生白色沉淀后的pH低于资料iii中的6.3.原因是:沉淀生成后c(Fe2+)
③0-t1时段,pH几乎不变;t1-t2时段,pH明显降低。结合方程式解释原因:
④pH≈4时制得铁黄晶种。若继续通入空气,t3后pH几乎不变,此时溶液中c(Fe2+)仍降低,但c(Fe3+)增加,且c(Fe2+)降低量大于c(Fe3+)增加量。结合总方程式说明原因:
Ⅱ.某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。
(2)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2
①电极反应式:
i.还原反应:MnO2+2e-+4H+=Mn2++2H2O
ii.氧化反应:
②根据电极反应式,分析A中仍存在盐酸和MnO2的原因。
i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。
ii.随c(Cl-)降低,
③补充实验证实了②中的分析。
| 实验操作 | 试剂 | 产物 | |
| I |
| 较浓H2SO4 | 有氯气 |
| Ⅱ | a | 有氯气 | |
| Ⅲ | a+b | 无氯气 |
(3)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是
(4)根据(2)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是
(5)Ag分别与1mol·L−1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:
(6)总结:物质氧化性和还原性变化的一般规律是
您最近一年使用:0次
2023-10-31更新
|
364次组卷
|
2卷引用:北京市日坛中学2023-2024学年高三上学期10月检测化学试题
5 . 下面是某化学学习小组的同学进行研究性学习的过程,请你参与并协助他们完成相关学习任务。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是 (用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
② ;
③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br— )= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。
试通过计算判断:溴与乙醛发生反应的化学方程式为 。
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 。
(3)烧杯B内盛装的液体可以是 (写出一种即可,在题给物质中找)。
I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是 (用所学的知识回答)。
(2)小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色。该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
② ;
③由于醛基具有还原性,溴将乙醛氧化为乙酸。
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br— 的物质的量。
(3)方案一是否可行 (填“是”或“否”),理由是 。
(4)小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br— )= mol,则说明溴与乙醛发生取代反应。
(5)小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3—KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2。
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL。
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g。
试通过计算判断:溴与乙醛发生反应的化学方程式为 。
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表:
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |

请回答下列问题:
(1)试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件) 。
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在 ;目的是 ;当试管A内的主要反应完成后温度计水银球的位置应在 ,目的是 。
(3)烧杯B内盛装的液体可以是 (写出一种即可,在题给物质中找)。
您最近一年使用:0次
2019-01-30更新
|
292次组卷
|
2卷引用:2016届云南省玉溪一中高三第一次月考试题化学试卷
6 . 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30 mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
① 能否各取少许固体用舌头品尝?_____ 。(选填“能”或“不能”)
② 用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有___ 性。
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置如图所示。

已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 写出装置I中发生反应的化学方程式___________________________________ 。
② 水_______ (选填“能"或“不能”)作为装置II中的试剂,理由是_________________ 。
③ 装置III中反应完全后,接下来的操作是_________________________________ 。
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量_______ (选填“增多”、“减少"或“不变”),原因可能是______________ (用化学方程式解释)。
活动一:查阅资料
NaNO2有毒,具有氧化性和还原性,NaNO2溶液显碱性,肉类在放置过程中,NaNO3逐渐转化为NaNO2,国家规定肉制品中NaNO2含量不能超过30 mg/kg。
活动二:鉴别NaNO2与食盐
(1)NaNO2与食盐的外观相似,易被当成食盐误用,分析以下两种鉴别方法:
① 能否各取少许固体用舌头品尝?
② 用稀硫酸、淀粉和KI溶液鉴别,溶液变蓝的是NaNO2具有
活动三:探究NaNO3与NaNO2的相互转化
(2)制取NaNO2与NaNO3混合溶液的装置如图所示。

已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 写出装置I中发生反应的化学方程式
② 水
③ 装置III中反应完全后,接下来的操作是
(3)将NaNO2与NaNO3混合溶液露置于空气,隔夜后,测得溶液的pH减小,则溶液中NaNO2的含量
您最近一年使用:0次
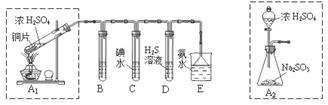
7 . 某兴趣小组设计如下图实验装置进行实验。
Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:

(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:

Ⅰ、探究大气污染物SO2的性质
(1)为了实现绿色环保的目标,能否用上图A2代替A1装置 (填“能”或“否”)。
(2)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为 ,C中反应的离子方程式为 ,D中反应的化学方程式为 。
Ⅱ、探究铜片与浓H2SO4反应的产物
实验结束,发现在铜片表面附着黑色固体。查阅资料得知:此黑色固体可能含有CuO、CuS、Cu2S。常温下CuS和Cu2S都不溶于稀盐酸,在空气中煅烧都转化为Cu2O和SO2。该小组同学收集一定量黑色固体,按如下实验方案探究其成分:

(3)步骤Ⅱ 中检验滤渣洗涤干净的实验方法是_____________________________。
(4)黑色固体的成分是________________。
Ⅲ、尾气处理
用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。
(5)氨水吸收过量SO2的反应的离子方程式为 。
(6)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。
现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、
2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则“吸收液” 中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 。 | , 则“吸收液”中存在 SO32-。 |
| 步骤3: 。 | , 则“吸收液”中存在 HSO3-。 |
您最近一年使用:0次
8 . 铬是一种银白色金属,化学性质稳定,以+2、+3和+6价为常见价态.工业上以铬铁矿(主要成分为FeO•Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产金属铬和重铬酸钠Na2Cr2O7•2H2O(已知Na2Cr2O7是一种强氧化剂),其主要工艺流程如下:
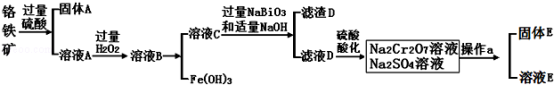
查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42﹣
②常温下,Ksp[Cr(OH)3]=6.3×10﹣31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝 热反应制取金属铬的化学方程式_________________ .
(2)酸化滤液D时,不选用盐酸的原因是____________ .
(3)固体E的主要成分是Na2SO4,根据如图分析操作a为___________ 、____________ .
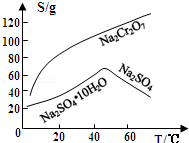
(4)已知含+6价铬的污水会污染环境.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72﹣,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为______________ ;
②下列溶液中可以代替上述流程中Na2S2O3溶液的是___________ (填选项序号);
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全_____________ ;
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole﹣,则加入Na2S2O3溶液时发生反应的离子方程式为_______ .

查阅资料得知:
①常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42﹣
②常温下,Ksp[Cr(OH)3]=6.3×10﹣31
回答下列问题:
(1)工业上常采用热还原法制备金属铬,写出以Cr2O3为原料,利用铝 热反应制取金属铬的化学方程式
(2)酸化滤液D时,不选用盐酸的原因是
(3)固体E的主要成分是Na2SO4,根据如图分析操作a为

(4)已知含+6价铬的污水会污染环境.电镀厂产生的镀铜废水中往往含有一定量的Cr2O72﹣,处理该废水常用还原沉淀法,具体流程如下:

①Cr(OH)3的化学性质与Al(OH)3相似.在上述生产过程中加入NaOH溶液时要控制溶液的pH不能过高,是因为
②下列溶液中可以代替上述流程中Na2S2O3溶液的是
| A.FeSO4溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.Na2SO3溶液 |
③调整溶液的pH=5时,通过列式计算说明溶液中的Cr3+是否沉淀完全
④上述流程中,每消耗0.1molNa2S2O3转移0.8mole﹣,则加入Na2S2O3溶液时发生反应的离子方程式为
您最近一年使用:0次
2016-12-09更新
|
284次组卷
|
2卷引用:2016届江西省新余四中高三上学期第一次段考化学试卷
名校
解题方法
9 . 高铁酸盐( )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知: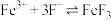
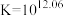

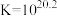
I.制备高铁酸盐
(1)制备 的原理是:
的原理是:

________
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的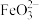 。此过程的反应为
。此过程的反应为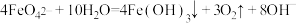 、
、___________ 。
为研究使 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中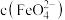 成正比。
成正比。

(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是___________ 。
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:___________ 。
(5)“—■—”曲线为___________ (填入“试管c”或“试管d”)的实验结果,理由是___________ 。
(6)综合以上讨论,任意写出一种能稳定 的方法
的方法___________ 。
 )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:
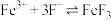
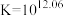

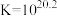
I.制备高铁酸盐
(1)制备
 的原理是:
的原理是:
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的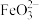 。此过程的反应为
。此过程的反应为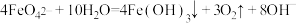 、
、为研究使
 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:| 序号 | X | 现象 | |
 | a | 2滴0.01 mol/L KI | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01 mol/L NaF 溶液 | ||
| d | 2滴0.01 mol/L  溶液 溶液 |
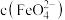 成正比。
成正比。
(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:
(5)“—■—”曲线为
(6)综合以上讨论,任意写出一种能稳定
 的方法
的方法
您最近一年使用:0次
2023-05-07更新
|
588次组卷
|
2卷引用:北京市第五中学通州分校2023-2024学年高三上学期12月练习二化学试题
10 . 下表是元素周期表中的一部分。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是______ ,氧化性最强的单质是____ ,还原性最强的单质是_____ 。
(2)最高价氧化物对应的水化物中,碱性最强的是___________ ,酸性最强的是___________ ,呈两性的是_______________ 。
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是______________ 。
(4)在B、C、D、G、I中,原子半径最大的是______________________ 。
(5)元素C与I形成的化合物的电子式是________________________ 。

根据A—J在周期表中的位置,用元素符号或化学式回答下列问题:
(1)化学性质最不活泼的元素是
(2)最高价氧化物对应的水化物中,碱性最强的是
(3)A分别与E、F、G、H、I形成的化合物中,最稳定的是
(4)在B、C、D、G、I中,原子半径最大的是
(5)元素C与I形成的化合物的电子式是
您最近一年使用:0次
2016-12-09更新
|
192次组卷
|
2卷引用:2014-2015学年四川省乐山市五通桥中学高一下化学试卷