名校
解题方法
1 . “84消毒液”广泛应用于杀菌消毒,其有效成分是 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
资料:i. 的电离常数为
的电离常数为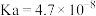 ;
; 的电离常数为
的电离常数为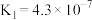 、
、
ii.碘的化合物主要以 和
和 的形式存在,
的形式存在, 。
。
iii.碘单质能与 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I.制备消毒液(夹持装置略)

(1)制备 的离子反应方程式
的离子反应方程式_______ 。
(2)结合资料i,写出D中反应的化学方程式_______ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是_______ 。
假设2:过量的 将反应生成的
将反应生成的 氧化为
氧化为 。
。
设计实验b证实了假设2成立。 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是_______ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由_______ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据_______ 。
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是_______ 。
 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。资料:i.
 的电离常数为
的电离常数为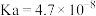 ;
; 的电离常数为
的电离常数为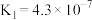 、
、
ii.碘的化合物主要以
 和
和 的形式存在,
的形式存在, 。
。iii.碘单质能与
 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I.制备消毒液(夹持装置略)

(1)制备
 的离子反应方程式
的离子反应方程式(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9g 固体 固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9g 固体,再加入1 固体,再加入1 盐酸10mL 盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量 固体(小于0.5g) 固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是
假设2:过量的
 将反应生成的
将反应生成的 氧化为
氧化为 。
。设计实验b证实了假设2成立。
 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是
您最近一年使用:0次
2022-12-30更新
|
1184次组卷
|
4卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
2 . 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图所示的装置模拟制取并收集ClO2。
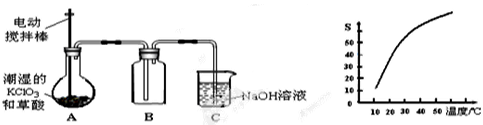
(1)B必须放在冰水浴中控制温度,其原因是________________________________ 。
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______ ;b______ ;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

① Ⅱ中反应的离子方程式是_________________________ 。
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式_______________________________________ 。
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量___________ 。(填“相同”,“不同”或“无法判断”)

(1)B必须放在冰水浴中控制温度,其原因是
(2)反应后在装置C中可得NaClO2溶液。已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2·3H2O,在温度高于38℃时析出晶体是NaClO2。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

① Ⅱ中反应的离子方程式是
② ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式
③ NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量
您最近一年使用:0次
2016-12-09更新
|
328次组卷
|
3卷引用:2016届河南省三门峡市陕州中学高三上学期第二次精英对抗赛化学试卷
3 . 某小组进行如下实验:向0.1mol·L-1 FeCl3溶液中通入SO2或加入Na2SO3溶液,均得到红色溶液。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。
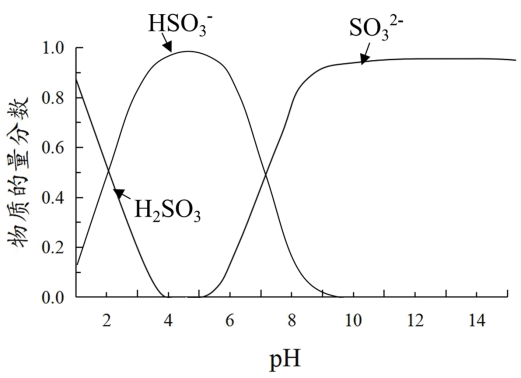
I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
(1)将上述实验补充完整________ 。
(2)配离子的配体为 的实验证据是
的实验证据是_______ 。
II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
(3)探究实验b中溶液褪色更快的原因:
i.甲认为pH降低,有利于Fe3+氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:_______ 。
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对 还原性的影响是
还原性的影响是_______ (填“增强”或“减弱”)。
③通过理论分析,甲认为其猜测_______ (填“成立”或“不成立”),并进一步实验,获得了证据。实验方案为:反应相同时间,分别取实验a和b中的溶液,检测_______ 浓度(填离子符号),比较其大小关系。
ii.乙猜测pH降低,有利于_______氧化 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。
④将乙的假设补充完整_______ (填化学式)。
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是_______ 。
(4)综合上述分析,pH降低,有利于_______ 反应的发生,导致实验b中溶液褪色更快。
已知:溶液中+4价含硫微粒物质的量分数随pH变化的曲线如下图所示。

I.推测Fe3+与溶液中的某种+4价含硫微粒形成了红色的配离子。设计如下实验(均在常温下进行):
| 实验 | 溶液1(1mL) | 溶液2(10mL) | 现象 |
| A | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液 | 溶液1与溶液2混合后,实验A、B、C所得溶液红色依次加深 |
| B | 0.1mol·L-1 FeCl3溶液 | SO2的饱和溶液,用NaOH固体调 pH=5.0 | |
| C | 0.1mol·L-1 FeCl3溶液 | _______ |
(2)配离子的配体为
 的实验证据是
的实验证据是II.探究pH对FeCl3和Na2SO3反应的影响。设计如下实验:
| 序号 | 实验a | 实验b |
| 方案 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,测得pH=1.7 | 5mL酸化的0.1mol·L-1 FeCl3与2mL 0.1mol·L-1 Na2SO3混合得红色溶液,加几滴浓盐酸,调pH=1.3 |
| 现象 | 放置10分钟后,溶液红色均褪去,实验b中溶液褪色更快。经检验,褪色后的溶液中均存在Fe2+。 | |
i.甲认为pH降低,有利于Fe3+氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。①从电极反应的角度,进行理论分析:
还原反应为:Fe3++e-=Fe2+氧化反应为:
②已知上述实验条件下pH对Fe3+的氧化性几乎没有影响。从平衡移动的角度判断pH对
 还原性的影响是
还原性的影响是③通过理论分析,甲认为其猜测
ii.乙猜测pH降低,有利于_______氧化
 ,导致实验b中溶液褪色更快。
,导致实验b中溶液褪色更快。④将乙的假设补充完整
⑤乙设计实验进行验证:
取10mL 0.1mol·L-1 Na2SO3溶液加硫酸调pH=1.7,用KMnO4溶液滴定,消耗体积为V1。另取一份相同的溶液放置10分钟后,再用KMnO4溶液滴定,消耗体积为V2.前后差值(V1-V2)为ΔVa。用同样的方法对10mL 0.1mol·L-1 Na2SO3(含H2SO4)pH=1.3进行滴定,消耗KMnO4溶液前后体积差值为ΔVb。
经对比可知,ΔVa>△Vb,由此得出的实验结论是
(4)综合上述分析,pH降低,有利于
您最近一年使用:0次
2022-04-29更新
|
1806次组卷
|
6卷引用:湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题
湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题北京市丰台区2022届高三二模化学试题(已下线)化学-2022年高考押题预测卷03(北京卷)(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(5月期)北京市顺义区第一中学2022届高三下学期三模化学试题天天练6-10
4 . 完成下列问题
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号) 和
和 从大到小排序:
从大到小排序:_________


_________ _________ _________ _________ _________
(1)下列四个合成反应路线的设计哪些是错误的?(请写出错误路线的编号)
①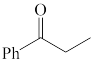

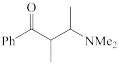
②


③

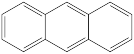
④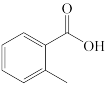


 和
和 从大到小排序:
从大到小排序:



(a)  (b)
(b) 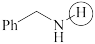 (c)
(c) 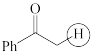 (d)
(d) 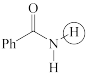 (e)
(e) 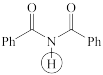
A. B.
B. C.
C.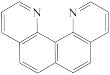 D.
D.
A.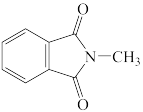 B.
B. C.
C. D.
D.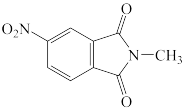
A. 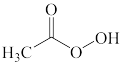 B.
B. 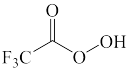 C.
C. 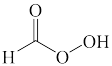 D.
D.  E.
E.  F.
F. 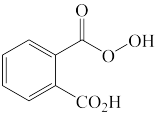
①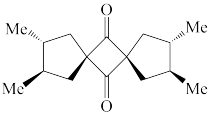 ②
② ③
③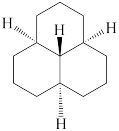 ④
④ ⑤
⑤
⑥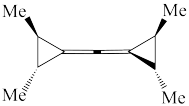 ⑦
⑦ ⑧
⑧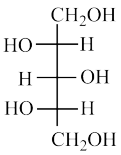 ⑨
⑨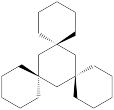 ⑩
⑩
您最近一年使用:0次
解题方法
5 . 化合物A、B、C和D互为同分异构体,分子量为136,分子中只含碳、氢、氧,其中氧的含量为23.5%。实验表明:化合物A、B、C和D均是取代芳香化合物,其中A、C和D的芳环侧链上只含一个官能团。4个化合物在碱性条件下可以进行如下反应:
A
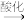 E (C7H6O2) + F
E (C7H6O2) + F
B
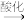 G(C7H8O)+H
G(C7H8O)+H
C
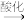 l(芳香化合物)+ J
l(芳香化合物)+ J
D K+H2O
K+H2O
(1)写出A、 B、C和D的分子式分别是___________ 、___________ 、___________ 、___________ 。
(2)画出A、B、C和D的结构简式分别是___________ 、___________ 、___________ 、___________ 。
(3)A和D分别与NaOH溶液发生了哪类反应:A+NaOH___________ ;D+NaOH___________
(4)写出H分子中官能团的名称___________ 。
(5)现有如 下溶液: HCl、 HNO3、 NH3·H2O、NaOH、NaHCO3、饱和Br2 水、FeCl3 和NH4C1。从中选择合适试剂,设计一种实验方案,鉴别E、G和l。___________
A

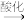 E (C7H6O2) + F
E (C7H6O2) + FB

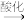 G(C7H8O)+H
G(C7H8O)+HC

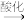 l(芳香化合物)+ J
l(芳香化合物)+ JD
 K+H2O
K+H2O(1)写出A、 B、C和D的分子式分别是
(2)画出A、B、C和D的结构简式分别是
(3)A和D分别与NaOH溶液发生了哪类反应:A+NaOH
(4)写出H分子中官能团的名称
(5)现有如 下溶液: HCl、 HNO3、 NH3·H2O、NaOH、NaHCO3、饱和Br2 水、FeCl3 和NH4C1。从中选择合适试剂,设计一种实验方案,鉴别E、G和l。
您最近一年使用:0次
名校
6 . 由于6s2惰性电子对效应,金Au、汞Hg、铊Tl、铅Pb、铋Bi的最稳定氧化态分别为-1,0, +1, +2, +3,下列说法错误的是
| A.根据这个规律,人们制出负一价的金的化合物CsAu |
| B.与汞同族锌镉为较活泼金属而汞为不活泼金属,且对于+1 氧化态,Hg倾向于形成Hg2+ |
| C.二氧化铅氧化性很强,可和浓盐酸反应制取氯气PbO2 + 4HCl(浓) = PbCl2+ Cl2↑+2H2O |
D.铋酸钠与酸性硫酸锰的离子方程式: 5BiO + 2Mn2++14H+= 5Bi3++ 2MnO + 2Mn2++14H+= 5Bi3++ 2MnO + 7H2O + 7H2O |
您最近一年使用:0次
2023-05-25更新
|
191次组卷
|
2卷引用:2023年广西高中学生竞赛(高一、高二同卷)化学试题
解题方法
7 . 某研究小组用工业钛白副产品为原料制备纳米级电池材料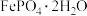 ,按如下流程开展实验。
,按如下流程开展实验。 ,含少量的
,含少量的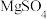 、
、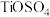 、
、 等杂质。
等杂质。
②已知 和
和 的氧化性随酸性的增强而增强。
的氧化性随酸性的增强而增强。
请回答:
(1)常温下步骤Ⅰ所得料液其pH___________ 7(填“>”、“<”)。
(2)下列说法不正确 的是___________。
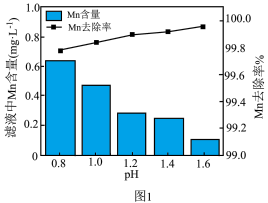
(3)步骤Ⅴ中Mn元素的去除率及滤液中Mn元素含量随着溶液pH值的关系如图1所示,___________ 。
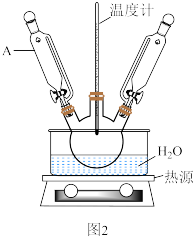
(4)步骤Ⅵ操作之一采用如图2所示装置进行(忽略夹持装置),仪器A的名称是___________ ;该操作不宜用酒精灯直接加热的原因是___________ 。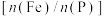 是衡量磷酸铁品质最关键的指标。
是衡量磷酸铁品质最关键的指标。
Fe元素的定量测定:①配制一系列pH=3~5, 浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺(
浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺( )溶液,调pH=3~5,加入邻菲罗啉。③进行比色
)溶液,调pH=3~5,加入邻菲罗啉。③进行比色
①通过比色能获得Fe元素浓度的原理是___________ 。
②测得产品中铁磷比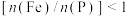 ,可能原因是
,可能原因是___________ 。
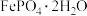 ,按如下流程开展实验。
,按如下流程开展实验。
 ,含少量的
,含少量的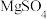 、
、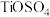 、
、 等杂质。
等杂质。②已知
 和
和 的氧化性随酸性的增强而增强。
的氧化性随酸性的增强而增强。请回答:
(1)常温下步骤Ⅰ所得料液其pH
(2)下列说法
| A.步骤Ⅱ,加入Fe粉的目的是调节溶液pH值,以便Ti元素水解沉淀 |
B.步骤Ⅲ,加入 的目的是除去Mg元素 的目的是除去Mg元素 |
| C.为了提高实验效率,可以将Ⅱ、Ⅲ、Ⅴ的过滤操作合并 |
D.步骤Ⅳ中过量的 可在步骤Ⅴ中被氧化去除 可在步骤Ⅴ中被氧化去除 |
(3)步骤Ⅴ中Mn元素的去除率及滤液中Mn元素含量随着溶液pH值的关系如图1所示,
(4)步骤Ⅵ操作之一采用如图2所示装置进行(忽略夹持装置),仪器A的名称是
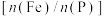 是衡量磷酸铁品质最关键的指标。
是衡量磷酸铁品质最关键的指标。Fe元素的定量测定:①配制一系列pH=3~5,
 浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺(
浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺( )溶液,调pH=3~5,加入邻菲罗啉。③进行比色
)溶液,调pH=3~5,加入邻菲罗啉。③进行比色①通过比色能获得Fe元素浓度的原理是
②测得产品中铁磷比
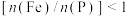 ,可能原因是
,可能原因是
您最近一年使用:0次
解题方法
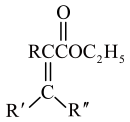
8 . 化合物Ⅰ具有良好的降血压、减肥以及治疗心脏疾病等功效,其合成路线如下(部分反应条件省略)
(1)化合物A的非全碳 官能团名称是___________ 。
(2)下列说法不正确 的是___________。
(3)化合物E的结构简式是___________ 。
(4)写出G→H的化学方程式___________ 。
(5)写出同时符合下列条件的化合物C的一种同分异构体的结构简式___________ 。
①分子中含有苯环且与 溶液发生显色反应
溶液发生显色反应
②核磁共振氢谱和红外光谱检测表明:分子中共有4种不同化学环境的氢原子,不含 键
键
(6)写出以 、
、 以及乙醇为原料制备化合物A的合成路线图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
以及乙醇为原料制备化合物A的合成路线图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。___________
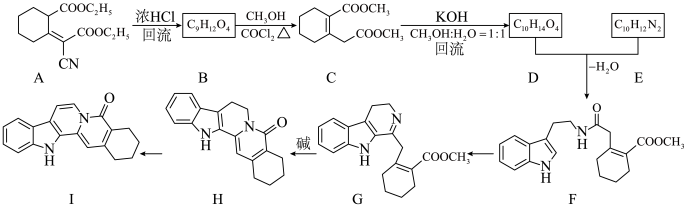
已知:①
②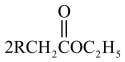
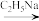
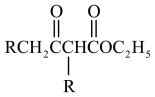
③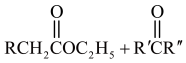

(1)化合物A的
(2)下列说法
| A.A→B的转变只是官能团种类和数量的变化 |
B.在B→C的反应中, 作催化剂 作催化剂 |
C.化合物G的分子式为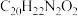 |
| D.化合物I可在酸性或碱性条件下发生水解反应 |
(3)化合物E的结构简式是
(4)写出G→H的化学方程式
(5)写出同时符合下列条件的化合物C的一种同分异构体的结构简式
①分子中含有苯环且与
 溶液发生显色反应
溶液发生显色反应②核磁共振氢谱和红外光谱检测表明:分子中共有4种不同化学环境的氢原子,不含
 键
键(6)写出以
 、
、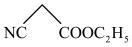 以及乙醇为原料制备化合物A的合成路线图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
以及乙醇为原料制备化合物A的合成路线图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
您最近一年使用:0次
2022高二上·安徽阜阳·竞赛
9 . 你知道什么是酸碱吗?
中学我们认识知道,酸是在水溶液中电离出的阳离子全部为氢离子的物质,碱是在水溶液中电离出的阴离子全部为氢氧根离子的物质。而事实上,酸碱的定义随着历史发展也在不断革新,历代化学家发表了不同的酸碱理论,目前较为广泛接受的有离子论,溶剂论,质子论,电子论和软硬酸碱理论,在此处针对溶剂论和质子论做简单介绍。
溶剂论是1905年富兰克林提出的一种按照纯溶剂是否能够自耦电离(例如水的自耦电离:2H2O H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4
H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4 NO++NO
NO++NO ,此时NO+即为该溶液的酸,NO
,此时NO+即为该溶液的酸,NO 即为该溶液的碱。
即为该溶液的碱。
据此回答第( 1 )题。
(1)①已知液氨会自耦电离,请类比水的自耦电离写出其自耦电离方程式:_______ ,其中,_______ 为液氨溶液的酸,_______ 为液氨溶液的碱。此时的酸碱中和反应可以写成(写出方程式):_______ 。
②写出氯气在液氨溶液中反应的离子方程式:_______ 。
质子论是1923年由布朗斯特和劳里提出的,其定义酸为可以给出质子的物种,碱定义为可以接受质子的物种,因此存在关系: ,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
(2)①下列说法正确的是_______ 。
A.因为在水溶液中有 H2SO4 2H++SO
2H++SO ,因此 H2SO4 与 SO
,因此 H2SO4 与 SO 互为共轭酸碱对
互为共轭酸碱对
B.由于水可以发生自耦电离,则按照该理论,水既属于酸又属于碱
C.可以根据HNO3的性质推断NO 的酸性较弱
的酸性较弱
D.液氨对碳酸和盐酸是区分溶剂,可以便于区分酸性的强弱
②对于反应NH3+HCl=NH4Cl而言,_______ 是酸_______ 是碱。
③在溶液中,酸的强度是依靠其电离平衡常数 来判断的。
来判断的。  越大则证明电离程度越大,故酸性越强。
越大则证明电离程度越大,故酸性越强。
对于一种酸HA,其电离平衡常数为:HA H++A-,其中
H++A-,其中 ,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
实验证明,盐酸,硝酸,硫酸,高氯酸的酸性是有差异的,可是在水溶液中无法区分酸性差异,其原因在于水溶液本身具有碱性,其溶剂化作用(质子在溶液中不是单独存在,而是结合溶剂分子生成溶剂合质子,这称为溶剂化作用)导致这四种酸在水溶液中的电离平衡趋势相同,从而无法断定酸性强弱,这类溶剂称为拉平溶剂。反之,若将这四种酸分别放入冰醋酸中,测得的平衡常数是不同的,即电离平衡趋势不同,这类溶剂称之为区分溶剂。据此回答问题:区分溶剂之所以能够区分不同强酸的酸碱性,原因在于其溶剂化作用_______ (填“较强”或“较弱”)。
中学我们认识知道,酸是在水溶液中电离出的阳离子全部为氢离子的物质,碱是在水溶液中电离出的阴离子全部为氢氧根离子的物质。而事实上,酸碱的定义随着历史发展也在不断革新,历代化学家发表了不同的酸碱理论,目前较为广泛接受的有离子论,溶剂论,质子论,电子论和软硬酸碱理论,在此处针对溶剂论和质子论做简单介绍。
溶剂论是1905年富兰克林提出的一种按照纯溶剂是否能够自耦电离(例如水的自耦电离:2H2O
 H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4
H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4 NO++NO
NO++NO ,此时NO+即为该溶液的酸,NO
,此时NO+即为该溶液的酸,NO 即为该溶液的碱。
即为该溶液的碱。据此回答第( 1 )题。
(1)①已知液氨会自耦电离,请类比水的自耦电离写出其自耦电离方程式:
②写出氯气在液氨溶液中反应的离子方程式:
质子论是1923年由布朗斯特和劳里提出的,其定义酸为可以给出质子的物种,碱定义为可以接受质子的物种,因此存在关系:
 ,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。(2)①下列说法正确的是
A.因为在水溶液中有 H2SO4
 2H++SO
2H++SO ,因此 H2SO4 与 SO
,因此 H2SO4 与 SO 互为共轭酸碱对
互为共轭酸碱对B.由于水可以发生自耦电离,则按照该理论,水既属于酸又属于碱
C.可以根据HNO3的性质推断NO
 的酸性较弱
的酸性较弱D.液氨对碳酸和盐酸是区分溶剂,可以便于区分酸性的强弱
②对于反应NH3+HCl=NH4Cl而言,
③在溶液中,酸的强度是依靠其电离平衡常数
 来判断的。
来判断的。  越大则证明电离程度越大,故酸性越强。
越大则证明电离程度越大,故酸性越强。对于一种酸HA,其电离平衡常数为:HA
 H++A-,其中
H++A-,其中 ,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。实验证明,盐酸,硝酸,硫酸,高氯酸的酸性是有差异的,可是在水溶液中无法区分酸性差异,其原因在于水溶液本身具有碱性,其溶剂化作用(质子在溶液中不是单独存在,而是结合溶剂分子生成溶剂合质子,这称为溶剂化作用)导致这四种酸在水溶液中的电离平衡趋势相同,从而无法断定酸性强弱,这类溶剂称为拉平溶剂。反之,若将这四种酸分别放入冰醋酸中,测得的平衡常数是不同的,即电离平衡趋势不同,这类溶剂称之为区分溶剂。据此回答问题:区分溶剂之所以能够区分不同强酸的酸碱性,原因在于其溶剂化作用
您最近一年使用:0次
10 . 已知铁元素的电势图为:FeO
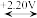 Fe3+
Fe3+ Fe2+
Fe2+ Fe,φ0(Cl2/Cl-)=+1.36V。下列有关说法正确的是
Fe,φ0(Cl2/Cl-)=+1.36V。下列有关说法正确的是

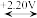 Fe3+
Fe3+ Fe2+
Fe2+ Fe,φ0(Cl2/Cl-)=+1.36V。下列有关说法正确的是
Fe,φ0(Cl2/Cl-)=+1.36V。下列有关说法正确的是| A.Fe2+在水溶液中可发生歧化反应 |
| B.无论在酸性或碱性条件下,Fe均可还原水 |
C.FeO 在水溶液中可稳定存在 在水溶液中可稳定存在 |
D.Cl2无论在何条件下均不能氧化Fe3+生成FeO |
您最近一年使用:0次



