1 . 以锗石矿A(化学式为 )为原料,可以实现如下转化。
)为原料,可以实现如下转化。
请回答:
(1)D的化学式为___________ ,液体E的沸点___________  (填“高于”或“低于”)。
(填“高于”或“低于”)。
(2)下列说法不正确 的是___________。
(3)已知液体E以物质的量之比1∶1与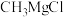 反应,该反应可用来构建
反应,该反应可用来构建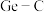 键,写出步骤Ⅲ的化学方程式
键,写出步骤Ⅲ的化学方程式___________ 。
(4)写出溶液G中所有的阴离子___________ ,设计实验证明溶液G中含有Cu元素___________ 。
 )为原料,可以实现如下转化。
)为原料,可以实现如下转化。
请回答:
(1)D的化学式为
 (填“高于”或“低于”)。
(填“高于”或“低于”)。(2)下列说法
| A.气体B是形成酸雨的成分之一 | B.固体C中可能含有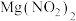 |
C. 也能与浓盐酸反应 也能与浓盐酸反应 | D.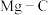 键强于 键强于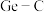 键 键 |
(3)已知液体E以物质的量之比1∶1与
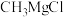 反应,该反应可用来构建
反应,该反应可用来构建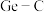 键,写出步骤Ⅲ的化学方程式
键,写出步骤Ⅲ的化学方程式(4)写出溶液G中所有的阴离子
您最近一年使用:0次
2 . 金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石( )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。
直接氯化:
反应Ⅰ:
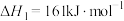
碳氯化:
反应Ⅱ: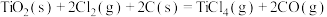
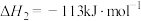
反应Ⅲ:

(1)直接氯化可以在___________ 下自发进行。
(2)反应Ⅳ 的
的 为
为___________ 
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
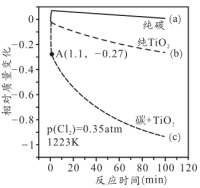
①用纯碳实验时,质量稍微有所增长,生成了含___________ 键的物质。
②用纯 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为___________ ;该反应的活化能___________ (填“高”或“低”)。
③按照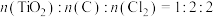 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=___________ 。
④1.1min之后,光气( )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:

决速步骤的反应方程式为___________ ,1.1min之后发生的总反应方程式为___________ 。
(4)按照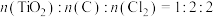 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
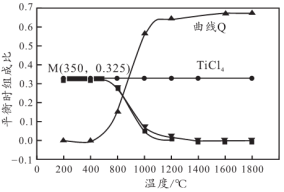
①曲线Q是___________ (填化学式)的变化图像。
②M点所发生的化学方程式是___________ 。
 )转化为
)转化为 ,再进一步还原得到钛。
,再进一步还原得到钛。直接氯化:
反应Ⅰ:

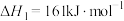
碳氯化:
反应Ⅱ:
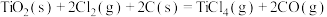
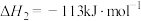
反应Ⅲ:


(1)直接氯化可以在
(2)反应Ⅳ
 的
的 为
为
(3)科学家对以上反应做过热重分析,温度为1223K、氯气分压
 的条件下,得到固体相对质量变化与时间的关系如下图所示:
的条件下,得到固体相对质量变化与时间的关系如下图所示:
①用纯碳实验时,质量稍微有所增长,生成了含
②用纯
 实验时,所发生的化学方程式为
实验时,所发生的化学方程式为③按照
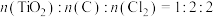 混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气(
混合,实验发现1.1min内质量迅速减少,经光谱分析证明有光气( )生成,固体中含有C和
)生成,固体中含有C和 ,则x=
,则x=④1.1min之后,光气(
 )继续反应,有理论认为机理如下:
)继续反应,有理论认为机理如下:
决速步骤的反应方程式为
(4)按照
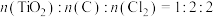 混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
混合,平衡状态下不同物质的组成比与温度的关系如下图所示:
①曲线Q是
②M点所发生的化学方程式是
您最近一年使用:0次
名校
解题方法
3 . “84消毒液”广泛应用于杀菌消毒,其有效成分是 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
资料:i. 的电离常数为
的电离常数为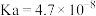 ;
; 的电离常数为
的电离常数为 、
、
ii.碘的化合物主要以 和
和 的形式存在,
的形式存在, 。
。
iii.碘单质能与 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。
I.制备消毒液(夹持装置略)

(1)制备 的离子反应方程式
的离子反应方程式_______ 。
(2)结合资料i,写出D中反应的化学方程式_______ 。
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
(3)针对烧杯3“滴加淀粉溶液不变蓝”的原因,提出两种假设:
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是_______ 。
假设2:过量的 将反应生成的
将反应生成的 氧化为
氧化为 。
。
设计实验b证实了假设2成立。 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是_______ 。
(4)某小组检验烧杯3所得溶液中含 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由_______ 。
(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据_______ 。
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是_______ 。
 。实验小组制备消毒液,并利用其性质探究制备碘水的方法。
。实验小组制备消毒液,并利用其性质探究制备碘水的方法。资料:i.
 的电离常数为
的电离常数为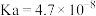 ;
; 的电离常数为
的电离常数为 、
、
ii.碘的化合物主要以
 和
和 的形式存在,
的形式存在, 。
。iii.碘单质能与
 反应:
反应: (
( 低浓度时显黄色,高浓度时为棕色)。
低浓度时显黄色,高浓度时为棕色)。I.制备消毒液(夹持装置略)

(1)制备
 的离子反应方程式
的离子反应方程式(2)结合资料i,写出D中反应的化学方程式
II.利用消毒液的性质探究碘水的制备方法
将某品牌“84消毒液”稀释10倍,各取100mL于三个烧杯中,设计如下实验方案制备碘水:
| 方案 | 操作 | 现象 | 反应后加淀粉溶液 |
| 1 | 烧杯1溶液中加入9g 固体 固体 | 溶液为橙黄色 | …… |
| 2 | 烧杯2溶液中加入9g 固体,再加入1 固体,再加入1 盐酸10mL 盐酸10mL | 溶液颜色快速加深,呈紫红色 | 变蓝 |
| 3 | 烧杯3溶液中加入少量 固体(小于0.5g) 固体(小于0.5g) | 振荡后溶液保持无色 | 不变蓝 |
假设1:生成的I2在碱性溶液中不能存在。
设计实验a证实了假设1成立,实验a的操作及现象是
假设2:过量的
 将反应生成的
将反应生成的 氧化为
氧化为 。
。设计实验b证实了假设2成立。
 氧化
氧化 生成
生成 的离子方程式是
的离子方程式是(4)某小组检验烧杯3所得溶液中含
 :取烧杯3所得无色溶液少许,加入稀硫酸酸化的
:取烧杯3所得无色溶液少许,加入稀硫酸酸化的 溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在
溶液,反应后再滴加淀粉溶液,发现溶液变蓝。该实验方案能否证明烧杯3所得溶液中存在 ,说明理由
,说明理由(5)预测烧杯1反应后加淀粉溶液的实验现象,结合方程式说明预测依据
(6)对比不同方案的实验现象,得出制取碘水的最佳方法要关注的因素是
您最近一年使用:0次
2022-12-30更新
|
1184次组卷
|
4卷引用:河南省鹤壁市高中2022-2023学年高二下学期精英对抗赛化学试题
2022高二上·安徽阜阳·竞赛
4 . 你知道什么是酸碱吗?
中学我们认识知道,酸是在水溶液中电离出的阳离子全部为氢离子的物质,碱是在水溶液中电离出的阴离子全部为氢氧根离子的物质。而事实上,酸碱的定义随着历史发展也在不断革新,历代化学家发表了不同的酸碱理论,目前较为广泛接受的有离子论,溶剂论,质子论,电子论和软硬酸碱理论,在此处针对溶剂论和质子论做简单介绍。
溶剂论是1905年富兰克林提出的一种按照纯溶剂是否能够自耦电离(例如水的自耦电离:2H2O H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4
H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4 NO++NO
NO++NO ,此时NO+即为该溶液的酸,NO
,此时NO+即为该溶液的酸,NO 即为该溶液的碱。
即为该溶液的碱。
据此回答第( 1 )题。
(1)①已知液氨会自耦电离,请类比水的自耦电离写出其自耦电离方程式:_______ ,其中,_______ 为液氨溶液的酸,_______ 为液氨溶液的碱。此时的酸碱中和反应可以写成(写出方程式):_______ 。
②写出氯气在液氨溶液中反应的离子方程式:_______ 。
质子论是1923年由布朗斯特和劳里提出的,其定义酸为可以给出质子的物种,碱定义为可以接受质子的物种,因此存在关系: ,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
(2)①下列说法正确的是_______ 。
A.因为在水溶液中有 H2SO4 2H++SO
2H++SO ,因此 H2SO4 与 SO
,因此 H2SO4 与 SO 互为共轭酸碱对
互为共轭酸碱对
B.由于水可以发生自耦电离,则按照该理论,水既属于酸又属于碱
C.可以根据HNO3的性质推断NO 的酸性较弱
的酸性较弱
D.液氨对碳酸和盐酸是区分溶剂,可以便于区分酸性的强弱
②对于反应NH3+HCl=NH4Cl而言,_______ 是酸_______ 是碱。
③在溶液中,酸的强度是依靠其电离平衡常数 来判断的。
来判断的。  越大则证明电离程度越大,故酸性越强。
越大则证明电离程度越大,故酸性越强。
对于一种酸HA,其电离平衡常数为:HA H++A-,其中
H++A-,其中 ,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
实验证明,盐酸,硝酸,硫酸,高氯酸的酸性是有差异的,可是在水溶液中无法区分酸性差异,其原因在于水溶液本身具有碱性,其溶剂化作用(质子在溶液中不是单独存在,而是结合溶剂分子生成溶剂合质子,这称为溶剂化作用)导致这四种酸在水溶液中的电离平衡趋势相同,从而无法断定酸性强弱,这类溶剂称为拉平溶剂。反之,若将这四种酸分别放入冰醋酸中,测得的平衡常数是不同的,即电离平衡趋势不同,这类溶剂称之为区分溶剂。据此回答问题:区分溶剂之所以能够区分不同强酸的酸碱性,原因在于其溶剂化作用_______ (填“较强”或“较弱”)。
中学我们认识知道,酸是在水溶液中电离出的阳离子全部为氢离子的物质,碱是在水溶液中电离出的阴离子全部为氢氧根离子的物质。而事实上,酸碱的定义随着历史发展也在不断革新,历代化学家发表了不同的酸碱理论,目前较为广泛接受的有离子论,溶剂论,质子论,电子论和软硬酸碱理论,在此处针对溶剂论和质子论做简单介绍。
溶剂论是1905年富兰克林提出的一种按照纯溶剂是否能够自耦电离(例如水的自耦电离:2H2O
 H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4
H3O++OH-)出溶剂合质子来区分酸碱的一种理论,这个理论将溶液自耦电离出的具有溶液特征的阳离子称为酸,具有溶液特征的阴离子称为碱。例如:液态N2O4中发生自耦电离N2O4 NO++NO
NO++NO ,此时NO+即为该溶液的酸,NO
,此时NO+即为该溶液的酸,NO 即为该溶液的碱。
即为该溶液的碱。据此回答第( 1 )题。
(1)①已知液氨会自耦电离,请类比水的自耦电离写出其自耦电离方程式:
②写出氯气在液氨溶液中反应的离子方程式:
质子论是1923年由布朗斯特和劳里提出的,其定义酸为可以给出质子的物种,碱定义为可以接受质子的物种,因此存在关系:
 ,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。
,如图的关系也称为“共轭酸碱对”,因此该理论又称为“共轭酸碱理论”。该理论下所有酸碱都是共轭的,满足弱酸共轭强碱,弱碱共轭强酸。其中的酸,碱可以是分子,也可以是阴离子,阳离子。同时,“盐”的定义被去除,因为组成盐的离子本身就可以分别看作酸和碱。(2)①下列说法正确的是
A.因为在水溶液中有 H2SO4
 2H++SO
2H++SO ,因此 H2SO4 与 SO
,因此 H2SO4 与 SO 互为共轭酸碱对
互为共轭酸碱对B.由于水可以发生自耦电离,则按照该理论,水既属于酸又属于碱
C.可以根据HNO3的性质推断NO
 的酸性较弱
的酸性较弱D.液氨对碳酸和盐酸是区分溶剂,可以便于区分酸性的强弱
②对于反应NH3+HCl=NH4Cl而言,
③在溶液中,酸的强度是依靠其电离平衡常数
 来判断的。
来判断的。  越大则证明电离程度越大,故酸性越强。
越大则证明电离程度越大,故酸性越强。对于一种酸HA,其电离平衡常数为:HA
 H++A-,其中
H++A-,其中 ,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。
,与化学平衡常数类似,为离子浓度的化学计量数次幂的乘积比电解质的化学计量数次幂的乘积。实验证明,盐酸,硝酸,硫酸,高氯酸的酸性是有差异的,可是在水溶液中无法区分酸性差异,其原因在于水溶液本身具有碱性,其溶剂化作用(质子在溶液中不是单独存在,而是结合溶剂分子生成溶剂合质子,这称为溶剂化作用)导致这四种酸在水溶液中的电离平衡趋势相同,从而无法断定酸性强弱,这类溶剂称为拉平溶剂。反之,若将这四种酸分别放入冰醋酸中,测得的平衡常数是不同的,即电离平衡趋势不同,这类溶剂称之为区分溶剂。据此回答问题:区分溶剂之所以能够区分不同强酸的酸碱性,原因在于其溶剂化作用
您最近一年使用:0次
5 . MAX(M代表过渡金属元素,A代表主族元素,X代表碳或氮)相是一类备受关注的新型陶瓷材料。由于独特的层状晶体结构,其具有自润滑、高韧性、可导电等性能,可作为高温结构材料、电极材料和化学防腐材料。某MAX相材料含有Ti、Al、N 3种原子,属六方晶系,Ti原子的堆积方式为 …BACBBCABBACBBCAB…,其中A、B、C都是密置单层。N原子占据所有的正八面体空隙,而Al原子占据一半的三棱柱空隙。如果Ti原子层上下同时接触N和Al原子,则沿着晶胞c轴方向,Al和N原子的投影重合。。
(1)写出该化合物的化学式________ ,及每个正当晶胞中的原子种类和个数________ 。
(2)沿着晶胞c轴方向,画一条同时含有Al和N原子的直线,标出直线上的原子排列________ (无需考虑原子间距离,直线上总原子数不少于10个。Al、Ti、N分别用о, Δ,口表示)。
(3)已知Ti、N原子之间的平均键长为210.0 pm, Ti、Al原子之间的平均键长为281.8 pm,估算晶体的理论密度________ (原子量: Ti:47.87, Al:26.98, N: 14.01, NA=6.02 × 1023 mo-1)。
(4)晶粒尺寸会影响上述材料的性质,所以高温制备时一般通过延长保温时间来增加晶粒尺寸。 判断常温下晶粒生长过程的熵变、焓变和自由能变化的正负________ ,并从化学热力学角度判断常温下该晶粒生长过程是否自发________ 。
(5)以上描述均针对完美晶体。一般情况下,晶粒中会出现缺陷。从热力学角度证明:对于足够大的晶体,出现缺陷是自发的________ 。
(1)写出该化合物的化学式
(2)沿着晶胞c轴方向,画一条同时含有Al和N原子的直线,标出直线上的原子排列
(3)已知Ti、N原子之间的平均键长为210.0 pm, Ti、Al原子之间的平均键长为281.8 pm,估算晶体的理论密度
(4)晶粒尺寸会影响上述材料的性质,所以高温制备时一般通过延长保温时间来增加晶粒尺寸。 判断常温下晶粒生长过程的熵变、焓变和自由能变化的正负
(5)以上描述均针对完美晶体。一般情况下,晶粒中会出现缺陷。从热力学角度证明:对于足够大的晶体,出现缺陷是自发的
您最近一年使用:0次
6 . 高温超导材料的研究是21世纪材料领域的热点问题,YBaCuO体系一直是此领域的研究重点之一。将钇(Y)、钡、铜的氧化物按一定的物质的量之比混合(Y为ⅢB族元素),再经高温煅烧可得到复合氧化物YBa2Cu3O6.5+δ,实验证明:该物质具有超导性能,其零电阻温度可达90K,化学式中的δ大小与超导性能密切相关。有一种观点认为δ的产生源于体系中产生了Cu3+。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为_______ 。
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为_______ ,m值为_______ 。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O
 +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
您最近一年使用:0次
7 . LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。Li+、K+和Cl-的半径分别为76pm、113pm和181pm。在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。
(1)简要说明加入熔点高的KCl反而使电解温度大大下降的原因:_______ 。
(2)有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)请解释在固相中完全不混溶的主要原因_______ 。
(3)写出计处LiCl和KCl两种晶体密度之比的表达式_______ (须包含离子半径的符号);
(4)在KCl晶体中,K+离子占据由Cl-离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离_______ 。
(5)实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明_______ 。
(1)简要说明加入熔点高的KCl反而使电解温度大大下降的原因:
(2)有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)请解释在固相中完全不混溶的主要原因
(3)写出计处LiCl和KCl两种晶体密度之比的表达式
(4)在KCl晶体中,K+离子占据由Cl-离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离
(5)实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明
您最近一年使用:0次
8 . N2O4和NO2的相互转化N2O4(g)⇌2NO(g)是讨 论化学平衡问题的常用体系。已知该反应在295K和315K温度下平衡常数Kp分别为0.100和0.400。将一定量的气体充入一个带活塞的特制容器,通过活塞移动使体系总压恒为lbar(lbar=100kPa)。
(1)计算295K下体系达平衡时N2O4和NO2的分压____ 。
(2)将上述体系温度升至315K,计算达平衡时N2O4和NO2的分压____ 。
(3)计算恒压下体系分别在315K和295K达平衡时的体积比及物质的量之比____ 。
(4)保持恒压条件下,不断升高温度,体系中NO2分压最大值的理论趋近值是____ (不考虑其他反应)?根据平衡关系式给出证明____ 。
(5)上述体系在保持恒外压的条件下,温度从295K升至315K,下列说法正确的是____ 。
a.平衡向左移动 b.平衡不移动 c.平衡向右移动 d.三者均有可能
(6)与体系在恒容条件下温度从295K升至315K的变化相比,恒压下体系温度升高,下列说法正确的是____ (简述理由,不要求计算)。
a.平衡移动程度更大 b.平衡移动程度更小 c.平衡移动程度不变 d.三者均有可能
(1)计算295K下体系达平衡时N2O4和NO2的分压
(2)将上述体系温度升至315K,计算达平衡时N2O4和NO2的分压
(3)计算恒压下体系分别在315K和295K达平衡时的体积比及物质的量之比
(4)保持恒压条件下,不断升高温度,体系中NO2分压最大值的理论趋近值是
(5)上述体系在保持恒外压的条件下,温度从295K升至315K,下列说法正确的是
a.平衡向左移动 b.平衡不移动 c.平衡向右移动 d.三者均有可能
(6)与体系在恒容条件下温度从295K升至315K的变化相比,恒压下体系温度升高,下列说法正确的是
a.平衡移动程度更大 b.平衡移动程度更小 c.平衡移动程度不变 d.三者均有可能
您最近一年使用:0次
解题方法
9 . 下列实验事实不能证明苯分子中不存在独立的碳碳双键的是


| A.用扫描隧道显微镜获得的苯分子图像(如图) |
| B.苯可与氢气在一定条件下发生加成反应 |
| C.苯不能使酸性高锰酸钾溶液褪色 |
| D.环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ·mol-1、-3747 kJ·mol-1和-3265 kJ·mol-1 |
您最近一年使用:0次
10 . 实验室里用下图所示仪器和药品制取纯净的无水氯化铁。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出,其中⑤、⑥所用为双孔塞,


根据要求回答下列问题:
(1)如果规定气体从左向右流动,上述各仪器装置的正确连接顺序是(填装置的序号):
③→______ →______ →_______ →_______ →_______ 。
(2)装置④的作用是_______________ 。
(3)实验开始时,应首先______________ ;实验结束时,应先熄灭装置__________ 处的酒精灯。该实验条件下生成的氯化铁呈烟状,且易水解,为便于收集,需要在__________ 和__________ (填装置序号)之间增加装置⑦,该装置中烧杯里的液体可以是___________ 。
(4)在装置⑤的烧瓶中,发生反应的化学方程式为__________________ 。
(5)可用离子交换和滴定的方法测定FeCl3的纯度:称取0.68g的FeCl3样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH―的阴离子交换柱,使Cl―和OH―发生交换。交换完成后,流出溶液中的OH―用0.4000 mol/L的盐酸滴定,滴至终点时消耗盐酸30.00 mL。则该样品中FeCl3的质量分数为___________ %。
(6)设计一个简单实验,证明装置①的硬质玻璃管中有少量的铁未能与Cl2发生反应(写出实验操作及相关实验现象)_________________ 。


根据要求回答下列问题:
(1)如果规定气体从左向右流动,上述各仪器装置的正确连接顺序是(填装置的序号):
③→
(2)装置④的作用是
(3)实验开始时,应首先
(4)在装置⑤的烧瓶中,发生反应的化学方程式为
(5)可用离子交换和滴定的方法测定FeCl3的纯度:称取0.68g的FeCl3样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH―的阴离子交换柱,使Cl―和OH―发生交换。交换完成后,流出溶液中的OH―用0.4000 mol/L的盐酸滴定,滴至终点时消耗盐酸30.00 mL。则该样品中FeCl3的质量分数为
(6)设计一个简单实验,证明装置①的硬质玻璃管中有少量的铁未能与Cl2发生反应(写出实验操作及相关实验现象)
您最近一年使用:0次



