1 . S8与NH3在无水条件下反应,得到一种二元化合物A,元素分析可知,A中含S元素69.60%。A进行如下反应:
(1)A、B、C、D的化学式分别为___________ 、___________ 、___________ 、___________ 。
(2)A与SnCl2的乙醇溶液反应除生成B外,还生成一种含Sn(IV)化合物,试写出A→B的化学方程式___________ 。
(3)D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)互为等电子体,但D与无色液体的几何构型完全不同,为环状结构,试画出D的最稳定的Lewis结构式___________ ,理由是___________ ,该Lewis结构式中,S原子的电子构型是___________ 。

(1)A、B、C、D的化学式分别为
(2)A与SnCl2的乙醇溶液反应除生成B外,还生成一种含Sn(IV)化合物,试写出A→B的化学方程式
(3)D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)互为等电子体,但D与无色液体的几何构型完全不同,为环状结构,试画出D的最稳定的Lewis结构式
您最近一年使用:0次
2 . 镍是钢中的重要元素之一,镍的加入可以增加钢的硬度、弹性、延展性和抗腐蚀性。某实验室有两份含Ni钢样,1号钢样中Ni的质量分数为0.362%,2号钢样Ni含量未知。实验人员用过二硫酸铵-丁二酮肟吸光光度法对钢样中Ni含量进行测定:取一定质量的钢样在通风柜中加入适量硝酸,加热溶解,转移至100 mL容量瓶,定容摇匀。移取10.00 mL试样溶液于50 mL容量瓶中,依次加入酒石酸钠、NaOH、丁二酮肟和过二硫酸铵。丁酮肟加入后有浑浊现象,加入过二硫酸铵后溶解成酒红色溶液,再加水定容。
(1)请写出镍溶解及氧化过程中的离子方程式_________ ,并说明酒石酸钠和NaOH的作用_________ 。
(2) 1号钢样经上述分解步骤和显色反应后制备的溶液,利用普通吸光光度法进行检测。使用2 cm吸收池于530 nm处(ε = 6.60 × 103 L·mol-1·cm-1 )测量,欲使测量的相对误差最小,称取1号钢样的质量应为多少_________ ?
(3)请指出(2)中普通吸光光度法使用的参比溶液的组成_________ ,为何使用该溶液作为参比溶液_________ ?
(4)以示差吸光光度法测定2号钢样中Ni含量,称取0.382 g2号钢样,经与测定1号钢样同样步骤配制的溶液,使用2 cm吸收池,波长选择530 nm,以4-2中配制的1号钢样显色反应后的溶液作参比液,并以此调节透射比为100%,此时测得2号钢样显色后溶液的透射比为T= 31.4%,计算2号钢样中Ni的质量分数_________ 。
(1)请写出镍溶解及氧化过程中的离子方程式
(2) 1号钢样经上述分解步骤和显色反应后制备的溶液,利用普通吸光光度法进行检测。使用2 cm吸收池于530 nm处(ε = 6.60 × 103 L·mol-1·cm-1 )测量,欲使测量的相对误差最小,称取1号钢样的质量应为多少
(3)请指出(2)中普通吸光光度法使用的参比溶液的组成
(4)以示差吸光光度法测定2号钢样中Ni含量,称取0.382 g2号钢样,经与测定1号钢样同样步骤配制的溶液,使用2 cm吸收池,波长选择530 nm,以4-2中配制的1号钢样显色反应后的溶液作参比液,并以此调节透射比为100%,此时测得2号钢样显色后溶液的透射比为T= 31.4%,计算2号钢样中Ni的质量分数
您最近一年使用:0次
3 . 25℃,银离子在溶液中与与间苯二胺和对苯二胺定量发生如下反应:

氧化得到的偶联产物在550nm波长处的摩尔消光系数为1.8×104Lmol-1cm-1。利用这一反应,通过分光光度法可测定起始溶液中的银离子浓度。
(1)25℃,在纯水中配得乙酸银的饱和水溶液。取1.00mL溶液,按计量加入两种苯二胺,至显色稳定后,稀释定容至1L。用1cm的比色皿,测得溶液在550nm处的吸光度为0.225。计算乙酸银的溶度积Ksp______ 。(提示:可合理忽略副反应。)朗伯-比尔方程A=εlc,A吸光度;ε摩尔消光系数;l光通过溶液的路径长;c溶液浓度。
(2)室温下将乙酸银与4-三甲铵基苯硫醇的六氟磷酸盐(HL+)( ){HL+=[HSC6H4N(CH3)3]+}混合研磨,两种固体发生反应,得到一种淡黄色粉末。粉末用乙腈处理,结晶出无色溶剂合物A,化学式为[Ag9L8(CH3CN)x](PF6)y·nCH3CN。元素分析结果给出,A中C,H,N,P的含量(质量分数,%)分别为:C-27.40,H-3.35,N-6.24,P-6.90。室温下在真空中小心处理A,A可脱去外界的溶剂分子,失重2.0%。
){HL+=[HSC6H4N(CH3)3]+}混合研磨,两种固体发生反应,得到一种淡黄色粉末。粉末用乙腈处理,结晶出无色溶剂合物A,化学式为[Ag9L8(CH3CN)x](PF6)y·nCH3CN。元素分析结果给出,A中C,H,N,P的含量(质量分数,%)分别为:C-27.40,H-3.35,N-6.24,P-6.90。室温下在真空中小心处理A,A可脱去外界的溶剂分子,失重2.0%。
①通过计算,确定A的化学式______ 。(提示:元素分析中,氢含量测定误差常常较大。)
②写出两种固体反应生成淡黄色粉末的方程式______ (要求系数比为最简整数比)。

氧化得到的偶联产物在550nm波长处的摩尔消光系数为1.8×104Lmol-1cm-1。利用这一反应,通过分光光度法可测定起始溶液中的银离子浓度。
(1)25℃,在纯水中配得乙酸银的饱和水溶液。取1.00mL溶液,按计量加入两种苯二胺,至显色稳定后,稀释定容至1L。用1cm的比色皿,测得溶液在550nm处的吸光度为0.225。计算乙酸银的溶度积Ksp
(2)室温下将乙酸银与4-三甲铵基苯硫醇的六氟磷酸盐(HL+)(
 ){HL+=[HSC6H4N(CH3)3]+}混合研磨,两种固体发生反应,得到一种淡黄色粉末。粉末用乙腈处理,结晶出无色溶剂合物A,化学式为[Ag9L8(CH3CN)x](PF6)y·nCH3CN。元素分析结果给出,A中C,H,N,P的含量(质量分数,%)分别为:C-27.40,H-3.35,N-6.24,P-6.90。室温下在真空中小心处理A,A可脱去外界的溶剂分子,失重2.0%。
){HL+=[HSC6H4N(CH3)3]+}混合研磨,两种固体发生反应,得到一种淡黄色粉末。粉末用乙腈处理,结晶出无色溶剂合物A,化学式为[Ag9L8(CH3CN)x](PF6)y·nCH3CN。元素分析结果给出,A中C,H,N,P的含量(质量分数,%)分别为:C-27.40,H-3.35,N-6.24,P-6.90。室温下在真空中小心处理A,A可脱去外界的溶剂分子,失重2.0%。①通过计算,确定A的化学式
②写出两种固体反应生成淡黄色粉末的方程式
您最近一年使用:0次
名校
解题方法
4 . 钠是一种非常活泼、具有广泛应用的金属。请回答:
(1)将一小块金属钠投入水中,发生反应的离子方程式是_______ ;可观察到的实验现象是_______ (填字母序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积_______ L;原混合气体的中CO2和H2O的分子数比为_______ 。
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
(1)将一小块金属钠投入水中,发生反应的离子方程式是
a.钠沉到水底 b.钠熔成小球 c.小球四处游动 d.有嘶嘶声
(2)钠在空气中的燃烧产物Na2O2可用于呼吸面具或潜水艇中氧气的来源,11.6gCO2和H2O的混合物与足量Na2O2充分反应后,固体质量增加了3.6 g,则生成标准状况下O2的体积
(3)下列实验方案中,不能测定Na2CO3和NaHCO3的混合物中Na2CO3质量分数的是_______
| A.取a g混合物充分加热,质量减少b g |
| B.取a g混合物与足量NaOH溶液充分反应,得到b g溶液 |
| C.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得到b g固体 |
| D.取a g混合物与足量稀硫酸反应,逸出气体经干燥后用碱石灰吸收,质量增加b g |
您最近一年使用:0次
2022-11-29更新
|
538次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高一上学期基础知识竞赛化学试题
解题方法
5 . 某研究小组用工业钛白副产品为原料制备纳米级电池材料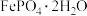 ,按如下流程开展实验。
,按如下流程开展实验。 ,含少量的
,含少量的 、
、 、
、 等杂质。
等杂质。
②已知 和
和 的氧化性随酸性的增强而增强。
的氧化性随酸性的增强而增强。
请回答:
(1)常温下步骤Ⅰ所得料液其pH___________ 7(填“>”、“<”)。
(2)下列说法不正确 的是___________。
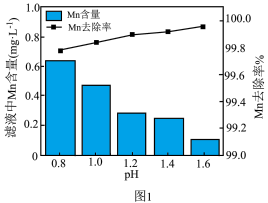
(3)步骤Ⅴ中Mn元素的去除率及滤液中Mn元素含量随着溶液pH值的关系如图1所示,___________ 。
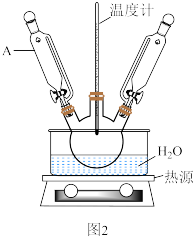
(4)步骤Ⅵ操作之一采用如图2所示装置进行(忽略夹持装置),仪器A的名称是___________ ;该操作不宜用酒精灯直接加热的原因是___________ 。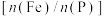 是衡量磷酸铁品质最关键的指标。
是衡量磷酸铁品质最关键的指标。
Fe元素的定量测定:①配制一系列pH=3~5, 浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺(
浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺( )溶液,调pH=3~5,加入邻菲罗啉。③进行比色
)溶液,调pH=3~5,加入邻菲罗啉。③进行比色
①通过比色能获得Fe元素浓度的原理是___________ 。
②测得产品中铁磷比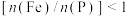 ,可能原因是
,可能原因是___________ 。
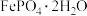 ,按如下流程开展实验。
,按如下流程开展实验。
 ,含少量的
,含少量的 、
、 、
、 等杂质。
等杂质。②已知
 和
和 的氧化性随酸性的增强而增强。
的氧化性随酸性的增强而增强。请回答:
(1)常温下步骤Ⅰ所得料液其pH
(2)下列说法
| A.步骤Ⅱ,加入Fe粉的目的是调节溶液pH值,以便Ti元素水解沉淀 |
B.步骤Ⅲ,加入 的目的是除去Mg元素 的目的是除去Mg元素 |
| C.为了提高实验效率,可以将Ⅱ、Ⅲ、Ⅴ的过滤操作合并 |
D.步骤Ⅳ中过量的 可在步骤Ⅴ中被氧化去除 可在步骤Ⅴ中被氧化去除 |
(3)步骤Ⅴ中Mn元素的去除率及滤液中Mn元素含量随着溶液pH值的关系如图1所示,
(4)步骤Ⅵ操作之一采用如图2所示装置进行(忽略夹持装置),仪器A的名称是
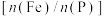 是衡量磷酸铁品质最关键的指标。
是衡量磷酸铁品质最关键的指标。Fe元素的定量测定:①配制一系列pH=3~5,
 浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺(
浓度由低到高的与邻菲罗啉的橙红色络合物的标准液。②称取一定量产品,用适量盐酸溶解,再加入足量的盐酸羟胺( )溶液,调pH=3~5,加入邻菲罗啉。③进行比色
)溶液,调pH=3~5,加入邻菲罗啉。③进行比色①通过比色能获得Fe元素浓度的原理是
②测得产品中铁磷比
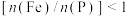 ,可能原因是
,可能原因是
您最近一年使用:0次
6 . 用传统的工艺方法从矿物中提取锰和锌存在能耗高、三废排放量大和工艺流程长等缺点。2009年报道,采用1:1硫酸溶液同槽浸出锰结核矿[质量分数w(MnO2)=0.20]和锌精矿[质量分数w(ZnS)=0.70]的工艺方法提取锰和锌获得成功,对资源综合利用、节能减排和清洁生产都有重要的实际意义。已知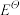 (Fe3+/Fe2+)=0.77V,
(Fe3+/Fe2+)=0.77V,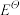 (Fe2+/Fe)=-0.44V,
(Fe2+/Fe)=-0.44V,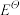 (MnO2/Mn2+)=1.23V,
(MnO2/Mn2+)=1.23V,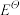 (S/ZnS)=0.265V。
(S/ZnS)=0.265V。
(1)锰结核矿和锌精矿单独酸浸结果很不理想。请通过热力学计算,说明锰结核矿和锌精矿同槽酸浸时发生化学反应的可行性_______ 。
(2)模拟实验发现,二氧化锰和硫化锌同槽酸浸时反应速率很慢,若在酸溶液中加入少量的铁屑则能明显使反应速率加快。写出铁进入溶液后分别与二氧化锰和硫化锌发生化学反应的离子方程式_______ ,并简述反应速率加快的原因_______ 。
(3)研究发现,两种矿物同槽酸浸4小时后,锰和锌的浸出率只有~80%,为了提高浸出率,在实际工艺中,须将过滤后的滤渣用四氯乙烷处理后再做二次酸浸,请简要说明四乙氯烷的作用_______ 。
(4)锌精矿中常有部分铅共生,同槽酸浸工艺回收铅的方法之一是在浸渣中加入足量的食盐水使铅溶出,写出溶出铅的化学方程式_______ 。
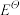 (Fe3+/Fe2+)=0.77V,
(Fe3+/Fe2+)=0.77V,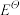 (Fe2+/Fe)=-0.44V,
(Fe2+/Fe)=-0.44V,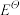 (MnO2/Mn2+)=1.23V,
(MnO2/Mn2+)=1.23V,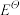 (S/ZnS)=0.265V。
(S/ZnS)=0.265V。(1)锰结核矿和锌精矿单独酸浸结果很不理想。请通过热力学计算,说明锰结核矿和锌精矿同槽酸浸时发生化学反应的可行性
(2)模拟实验发现,二氧化锰和硫化锌同槽酸浸时反应速率很慢,若在酸溶液中加入少量的铁屑则能明显使反应速率加快。写出铁进入溶液后分别与二氧化锰和硫化锌发生化学反应的离子方程式
(3)研究发现,两种矿物同槽酸浸4小时后,锰和锌的浸出率只有~80%,为了提高浸出率,在实际工艺中,须将过滤后的滤渣用四氯乙烷处理后再做二次酸浸,请简要说明四乙氯烷的作用
(4)锌精矿中常有部分铅共生,同槽酸浸工艺回收铅的方法之一是在浸渣中加入足量的食盐水使铅溶出,写出溶出铅的化学方程式
您最近一年使用:0次
解题方法
7 . 我国从澳大利亚进口的某高炉生铁(用A表示)的成分如下(其余是铁):
(1)称取10.000gA经过一系列处理(最后一步是在空气中灼烧)后,锰全部转变为某种氧化物,其质量为0.0687g,则该氧化物的化学式为_______ 。
(2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数为_______ %。
(3)某炼钢厂的烟尘成分和质量分数如下表:
为了减少烟尘的排放,将姻尘与CO混合后在空气中煆烧,得到铁的氧化物和CaO的烧结物,其中CaO的质量分数为8.92%(金属元素无损耗),烧结物分离出CaO后,铁的氧化物的组成和物质的量之比如何(若无确定值,请表示某组分物质的量分数的取值范围)_______ ?
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
(2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数为
(3)某炼钢厂的烟尘成分和质量分数如下表:
| FeO | Fe2O3 | CaO | |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |
您最近一年使用:0次
8 . 下图是一种染料敏化太阳能电池的示意图,电池的一个电极由吸附光敏染料(D)的TiO2。纳米晶体涂敷在导电玻璃上构成,另一电极由Pt-导电玻璃构成,工作原理为:

①TiO2/D +TiO2/D*(激发态)
+TiO2/D*(激发态)
②TiO2/D*→TiO2/D+e-
③还原剂A+D→D+氧化产物B
④还原剂A再生
回答下列问题:
(1)Pt电极是该电池的_______ 极(填“正”或“负”)。
(2)结合图示写出③的离子方程式(其中染料分子用D表示)_______ 。
(3)电池工作过程中,导带中的e-会与D+发生复合,该反应的速率常数为kˊ,步骤③的速率常数为k,若该电池持续稳定工作,则k_______ kˊ(填“>”或“<”)。
(4)导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答两条即可)_______ 。
(5)一种经典的染料D以金属离子Mx+为中心,2,2ˊ-联吡啶衍生物(用L表示,结构如图,分子式为C12H8N2O4)和SCN-为配体,化学式可用M(L)n(NCS)6-2n表示。
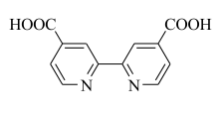
①已知D中C、H、N元素质量分数分别为44.25%、2.27%、11.91%,通过计算判断出金属M的种类_______ ,n=_______ 。
②若D为抗磁性,写出中心离子Mx+价电子的轨道表示式_______ ,其杂化轨道类型为_______ 。
③已知SCN-中N原子与中心离子配位,画出D可能的结构,配体L用 表示
表示_______ 。

①TiO2/D
 +TiO2/D*(激发态)
+TiO2/D*(激发态)②TiO2/D*→TiO2/D+e-
③还原剂A+D→D+氧化产物B
④还原剂A再生
回答下列问题:
(1)Pt电极是该电池的
(2)结合图示写出③的离子方程式(其中染料分子用D表示)
(3)电池工作过程中,导带中的e-会与D+发生复合,该反应的速率常数为kˊ,步骤③的速率常数为k,若该电池持续稳定工作,则k
(4)导电玻璃材料的选择非常重要,你认为该材料应具备哪些性能(回答两条即可)
(5)一种经典的染料D以金属离子Mx+为中心,2,2ˊ-联吡啶衍生物(用L表示,结构如图,分子式为C12H8N2O4)和SCN-为配体,化学式可用M(L)n(NCS)6-2n表示。

①已知D中C、H、N元素质量分数分别为44.25%、2.27%、11.91%,通过计算判断出金属M的种类
②若D为抗磁性,写出中心离子Mx+价电子的轨道表示式
③已知SCN-中N原子与中心离子配位,画出D可能的结构,配体L用
 表示
表示
您最近一年使用:0次
解题方法
9 . 化合物A俗称“吊白块”,年产量上万吨,主要用于染色工艺,具还原性和漂白性,对热不稳定,有毒。近年报道,我国一些不法商人违章地将A添加到米、面、腐竹、食糖等食品中增白,导致多起严重食物中毒事件,如某地曾发生五所学校400余名学生食用含A食品一次性中毒事件。
已知:固体A·2H2O的摩尔质量为154g/mol;
①A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
②A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
③A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1:1),反应产物为A和亚硫酸钠。
④A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式___________ 。
(2)写出上述制备A的“分子方程式”_____________ 。
(3)给出A的化学名称_______________ 。
已知:固体A·2H2O的摩尔质量为154g/mol;
①A的晶体结构及其水溶液的电导证实A是钠盐,每摩尔A含1摩尔钠离子。
②A在水中的溶解度极大,20℃饱和溶液A的质量分数达45%。
③A的制备方法之一是,在NaOH溶液中分甲醛与Na2S2O4(连二亚硫酸钠)反应(摩尔比1:1),反应产物为A和亚硫酸钠。
④A在化学上属于亚磺酸的衍生物,亚磺酸的通式为RSO2H,R为有机基团。
(1)画出A的阴离子的结构(简)式
(2)写出上述制备A的“分子方程式”
(3)给出A的化学名称
您最近一年使用:0次
10 . 高温超导材料的研究是21世纪材料领域的热点问题,YBaCuO体系一直是此领域的研究重点之一。将钇(Y)、钡、铜的氧化物按一定的物质的量之比混合(Y为ⅢB族元素),再经高温煅烧可得到复合氧化物YBa2Cu3O6.5+δ,实验证明:该物质具有超导性能,其零电阻温度可达90K,化学式中的δ大小与超导性能密切相关。有一种观点认为δ的产生源于体系中产生了Cu3+。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为_______ 。
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为_______ ,m值为_______ 。
(1)经测定δ一般不大于0.50,按此推算,Cu3+ 占物质中总铜量的质量分数最大为
(2)已知可用间接碘量法测出体系中Cu3+ 的质量分数,该法涉及的化学反应有:4Cu3++2H2O=4Cu2++O2+4H+,2Cu2++4I-=Cu2I2+I2,2S2O
 +I2=S4O
+I2=S4O +2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
+2I-等。现有两份质量都为m的该氧化物,其中一份加过量的KI固体,溶解后用浓度为0.1568mol/L的Na2S2O3 滴定至终点,消耗Na2S2O3 的体积为30.26mL,另一份先完全溶解,再加和第一份等量的KI固体,用同样浓度的Na2S2O3 滴定至终点,消耗的体积为23.89mL,该氧化物中Cu3+ 的质量分数为
您最近一年使用:0次



