名校
解题方法
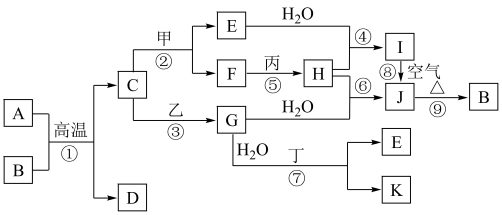
1 . 如图是中学化学常见物质的转化关系,部分物质和反应条件略去。其中A是地壳中含量最多的金属元素的单质,B是一种红棕色粉末;通常情况下,乙为黄绿色气体单质,H是有刺激性气味的气体,在工业上可通过反应⑥在高温高压、催化剂条件下合成;J为难溶于水的红褐色固体;反应⑦在工业上可用于制作印刷电路板。
请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为___________ 。
(2)在反应①~⑨中,不属于氧化还原反应的是___________ 。
(3)写出下列反应的化学方程式:
反应①:___________ 。
反应⑧:___________ 。
(4)写出乙与E在溶液中反应的离子方程式:___________ 。
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:___________ 。
(6)检验G中阳离子的试剂的化学式为___________ ,反应现象为___________ 。

请回答下列问题:
(1)组成物质C的元素在元素周期表中的位置为
(2)在反应①~⑨中,不属于氧化还原反应的是
(3)写出下列反应的化学方程式:
反应①:
反应⑧:
(4)写出乙与E在溶液中反应的离子方程式:
(5)在E溶液中加入与E等物质的量的一种淡黄色固体,恰好使E转化为J,写出该反应的离子方程式:
(6)检验G中阳离子的试剂的化学式为
您最近一年使用:0次
2 .  、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
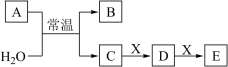
(1)若 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:
① 的电子式为
的电子式为___________ , 与
与 反应的离子方程式为
反应的离子方程式为___________ 。
②若 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为___________ 。
③若 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为_____ (填代号)。
a.酚酞溶液b. 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液
④若 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为________ ,写出 的一种用途
的一种用途______ 。
(2)若 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:
①组成物质 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是___________ 。
② 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性___________ (填“增强”、“减弱”或“不变”)。
③若 为强电解质,则
为强电解质,则 可能为
可能为___________ (填代号)。
a. b.
b. c.
c. d.
d.
④请写出 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:___________ 。
 、
、 、
、 、
、 、
、 、
、 是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
是中学常见的无机物,存在如图转化关系(部分生成物和反应条件略去)。
(1)若
 的焰色试验为黄色,且
的焰色试验为黄色,且 为化合物,回答下列问题:
为化合物,回答下列问题:①
 的电子式为
的电子式为 与
与 反应的离子方程式为
反应的离子方程式为②若
 为强还原性的非金属单质,通常为黑色粉末,则
为强还原性的非金属单质,通常为黑色粉末,则 的电子式为
的电子式为③若
 为一种造成温室效应的气体,则鉴别等浓度的
为一种造成温室效应的气体,则鉴别等浓度的 、
、 溶液,可选择的试剂为
溶液,可选择的试剂为a.酚酞溶液b.
 溶液c.
溶液c. 溶液d.
溶液d. 溶液
溶液④若
 为
为 ,则
,则 与
与 反应的化学方程式为
反应的化学方程式为 的一种用途
的一种用途(2)若
 为黄绿色气体单质,具有很强的氧化性,则:
为黄绿色气体单质,具有很强的氧化性,则:①组成物质
 的元素在元素周期表中的位置是
的元素在元素周期表中的位置是②
 的水溶液放置一段时间后,溶液的酸性
的水溶液放置一段时间后,溶液的酸性③若
 为强电解质,则
为强电解质,则 可能为
可能为a.
 b.
b. c.
c. d.
d.
④请写出
 与冷的石灰乳反应的化学方程式:
与冷的石灰乳反应的化学方程式:
您最近一年使用:0次
2023-12-26更新
|
184次组卷
|
2卷引用:陕西师范大学附属中学2023-2024学年高一上学期12月月考化学试题
解题方法
3 . 已知短周期元素 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
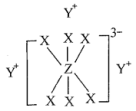
回答下列问题:
(1) 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是___________ ,写出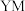 的电子式:
的电子式:___________ 。
(2) 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):___________ 。
(3)在 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:___________ 。
(4)镓 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓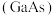 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是___________ 。
a. 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族
b. 为新型无机非金属材料
为新型无机非金属材料
c. 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强
d.酸性:
②废弃的含 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为___________ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
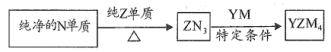
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为___________ 。
②现设计如图四种装置测定 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
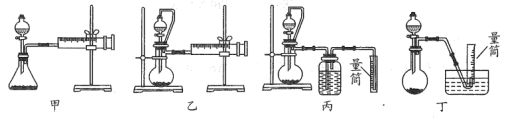
从简约性、准确性考虑,最适宜的方案是___________ (填编号)。
③取样品 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为___________ (用代数式表示)。
 、
、 、
、 、
、 、
、 分布在三个周期,
分布在三个周期, 、
、 最外层电子数相同,物质
最外层电子数相同,物质 由原子序数依次增大的元素
由原子序数依次增大的元素 、
、 、
、 组成,其中
组成,其中 的简单离子半径在同周期中最小,
的简单离子半径在同周期中最小, 、
、 、
、 简单离子的核外电子排布相同,物质
简单离子的核外电子排布相同,物质 的结构式如下图所示:
的结构式如下图所示:
回答下列问题:
(1)
 、
、 元素的中文名称为徐寿确定并使用至今,
元素的中文名称为徐寿确定并使用至今, 在周期表中的位置是
在周期表中的位置是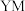 的电子式:
的电子式:(2)
 、
、 、
、 、
、 简单离子的半径由大到小的顺序(用对应离子符号表示):
简单离子的半径由大到小的顺序(用对应离子符号表示):(3)在
 ,与
,与 的混合液中,通入足量
的混合液中,通入足量 ,是工业制取
,是工业制取 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓
 与
与 为同主族元素,氮化镓
为同主族元素,氮化镓 和砷化镓
和砷化镓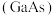 作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。①下列有关说法正确的是
a.
 位于元素周期表第四周期ⅣA族
位于元素周期表第四周期ⅣA族b.
 为新型无机非金属材料
为新型无机非金属材料c.
 的最高价氧化物对应水化物的碱性比
的最高价氧化物对应水化物的碱性比 元素最高价氧化物对应水化物的碱性强
元素最高价氧化物对应水化物的碱性强d.酸性:

②废弃的含
 的半导体材料可以用浓硝酸溶解,生成
的半导体材料可以用浓硝酸溶解,生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示
是有机合成的重要还原剂,其合成路线如图所示
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②现设计如图四种装置测定
 样品的纯度(假设杂质不参与反应)。
样品的纯度(假设杂质不参与反应)。
从简约性、准确性考虑,最适宜的方案是
③取样品
 ,若实验测得氢气的体积为
,若实验测得氢气的体积为 (标准状态),则
(标准状态),则 样品纯度为
样品纯度为
您最近一年使用:0次
名校
解题方法
4 . 结构决定性质是元素周期律和有机化学中展现的淋漓尽致,是高中化学重要思想。
Ⅰ.一种扇形元素周期表的一部分如图所示。字母a~n表示元素周期表中的对应元素。
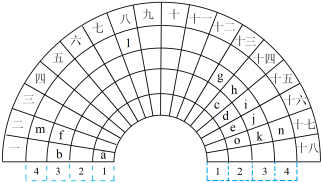
(1)元素n在元素周期表中的位置___________ 。
(2)比较f、o、k简单离子的半径,由大到小的顺序是___________ (用离子符号表示)。
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式___________ 。
(4)i的最高价氧化物对应水化物的化学式___________ ,i、d的最简单氢化物中稳定性更高的为___________ (用化学式表示)。
Ⅱ.A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):
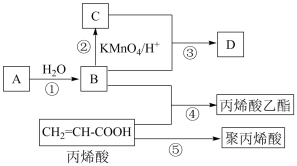
(5)A的结构简式为___________ ,C中官能团的名称为___________ 。
(6)丙烯酸乙酯的结构简式为___________ 。
(7)写出反应①化学方程式和有机反应基本类型:___________ ,___________ 反应。
(8)写出反应⑤化学方程式和有机反应基本类型:___________ ,___________ 反应。
Ⅰ.一种扇形元素周期表的一部分如图所示。字母a~n表示元素周期表中的对应元素。

(1)元素n在元素周期表中的位置
(2)比较f、o、k简单离子的半径,由大到小的顺序是
(3)b与e组成的化合物中,含有非极性共价键的化合物的电子式
(4)i的最高价氧化物对应水化物的化学式
Ⅱ.A、B、C、D是四种常见的有机物,其中A的产量通常用来衡量一个国家的石油化工发展水平,B与C在浓硫酸和加热条件下发生反应,生成的有机物有特殊香味;A、B、C、D在一定条件下的转化关系如图所示(反应条件已省略):

(5)A的结构简式为
(6)丙烯酸乙酯的结构简式为
(7)写出反应①化学方程式和有机反应基本类型:
(8)写出反应⑤化学方程式和有机反应基本类型:
您最近一年使用:0次
名校
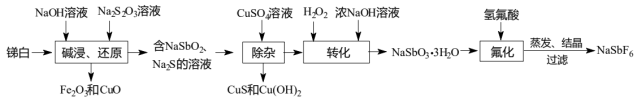
5 . 六氟锑酸钠(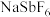 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含 、
、 和
和 、
、 、
、 等)合成六氟锑酸钠的工艺流程如图所示:
等)合成六氟锑酸钠的工艺流程如图所示:
已知:① 的性质与
的性质与 类似;②
类似;② 可溶于Na2S溶液;③
可溶于Na2S溶液;③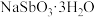 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:
(1)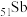 在元素周期表中的位置是
在元素周期表中的位置是_______ ,属于______ 区元素
(2)“碱浸、还原”时, 发生反应的离子方程式为
发生反应的离子方程式为_______ ;若 与
与 反应计量关系为2∶1,则氧化产物为
反应计量关系为2∶1,则氧化产物为_______
(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的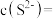
_______ [结果保留两位有效数字,常温下, ,
,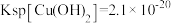 ]
]
(4)“转化”时控温约 的原因是
的原因是_______
(5)“氟化”中发生的反应化学方程式为_______ ,此过程不能选择玻璃仪器,是因为_______
(6)氟锑酸化学式为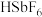 ,酸性比纯硫酸要强
,酸性比纯硫酸要强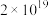 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成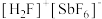 ,
, 离子的空间构型为
离子的空间构型为_______
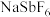 )是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含
)是一种新开发的锑的精细化工产品,主要用于有机合成、光化学反应、半导体刻蚀等.中南大学的杨天足教授提出了一种在水溶液中由锑白(主要含 、
、 和
和 、
、 、
、 等)合成六氟锑酸钠的工艺流程如图所示:
等)合成六氟锑酸钠的工艺流程如图所示:
已知:①
 的性质与
的性质与 类似;②
类似;② 可溶于Na2S溶液;③
可溶于Na2S溶液;③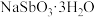 晶体难溶于水。请回答下列问题:
晶体难溶于水。请回答下列问题:(1)
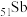 在元素周期表中的位置是
在元素周期表中的位置是(2)“碱浸、还原”时,
 发生反应的离子方程式为
发生反应的离子方程式为 与
与 反应计量关系为2∶1,则氧化产物为
反应计量关系为2∶1,则氧化产物为(3)“除杂”时,当溶液中出现蓝色沉淀,立即停止加入
 溶液,测得此时溶液的
溶液,测得此时溶液的 ,则此时溶液中残留的
,则此时溶液中残留的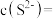
 ,
,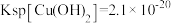 ]
](4)“转化”时控温约
 的原因是
的原因是(5)“氟化”中发生的反应化学方程式为
(6)氟锑酸化学式为
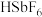 ,酸性比纯硫酸要强
,酸性比纯硫酸要强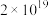 倍,称为超强酸,其与HF作用生成
倍,称为超强酸,其与HF作用生成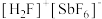 ,
, 离子的空间构型为
离子的空间构型为
您最近一年使用:0次
2022-05-06更新
|
396次组卷
|
2卷引用:江苏省扬州中学2022-2023学年高三上学期11月月考化学试题
解题方法
6 . 已知A、B、C、D、E、F是原子序数依次增大的六种短周期主族元素,A与B能形成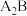 和
和 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
(1)C在元素周期表中的位置是_______ 。
(2)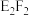 的电子式为
的电子式为_______ 。
(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(4) 和
和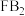 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的 和
和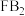 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为_______ 。
(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。
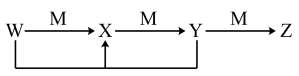
①Z的化学式为_______ 。
②上述五种物质所含的元素中,原子半径最大的是_______ (填元素符号)。
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为_______ 。
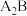 和
和 两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:
两种常见共价化合物,A与C位于相邻主族,B与E位于同一主族,D是同周期中简单离子半径最小的元素。回答下列问题:(1)C在元素周期表中的位置是
(2)
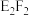 的电子式为
的电子式为(3)D的最高价氧化物对应的水化物与F的最高价氧化物对应的水化物反应的离子方程式为
(4)
 和
和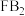 是市场上较好的消毒剂,等质量的
是市场上较好的消毒剂,等质量的 和
和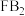 分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为
分别与足量二氧化硫反应时,消耗二氧化硫的质量之比为(5)已知W、X、Y、Z四种物质中均含有上述元素中的某一种,M、X为单质,其余均为化合物,它们之间存在如图所示的转化关系(反应条件略)。

①Z的化学式为
②上述五种物质所含的元素中,原子半径最大的是
③C元素形成的单质与M在海水中可以形成原电池,其正极的电极反应式为
您最近一年使用:0次
名校
7 . A、B、C、D、E、F、G为中学化学常见物质,它们之间有如图转化关系(反应条件已略去)。已知:A、C、D、E均含有同种非金属元素M,A为气态氢化物;G是一种紫红色的金属单质;B是空气的组成成分,在空气中占比约为21%。根据学知识,按要求回答下列问题:

Ⅰ.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为_______ 。
(2)写出反应②的化学方程式:_______ ,该反应中体现了E的浓溶液的强氧化性和_______ 性。
(3)将C通入足量溴水中,发生反应的离子方程式为_______ ;将C通入少量品红溶液中可观察到的现象为_______ 。
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F3种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:_______ 。
(5)常温下,将60mL C、D的混合气体与30mL B同时通入水中,充分反应后,剩余7.5mL气体,则60mL混合气体中C的体积分数可能为_______ (填标号)。
①15.00% ②25.00% ③41.25% ④68.75%

Ⅰ.若A具有臭鸡蛋气味,且能与C反应生成一种淡黄色非金属单质,反应①为非氧化还原反应,反应②为E的浓溶液与G反应,则:
(1)M元素在元素周期表中的位置为
(2)写出反应②的化学方程式:
(3)将C通入足量溴水中,发生反应的离子方程式为
Ⅱ.若光照条件下,E的浓溶液易分解得到B、D、F3种物质;大量排放汽车尾气中的C、D会导致光化学烟雾,已知:反应②为E的稀溶液与G反应。
(4)写出A+B→C+F的化学方程式:
(5)常温下,将60mL C、D的混合气体与30mL B同时通入水中,充分反应后,剩余7.5mL气体,则60mL混合气体中C的体积分数可能为
①15.00% ②25.00% ③41.25% ④68.75%
您最近一年使用:0次
2022-05-20更新
|
575次组卷
|
3卷引用:河南省安阳市2021-2022学年高一下学期阶段性考试(四)化学试题
河南省安阳市2021-2022学年高一下学期阶段性考试(四)化学试题河南省许平汝漯2021-2022学年高一下学期5月大联考化学试题(已下线)第15练 实验综合题与无机综合题-2022年【暑假分层作业】高一化学(人教版2019必修第二册)
20-21高一·浙江·阶段练习
解题方法
8 . 化合物A中含有三种元素,3.68gA 在氧气中充分煅烧后生成1.28 gB、1.60 gC和气体D,物质A~H存在如下转化关系。
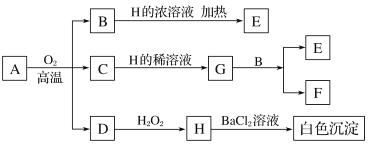
已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A的化学式:___________ ,其中非金属元素在元素周期表中的位置为:___________ 。
(2)检验气体D的实验方法:___________ 。
(3)写出B与H的浓溶液反应的化学方程式:___________ 。
(4)写出A在氧气中充分煅烧的化学方程式:___________ 。

已知B是一种红色金属单质,C是金属氧化物,D是非金属氧化物,E、F、G是盐。请回答:
(1)化合物A的化学式:
(2)检验气体D的实验方法:
(3)写出B与H的浓溶液反应的化学方程式:
(4)写出A在氧气中充分煅烧的化学方程式:
您最近一年使用:0次
名校
解题方法
9 . A~H均为短周期元素,A~F在元素周期表中的相对位置如图1所示,G与其他七种元素不在同一周期,H是短周期中原子半径最大的主族元素。由B、G构成的最简单化合物常作为氮肥工业和纯碱工业的原料。由上述某些元素组成的物质甲~戊的转化关系如图2所示。

已知图2中反应①是复分解反应,生成物中水已略去。请回答下列问题:
(1)上述元素组成的单质中,硬度最大的是_________________ (填该物质名称)。
(2)若戊是含有18电子的双原子分子,则丙的电子式为________________ ;在①中制取气体丙的化学方程式为_______________________________________________ 。
(3)若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用作干燥剂,写出甲的一种用途:_____________________________ 。
(4)如果图2中反应①是置换反应,戊是单质,则戊不可能是_____________ 。 (填序母序号)
A、O2 B、Cl2 C、H2 D、N2

已知图2中反应①是复分解反应,生成物中水已略去。请回答下列问题:
(1)上述元素组成的单质中,硬度最大的是
(2)若戊是含有18电子的双原子分子,则丙的电子式为
(3)若甲的水溶液呈碱性,丙的凝胶经干燥脱水后,常用作干燥剂,写出甲的一种用途:
(4)如果图2中反应①是置换反应,戊是单质,则戊不可能是
A、O2 B、Cl2 C、H2 D、N2
您最近一年使用:0次
10 . Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去),已知A由短周期非金属元素组成,B具有漂白性且光照易分解。

(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为______________________ ;
②A与H2O反应的离子反应方程式为______________________ ;
③X可能为________ (填代号)。a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为______________________ ;
②A与H2O反应的化学反应方程式为______________________ ;
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(3)请画出沉淀B中金属元素的原子结构示意图______________________ ;
(4)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式______________________ ;
(5)请写出气体C与氯气发生氧化还原反应的化学方程式______________________ 。

(1)若A为单质,且常温下0.1mol•L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为
②A与H2O反应的离子反应方程式为
③X可能为
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为
②A与H2O反应的化学反应方程式为
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体 C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol.回答下列问题:
(3)请画出沉淀B中金属元素的原子结构示意图
(4)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式
(5)请写出气体C与氯气发生氧化还原反应的化学方程式
您最近一年使用:0次



