解题方法
1 . 某小组在做铜与浓硫酸反应时发现产生黑色固体。于是他们对黑色固体进行探究,实验步骤如下:
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤II产生的气体是___________ 。
(2)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀。由该检验过程所得结论是___________ 。
(3)再次假设,黑色沉淀是铜的硫化物。实验如下:
①现象2说明黑色沉淀具有___________ 性。
②产生红棕色气体的化学方程式是___________ 。
③能确认黑色沉淀中含有S元素的现象是___________ 。
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是___________ 。
(4)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是___________ 。
I.将光亮铜丝插入浓硫酸,加热;
II.待产生大量黑色沉淀和气体时,抽出铜丝,停止加热;
III.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
(1)步骤II产生的气体是
(2)该同学假设黑色沉淀是CuO。检验过程如下:
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+。
①将CuO放入稀硫酸中,一段时间后,未见明显现象,再滴加K4[Fe(CN)6]溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,滴加K4[Fe(CN)6]溶液,未见红褐色沉淀。由该检验过程所得结论是
(3)再次假设,黑色沉淀是铜的硫化物。实验如下:
| 实验装置 | 现象 |
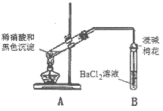 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
②产生红棕色气体的化学方程式是
③能确认黑色沉淀中含有S元素的现象是
④为确认黑色沉淀是“铜的硫化物”,还需进行的实验是
(4)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入足量浓硫酸中加热一段时间后,黑色沉淀完全溶解,得到澄清溶液,其中CuS溶解的化学方程式是
您最近一年使用:0次
2 . 化学小组实验探究SO2与AgNO3溶液的反应。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。
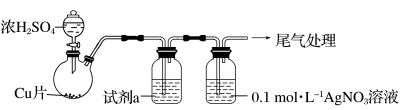
①浓H2SO4与Cu反应的化学方程式是____________________________________ 。
②试剂a是____________ 。
(2)对体系中有关物质性质分析得出:沉淀B可能为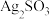 、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:__________ 。
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是__________ 。
(3)根据沉淀F的存在,推测 的产生有两个途径:
的产生有两个途径:
途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中, 被氧化为
被氧化为 进入D。
进入D。
实验三:探究 的产生途径
的产生途径
①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有________ :取上层清液继续滴加BaCl2溶液,未出现白色沉淀,可判断B中不含Ag2SO4。做出判断的理由:_______ 。
②实验三的结论:__________ 。
(4)实验一中SO2与AgNO3溶液反应的离子方程式是_________________ 。
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和 生成。
生成。
(6)根据上述实验所得结论:__________________ 。
(1)实验一:用如下装置(夹持、加热仪器略)制备SO2,将足量SO2通入AgNO3溶液中,迅速反应,得到无色溶液A和白色沉淀B。

①浓H2SO4与Cu反应的化学方程式是
②试剂a是
(2)对体系中有关物质性质分析得出:沉淀B可能为
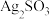 、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)
、Ag2SO4或两者混合物。(资料:Ag2SO4微溶于水;Ag2SO3难溶于水)实验二:验证B的成分

①写出Ag2SO3溶于氨水的离子方程式:
②加入盐酸后沉淀D大部分溶解,剩余少量沉淀F。推断D中主要是BaSO3,进而推断B中含有Ag2SO3。向滤液E中加入一种试剂,可进一步证实B中含有Ag2SO3。所用试剂及现象是
(3)根据沉淀F的存在,推测
 的产生有两个途径:
的产生有两个途径:途径1:实验一中,SO2在AgNO3溶液中被氧化生成Ag2SO4,随沉淀B进入D。
途径2:实验二中,
 被氧化为
被氧化为 进入D。
进入D。实验三:探究
 的产生途径
的产生途径①向溶液A中滴入过量盐酸,产生白色沉淀,证明溶液中含有
②实验三的结论:
(4)实验一中SO2与AgNO3溶液反应的离子方程式是
(5)根据物质性质分析,SO2与AgNO3溶液应该可以发生氧化还原反应。将实验一所得混合物放置一段时间,有Ag和
 生成。
生成。(6)根据上述实验所得结论:
您最近一年使用:0次
2019-06-09更新
|
10272次组卷
|
23卷引用:北京市第一〇一中学2021届高三上学期9月月考化学试题
北京市第一〇一中学2021届高三上学期9月月考化学试题2019年北京高考化学试题(已下线)专题10.3 化学实验方案的设计与评价 (练)-《2020年高考一轮复习讲练测》人教版(2019)必修第二册第五章 模拟高考必修第二册RJ第5章挑战区 模拟高考湖南省长沙市雅礼中学2021届高三上学期第一次月考化学试题人教版2019必修第二册 第五章 第一节综合拔高练(已下线)考点32 化学实验方案设计与评价-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点33 物质的定性与定量分析-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)考向14 物质制备探究-备战2022年高考化学一轮复习考点微专题(已下线)考向12 硫及其化合物-备战2022年高考化学一轮复习考点微专题(已下线)第7周 晚练题-备战2022年高考化学周测与晚练(新高考专用)江西省宜春市第九中学2021-2022学年高三上学期10月月考化学试题(已下线)专题讲座(十)化学实验设计与探究(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)2021年广东省高考化学试卷变式题11-21(已下线)专题02 定性探究-【微专题·大素养】备战2022年高考化学核心突破(实验综合大题)(已下线)必刷卷05-2022年高考化学考前信息必刷卷(全国甲卷)(已下线)专题十六实验设计与探究实验江苏省海安市实验中学2022-2023学年高一第一次月考化学试题广东省湛江市普通高中2023届高三下学期4月模拟考试化学试题(已下线)专题19 实验综合题(已下线)T28-实验探究题北京市第九中学2023-2024学年高二下学期2月开学考化学试题



