名校
解题方法
1 . 下列有关实验操作及实验现象的解释或结论正确的是
选项 | 实验操作 | 实验现象 | 实验解释或结论 |
A | 向某钾盐溶液中滴加浓盐酸,将产生的气体通入澄清石灰水中 | 产生白色浑浊 | 该钾盐为 |
B | 煤粉隔绝空气加强热,将产生的气体收集点燃,火焰上方罩有干冷小烧杯 | 有蓝色火焰,小烧杯中有小液滴 | 煤粉生成可燃性气体一定是氢气 |
C | 向2mL | 滴加 | 不能说明反应后不存在 |
D | 将收集满甲烷和氯气混合气的试管倒扣在盛满水的水槽中,久置光照 | 试管内液面上升 | 甲烷和氯气发生取代反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
2 . 氯酸钾为无色或白色晶体,是一种强氧化剂。某化学小组制取氯酸钾并进行有关探究实验。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:
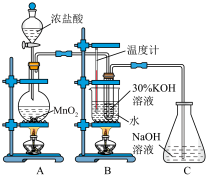
(1)装置A中盛装浓盐酸的仪器名称是___________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为___________ (填化学式)。已知氯酸钾和氯化钾的溶解度曲线如图所示,反应结束后,从装置B所得溶液中提取氯酸钾晶体的实验操作是蒸发浓缩、___________ 、洗涤、干燥。
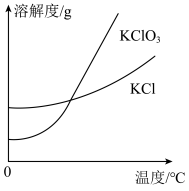
II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
①3号试管实验中x的值为___________ ;1号试管实验的作用是___________ 。
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为___________ 。
③由该系列实验可得出的结论是___________ 。
I.制取氯酸钾
利用如图所示的实验装置进行实验。回答下列问题:

(1)装置A中盛装浓盐酸的仪器名称是
(2)装置A中发生反应的离子方程式为
(3)氯气和氢氧化钾溶液在加热的条件下可制得氯酸钾,若装置B中加热温度过低,所得主要氧化产物为

II.探究氯酸钾与碘化钾的反应
(4)在不同条件下KClO3可将KI氧化为I2或KIO3.室温下,该小组设计了系列实验研究硫酸浓度对反应产物的影响,实验记录如下表:
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol·L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol·L-1H2SO4/mL | 0 | 3.0 | x | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 5.0 | 0 |
| 取少量反应后溶液滴加淀粉溶液 | 无现象 | 变蓝 | 变蓝 | 无现象 |
②假设氧化产物唯一,还原产物为KCl,2号试管中主要反应的离子方程式为
③由该系列实验可得出的结论是
您最近一年使用:0次
2023-11-13更新
|
431次组卷
|
2卷引用:黑龙江省肇东市第四中学校2023-2024学年高三上学期第二次月考化学试卷
名校
解题方法
3 . 某研究性小组同学带领兴趣小组的同学完成了下列任务。
任务一:探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2装置的优点是:①能更好的吸收有毒气体SO2,防止其污染环境;②___________ 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是___________ 。
(3)能说明图2有SO2气体产生的实验现象是___________ 。
(4)反应一段时间后,用滴管吸取(图2)A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有三种可能:I:只含有Fe3+;II:只含有Fe2+;III:既有Fe3+又有Fe2+。为验证III的可能性,选用如下试剂,填写下列空格:
A.稀H2SO4 B.NaOH溶液 C.KSCN溶液 D.KMnO4溶液 E.氯水。
取试样,滴加少量的___________ (填试剂序号),经观察现象可确定含有Fe3+;再取适量的试样滴加少量的___________ (填试剂序号),观察现象则可确定含有Fe2+。
任务二:测定空气中SO2的含量
(5)某课外小组的同学将空气样品经过管道通入密闭容器中的300mL0.100mo/L的酸性KMnO4溶液。写出SO2与该溶液反应的离子方程式为:___________ 。若管道中空气流量为aL/min,经过bmin溶液恰好褪色,假定样品中的SO2可被溶液充分吸收,则该空气样品中SO2的含量是___________ g/L。
任务一:探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。

(1)比较两实验装置,图2装置的优点是:①能更好的吸收有毒气体SO2,防止其污染环境;②
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而防止污染环境;二是
(3)能说明图2有SO2气体产生的实验现象是
(4)反应一段时间后,用滴管吸取(图2)A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有三种可能:I:只含有Fe3+;II:只含有Fe2+;III:既有Fe3+又有Fe2+。为验证III的可能性,选用如下试剂,填写下列空格:
A.稀H2SO4 B.NaOH溶液 C.KSCN溶液 D.KMnO4溶液 E.氯水。
取试样,滴加少量的
任务二:测定空气中SO2的含量
(5)某课外小组的同学将空气样品经过管道通入密闭容器中的300mL0.100mo/L的酸性KMnO4溶液。写出SO2与该溶液反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
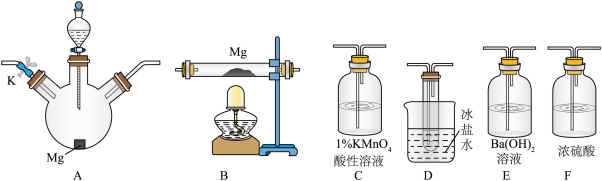
4 . 较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到 、
、 、
、 三种气体。某同学欲用下列仪器组装装置来直接验证有
三种气体。某同学欲用下列仪器组装装置来直接验证有 、
、 生成并制取氮化镁。(假设实验中每步转化均是完全的)
生成并制取氮化镁。(假设实验中每步转化均是完全的)
已知:① 沸点是21.1℃、熔点是
沸点是21.1℃、熔点是 ℃;
℃; 的沸点是
的沸点是 ℃、熔点是
℃、熔点是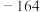 ℃;
℃;
②氮化镁遇水会发生水解。
回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是_________ (填序号)
a.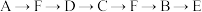 b.
b.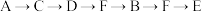
c.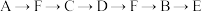 d.
d.
(2)实验中两次使用装置 ,第二次使用装置
,第二次使用装置 的作用是
的作用是_________ 。
(3)实验前需先打开开关 ,向装置内通
,向装置内通 气体,其目的是
气体,其目的是_________ ,当_________ 时停止通入 。
。
(4)实验过程中,发现在 中产生预期现象的同时,
中产生预期现象的同时, 中溶液颜色慢慢褪去,试写出
中溶液颜色慢慢褪去,试写出 中反应的离子方程式
中反应的离子方程式_________ 。
 、
、 、
、 三种气体。某同学欲用下列仪器组装装置来直接验证有
三种气体。某同学欲用下列仪器组装装置来直接验证有 、
、 生成并制取氮化镁。(假设实验中每步转化均是完全的)
生成并制取氮化镁。(假设实验中每步转化均是完全的)
已知:①
 沸点是21.1℃、熔点是
沸点是21.1℃、熔点是 ℃;
℃; 的沸点是
的沸点是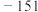 ℃、熔点是
℃、熔点是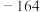 ℃;
℃;②氮化镁遇水会发生水解。
回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是
a.
 b.
b.
c.
 d.
d.
(2)实验中两次使用装置
 ,第二次使用装置
,第二次使用装置 的作用是
的作用是(3)实验前需先打开开关
 ,向装置内通
,向装置内通 气体,其目的是
气体,其目的是 。
。(4)实验过程中,发现在
 中产生预期现象的同时,
中产生预期现象的同时, 中溶液颜色慢慢褪去,试写出
中溶液颜色慢慢褪去,试写出 中反应的离子方程式
中反应的离子方程式
您最近一年使用:0次
5 . 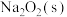 是一种重要的化学原料,有着重要的用途,可与
是一种重要的化学原料,有着重要的用途,可与 、
、 、
、 、
、 等多种物质反应。回答下列问题:
等多种物质反应。回答下列问题:
(1)将 、
、 、
、 放入一个真空密闭容器中,在150℃下用电火花不断引燃反应,恰好完全反应,生成物之一为
放入一个真空密闭容器中,在150℃下用电火花不断引燃反应,恰好完全反应,生成物之一为 ,压强为零,则
,压强为零,则 、
、 、
、 的物质的量之比为
的物质的量之比为_______ 。
(2)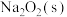 与
与 之间也能进行反应,某科研小组对其反应产物进行了探究分析。
之间也能进行反应,某科研小组对其反应产物进行了探究分析。
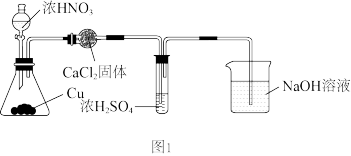
第1步:用如图1所示装置制取 ,用98.3%浓硫酸吸收(
,用98.3%浓硫酸吸收( 可溶于浓硫酸,加热后又会逸出),得到无色吸收液。
可溶于浓硫酸,加热后又会逸出),得到无色吸收液。
第2步:用如图2所示装置加热浓硫酸吸收液,使 挥发,通入盛有
挥发,通入盛有 的试管中,至固体颜色不变后,再通入
的试管中,至固体颜色不变后,再通入 ,气体2min。
,气体2min。

第3步:称取图2中反应后的固体0.5g,加水溶解,配制100mL待测溶液。
①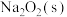 与
与 可能发生反应的化学方程式为
可能发生反应的化学方程式为 、
、_______ 。
②上述“第3步”中配制100mL待测溶液,需要的玻璃仪器有烧杯、玻璃棒、_______ (填1种)。
③图1、图2中的NaOH溶液用于尾气处理,则反应中氧化产物与还原产物的物质的量之比为_______ 。
(3)某科研兴趣小组运用数字化实验对 、
、 的反应过程进行探究(如图3所示)。
的反应过程进行探究(如图3所示)。
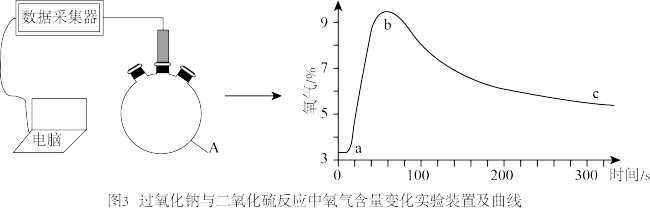
步骤如下:
Ⅰ.将计算机、数据采集器、氧气传感器依次相连。
Ⅱ.用无水 与浓
与浓 (70%)反应制取并用仪器A收集
(70%)反应制取并用仪器A收集 气体。
气体。
Ⅲ.将氧气传感器塞入仪器A中间接口,进行数据采集,用药匙取少量 从仪器A右端加入,迅速塞紧瓶塞。
从仪器A右端加入,迅速塞紧瓶塞。
①仪器A的名称为_______ 。
②ab段氧气的含量迅速升高,对应的化学方程式为_______ ,该反应是_______ (填“吸热”或“放热”)反应。
③bc段氧气的含量慢慢降低,可能发生反应的化学方程式为_______ 。
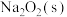 是一种重要的化学原料,有着重要的用途,可与
是一种重要的化学原料,有着重要的用途,可与 、
、 、
、 、
、 等多种物质反应。回答下列问题:
等多种物质反应。回答下列问题:(1)将
 、
、 、
、 放入一个真空密闭容器中,在150℃下用电火花不断引燃反应,恰好完全反应,生成物之一为
放入一个真空密闭容器中,在150℃下用电火花不断引燃反应,恰好完全反应,生成物之一为 ,压强为零,则
,压强为零,则 、
、 、
、 的物质的量之比为
的物质的量之比为(2)
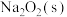 与
与 之间也能进行反应,某科研小组对其反应产物进行了探究分析。
之间也能进行反应,某科研小组对其反应产物进行了探究分析。第1步:用如图1所示装置制取
 ,用98.3%浓硫酸吸收(
,用98.3%浓硫酸吸收( 可溶于浓硫酸,加热后又会逸出),得到无色吸收液。
可溶于浓硫酸,加热后又会逸出),得到无色吸收液。
第2步:用如图2所示装置加热浓硫酸吸收液,使
 挥发,通入盛有
挥发,通入盛有 的试管中,至固体颜色不变后,再通入
的试管中,至固体颜色不变后,再通入 ,气体2min。
,气体2min。
第3步:称取图2中反应后的固体0.5g,加水溶解,配制100mL待测溶液。
①
 与
与 可能发生反应的化学方程式为
可能发生反应的化学方程式为 、
、②上述“第3步”中配制100mL待测溶液,需要的玻璃仪器有烧杯、玻璃棒、
③图1、图2中的NaOH溶液用于尾气处理,则反应中氧化产物与还原产物的物质的量之比为
(3)某科研兴趣小组运用数字化实验对
 、
、 的反应过程进行探究(如图3所示)。
的反应过程进行探究(如图3所示)。
步骤如下:
Ⅰ.将计算机、数据采集器、氧气传感器依次相连。
Ⅱ.用无水
 与浓
与浓 (70%)反应制取并用仪器A收集
(70%)反应制取并用仪器A收集 气体。
气体。Ⅲ.将氧气传感器塞入仪器A中间接口,进行数据采集,用药匙取少量
 从仪器A右端加入,迅速塞紧瓶塞。
从仪器A右端加入,迅速塞紧瓶塞。①仪器A的名称为
②ab段氧气的含量迅速升高,对应的化学方程式为
③bc段氧气的含量慢慢降低,可能发生反应的化学方程式为
您最近一年使用:0次
2022-09-29更新
|
1148次组卷
|
6卷引用:黑龙江省齐齐哈尔市地区普高联谊校2023-2024学年高三上学期9月月考化学试题
黑龙江省齐齐哈尔市地区普高联谊校2023-2024学年高三上学期9月月考化学试题河南省豫北名校普高联考2022-2023学年上学期高三测评(一)化学试题河南省重点高中2023届高三上学期9月联合考试化学试题(已下线)热点情景汇编-专题十三 实验探究中的新思路(已下线)化学(重庆B卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)第4讲 钠及其重要化合物
名校
解题方法
6 . 绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
①仪器B的名称是_______ 。
②将下列实验操作步骤正确排序_______ (填标号);重复上述操作步骤,直至A质量几乎不变,记为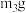 。
。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭 和
和
d.打开 和
和 ,缓缓通入
,缓缓通入 e.称量A f.冷却至室温
e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=_______ (列式表示)。若实验时按a、d次序操作,则使x_______ (填“偏大”“偏小”或“无影响”)。
(2)为探究硫酸亚铁的分解产物,将(2)中已质量几乎不变的装置A接入下图所示的装置中,打开 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红棕色粉末。
,加热。实验后反应管中残留固体为红棕色粉末。
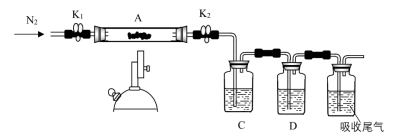
①C、D中的溶液依次为_______ (填标号)。
a.品红 b.NaOH c. d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式_______ 。
(3)有同学认为本实验中生成的 和氯水都有漂白性,二者混合后的漂白性会增强,他将
和氯水都有漂白性,二者混合后的漂白性会增强,他将 和
和 按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:
按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:_______ (用离子方程式表示)。
(4)探究 的酸性强于HClO(可能需要的装置和试剂如图所示)。
的酸性强于HClO(可能需要的装置和试剂如图所示)。
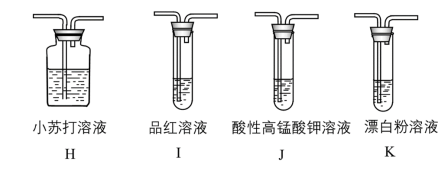
所需装置的连接顺序为:纯净的 →
→_______ (填装置字母代号)。能证明 的酸性强于HClO的实验现象是
的酸性强于HClO的实验现象是_______ 。
(1)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关
 和
和 )(设为装置A)称重,记为
)(设为装置A)称重,记为 。将样品装入石英玻璃管中,再次将装置A称重,记为
。将样品装入石英玻璃管中,再次将装置A称重,记为 。按下图连接好装置进行实验。
。按下图连接好装置进行实验。
①仪器B的名称是
②将下列实验操作步骤正确排序
 。
。a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭
 和
和
d.打开
 和
和 ,缓缓通入
,缓缓通入 e.称量A f.冷却至室温
e.称量A f.冷却至室温③根据实验记录,计算绿矾化学式中结晶水数目x=
(2)为探究硫酸亚铁的分解产物,将(2)中已质量几乎不变的装置A接入下图所示的装置中,打开
 和
和 ,缓缓通入
,缓缓通入 ,加热。实验后反应管中残留固体为红棕色粉末。
,加热。实验后反应管中残留固体为红棕色粉末。
①C、D中的溶液依次为
a.品红 b.NaOH c.
 d.
d. e.浓
e.浓
②写出硫酸亚铁高温分解反应的化学方程式
(3)有同学认为本实验中生成的
 和氯水都有漂白性,二者混合后的漂白性会增强,他将
和氯水都有漂白性,二者混合后的漂白性会增强,他将 和
和 按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:
按同温同压下体积比1:1同时通入到品红溶液中,结果发现品红溶液未褪色,请分析原因:(4)探究
 的酸性强于HClO(可能需要的装置和试剂如图所示)。
的酸性强于HClO(可能需要的装置和试剂如图所示)。
所需装置的连接顺序为:纯净的
 →
→ 的酸性强于HClO的实验现象是
的酸性强于HClO的实验现象是
您最近一年使用:0次
2022-04-11更新
|
545次组卷
|
3卷引用:哈尔滨市第九中学校2021-2022学年高一下学期4月阶段性验收考试化学试题
7 . 某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为_______ 。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式:_______ ,_______
(3)装置中空试管的作用是_______ 。
(4)实验中,观察到紫色石蕊溶液颜色的变化为_______ 。
(5)烧杯中氢氧化钠溶液的作用是(用离子方程式表示)_______

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中发生反应的化学方程式:
(3)装置中空试管的作用是
(4)实验中,观察到紫色石蕊溶液颜色的变化为
(5)烧杯中氢氧化钠溶液的作用是(用离子方程式表示)
您最近一年使用:0次
2022-04-04更新
|
232次组卷
|
2卷引用:黑龙江省鸡西市第一中学2021-2022学年高一上学期期中考试化学试题
名校
解题方法
8 . 某实验小组利用下图装置模拟古法硫酸生产方法并进行SO2性质探究。

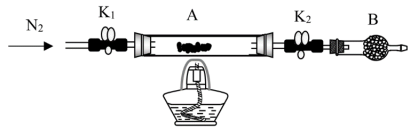
已知A中反应的化学方程式:2FeSO4·7H2O Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
完成下列填空:
(1)C装置中覆盖食用油的目的是___________ ;D装置的作用___________ 。B中所得硫酸溶液的质量分数理论值为___________ (保留三位小数)。
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
得到如下pH-t图:
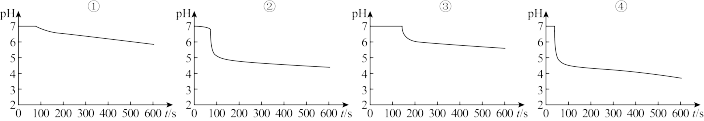
(2)曲线①呈缓慢下降趋势,这是因为___________ 。曲线②出现骤降,表明溶液中生成了___________ (填物质名称)。对比分析上述四组数据,可得出的结论是_________ (任写2条)。
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为_______ 。若该实验数据较实际值偏大,则可能的原因是________ (选填编号)。
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面

已知A中反应的化学方程式:2FeSO4·7H2O
 Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。
Fe2O3+SO2↑+SO3↑+14H2O,实验开始前打开活塞K1、K2,关闭活塞K3,通入一段时间N2后,关闭活塞K1、K2,打开活塞K3,高温加热绿矾。完成下列填空:
(1)C装置中覆盖食用油的目的是
为探究SO2与钡盐溶液的反应,在装置C中先后四次加入不同的溶液:
| ① | ② | ③ | ④ |
| 已煮沸的BaCl2溶液 | 未煮沸的BaCl2溶液 | 已煮沸的Ba(NO3)2溶液 | 未煮沸的Ba(NO3)2溶液 |
| 注:锥形瓶中溶液体积相同,钡盐溶液浓度相同;油层厚度一致,通入SO2流速一致。 | |||

(2)曲线①呈缓慢下降趋势,这是因为
(3)为对排气法收集到的SO2气体进行含量测定,将2240mL气体(已折算为标准状况)通入足量的Ba(NO3)2溶液中,经过滤、洗涤、烘干,最终得到沉淀21.436g。则SO2气体的体积分数为
a.气体通入速率过快 b.沉淀未进行恒重操作
c.收集的气体中有CO2 d.未用食用油覆盖液面
您最近一年使用:0次
2022-01-15更新
|
1076次组卷
|
3卷引用:黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题
黑龙江省哈尔滨市第九中学校2022届高考最后押题卷(一)化学试题上海市浦东新区2022届高三一模化学试题(已下线)专项14 化学实验综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
名校
9 . 取某固体样品,进行如下实验:
①取一定量的样品,加足量水充分溶解,过滤得到白色滤渣和无色溶液
②取白色滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生
③取①中无色溶液,通入适量 ,产生白色沉淀
,产生白色沉淀
根据上述实验现象,该固体样品的成分可能是
①取一定量的样品,加足量水充分溶解,过滤得到白色滤渣和无色溶液
②取白色滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生
③取①中无色溶液,通入适量
 ,产生白色沉淀
,产生白色沉淀根据上述实验现象,该固体样品的成分可能是
A. 、 、 、KOH 、KOH | B. 、 、 、NaCl 、NaCl |
C. 、 、 、NaOH 、NaOH | D. 、 、 、NaOH 、NaOH |
您最近一年使用:0次
2022-01-15更新
|
1132次组卷
|
8卷引用:黑龙江省双鸭山市第一中学2022-2023学年高一10月月考化学试题
10 . 某校化学实验小组为了证明铜与稀硝酸反应产生一氧化氮,用如图所示装置进行实验(加热装置和夹持装置均已略去,装置气密性良好,F是用于鼓入空气的双连打气球)。
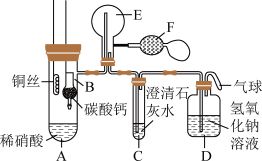
实验操作及现象:
试回答下列问题:
(1)操作I中产生气体的化学式为_______ 。操作I的目的是_______ 。D装置的作用是_______ 。
(2)C装置中白色沉淀的化学式是_______ 。操作II中当C装置中产生白色沉淀时立刻将B装置上提的原因是_______ 。
(3)操作III中A装置中产生无色气体的化学方程式是_______ 。
(4)E装置内气体颜色逐渐加深的原因是_______ 。
(5)操作V现象产生的原因是(用两个化学方程式说明)_______ ,_______ 。

实验操作及现象:
| 实验操作 | 现象 |
| I.将B装置下移,使碳酸钙与稀硝酸接触 | 产生气体 |
| II.当C装置中产生白色沉淀时,立刻将B装置上提 | |
| III.将A装置中铜丝放入稀硝酸中,给A装置微微加热 | A装置中产生无色气体,E装置中开始时出现浅红棕色气体 |
| IV.用F装置向E装置中鼓入空气 | E装置中气体颜色逐渐加深 |
| V.一段时间后 | C装置中白色沉淀溶解 |
(1)操作I中产生气体的化学式为
(2)C装置中白色沉淀的化学式是
(3)操作III中A装置中产生无色气体的化学方程式是
(4)E装置内气体颜色逐渐加深的原因是
(5)操作V现象产生的原因是(用两个化学方程式说明)
您最近一年使用:0次
2021-09-29更新
|
1732次组卷
|
14卷引用:黑龙江省富锦市第一中学2022-2023学年高一下学期第二次考试化学试题
黑龙江省富锦市第一中学2022-2023学年高一下学期第二次考试化学试题广东省广州市仲元中学2020-2021学年高一下学期期中考试化学试题(已下线)章末培优 第5章 化工生产中的重要非金属元素-2021-2022学年高一化学课后培优练(人教版2019必修第二册)广东省揭阳市普宁市华侨中学2021—2022学年高一下学期第一次月考化学科试题安徽省宣城市七校2021-2022学年高一下学期期中联考化学试卷广东省揭阳市惠来县第一中学2021-2022学年高一下学期第一次阶段考试化学试题(已下线)第04练 常见气体的制备与性质实验-2022年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)第02练 氮及其化合物-2022年【暑假分层作业】高一化学(人教版2019必修第二册)吉林省长春市第二实验中学2022-2023学年高一下学期4月月考化学试题第五章 化工生产中的重要非金属元素(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第02练 氮及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)广东省兴宁市沐彬中学2021-2022学年高一下学期期中段考化学试题山东省聊城市第二中学2023-2024学年高二上学期开学考试化学试题(已下线)第五章 化工生产中的重要非金属元素【单元测试B卷】


 溶液中滴加2滴
溶液中滴加2滴 KSCN溶液,再滴加5滴5%的
KSCN溶液,再滴加5滴5%的 溶液
溶液


