名校
解题方法
1 . I.某化学自主实验小组利用如图所示装置探究 能否被
能否被 还原
还原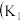 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。________ 。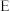 装置发生的化学反应方程式为
装置发生的化学反应方程式为_________ 。
(2)甲、乙分别是___________  填标号
填标号 。
。
a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:___________ 。
(4)此实验装置存在一个明显的缺陷是___________ 。
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下: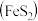 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:___________ 。
(6)写出催化反应室中SO2被氧化为SO3的化学方程式___________ 。
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用___________ 吸收。
 能否被
能否被 还原
还原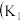 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。
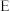 装置发生的化学反应方程式为
装置发生的化学反应方程式为(2)甲、乙分别是
 填标号
填标号 。
。a.硫酸、浓硫酸 b.碱石灰、无水氯化钙 c.碱石灰、碱石灰 d.五氧化二磷、五氧化二磷
(3)若
 能够被
能够被 还原,写出发生反应的化学方程式:
还原,写出发生反应的化学方程式:(4)此实验装置存在一个明显的缺陷是
II.硫酸可用于生产化肥、农药、炸药、染料和盐类等。工业生产硫酸的流程图如下:
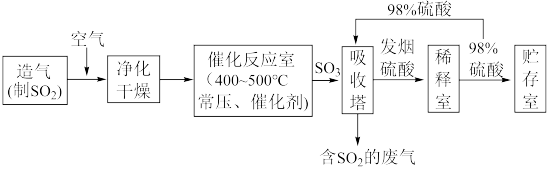
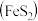 为原料来制备SO2,将黄铁矿粉碎的原因是:
为原料来制备SO2,将黄铁矿粉碎的原因是:(6)写出催化反应室中SO2被氧化为SO3的化学方程式
(7)硫酸工业的尾气中含有少量SO2,若直接排放会污染空气,并导致硫酸型酸雨,可用
您最近一年使用:0次
2024-02-24更新
|
689次组卷
|
3卷引用:新疆克孜勒苏柯尔克孜自治州第二中学2022-2023学年高一下学期期末考试化学试题
2 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。
ⅱ、浓碱条件下,MnO 可被OH-还原为MnO
可被OH-还原为MnO 。
。
ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
(1)B中试剂是_____ 。
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为_____ 。
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是_____ 。
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO 氧化为MnO
氧化为MnO 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因:_____ ,但通过实验测定溶液的碱性变化很小。
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为_____ ,溶液绿色缓慢加深,原因是MnO2被_____ (填化学式)氧化,可证明实验Ⅲ的悬浊液中氧化剂过量。
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是_____ 。
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:_____ 。
资料:ⅰ、Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、MnO
 (绿色)、MnO
(绿色)、MnO (紫色)。
(紫色)。ⅱ、浓碱条件下,MnO
 可被OH-还原为MnO
可被OH-还原为MnO 。
。ⅲ、Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):
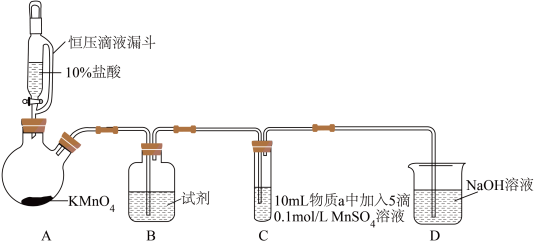
| 实验 | 物质a | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40%NaOH溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(2)通入Cl2前,实验Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
(3)对比实验Ⅰ、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是
(4)根据资料ⅱ,实验Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO
 氧化为MnO
氧化为MnO 。
。①用化学方程式表示可能导致溶液碱性减弱的原因:
②取实验Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③取实验Ⅱ中放置后的1mL悬浊液,加入4mL水,溶液紫色缓慢加深,发生反应的离子方程式是
④从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
2023-11-29更新
|
690次组卷
|
29卷引用:新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题
新疆乌鲁木齐市第101中学2022-2023学年高一上学期12月月考化学试题(已下线)2022年北京市高考真题化学试题(部分试题)(已下线)考点53 化学实验方案设计与评价-备战2023年高考化学一轮复习考点帮(全国通用)四川省成都市树德中学2022-2023学年高三上学期入学考试理综化学试题2022年北京市高考真题化学试题(已下线)第28讲 定性、定量实验(讲)-2023年高考化学一轮复习讲练测(新教材新高考)(已下线)2022年北京高考真题变式题1-14(已下线)易错点09 氯元素及其化合物-备战2023年高考化学考试易错题(已下线)专题三 离子反应-实战高考·二轮复习核心突破突破超重点 高效突破综合实验 实验4 创新探究实验角度1控制变量法探究(已下线)2022年北京高考真题化学试题变式题(实验探究题)(已下线)题型46 实验原理探究型综合实验(已下线)专题19 实验综合题(已下线)专题19 实验综合题(已下线)第18练 化学实验综合题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)考点09 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第11讲 氯气和卤族元素(已下线)专题15 化学实验综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题14 化学实验综合题-2023年高考化学真题题源解密(全国通用)(已下线)考点14 氯及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点48 实验方案设计与评价(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)北京一零一中学2023-2024学年高三上学期11月统练五化学试题(已下线)微专题 物质性质综合实验探究北京市日坛中学2023-2024学年高三上学期10月检测化学试题北京师范大学第二附属中学2023-2024学年高三上学期期中考试化学试题江苏省苏州市工业园区星海实验高级中学2023-2024学年高一上学期12月调研化学试题山东省日照神州天立高级中学高复部2023-2024学年高三上学期12月份阶段性测试化学试题
名校
3 . 某校化学兴趣小组拟探究SO2与Ca(NO3)2溶液的反应。
I.实验一:用如图所示装置制备SO2,然后将SO2,通入Ca( NO3)2溶液中,有白色沉淀M产生。
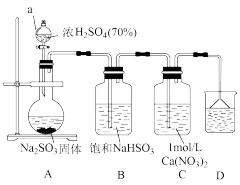
(1)A装置中发生反应的化学方程式为_______ 。仪器a的名称是_______ 。
(2)装置D的作用是_______ 。
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是____ 。
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4,也可能是二者混合物。(查阅资料得知:CaSO4微溶于水; CaSO3难溶于水)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,→b→c→得到沉淀M。取沉淀M少许于试管中,加入过量的HCl充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)操作b, c的名称分别为_______ ,_______ 。
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是_______ 。
实验三:探究 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为_______ 。
(7)从上述实验现象,你认为对SO2氧化起主要作用的是_______ (填 “O2”或“ ”),其理由是
”),其理由是_______ 。
I.实验一:用如图所示装置制备SO2,然后将SO2,通入Ca( NO3)2溶液中,有白色沉淀M产生。

(1)A装置中发生反应的化学方程式为
(2)装置D的作用是
(3)配制1mol·L-1Ca(NO3)2溶液时所用蒸馏水必须除去溶解的氧气,除氧方法是
II.根据所学知识推测:白色沉淀M可能为CaSO3或CaSO4,也可能是二者混合物。(查阅资料得知:CaSO4微溶于水; CaSO3难溶于水)
实验二:探究白色沉淀M的成分。反应后将装置C中物质转移到烧杯中静置,→b→c→得到沉淀M。取沉淀M少许于试管中,加入过量的HCl充分反应,发现沉淀部分溶解。由此可知白色沉淀M含有CaSO3。
(4)操作b, c的名称分别为
(5)取加入过量稀HCl静置后的上层溶液于试管中,加入一种试剂,可进一步证实沉淀M中含有CaSO3,则所加试剂及现象是
实验三:探究
 的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。
的产生途径,将SO2分别缓慢通入物质的量浓度相等的无氧CaCl2溶液、有氧CaCl2溶液、无氧Ca(NO3)2溶液中,一段时间后,测溶液的pH,结果表明:①无氧CaCl2溶液中无沉淀,其他两溶液中均有沉淀;②三种溶液均呈酸性,其中无氧CaCl2溶液酸性最弱,有氧CaCl2溶液酸性最强。(6)有氧CaCl2溶液中通入SO2发生反应的离子方程式为
(7)从上述实验现象,你认为对SO2氧化起主要作用的是
 ”),其理由是
”),其理由是
您最近一年使用:0次
2022-08-17更新
|
646次组卷
|
4卷引用:新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高二上学期开学考试化学试题
新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高二上学期开学考试化学试题重庆市巴蜀中学校2021-2022学年高三下学期适应性月考(八)化学试题(已下线)2022年北京高考真题变式题1-14(已下线)2022年北京高考真题化学试题变式题(实验探究题)
名校
4 . 某研究小组设计如图所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。
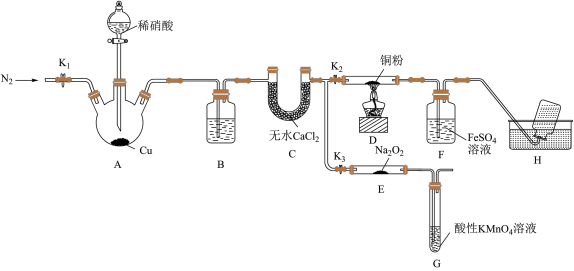
已知:①NO与Na2O2可发生反应2NO+Na2O2 =2NaNO2。
②NO、NO 能被酸性高锰酸钾溶液氧化为
能被酸性高锰酸钾溶液氧化为
③在溶液中存在平衡FeSO4+NO Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是________ 。
(2)装置B中盛放的试剂为水,其作用是________ 。
(3)装置F中的实验现象为______ 。装置H中收集的气体为N2和_______ (填化学式)。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是________ 。
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有NO2和_____ (填化学式)。
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO 可将MnO
可将MnO 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①判断滴定终点的方法________ 。
②样品中NaNO2的质量分数为___________ (用含有a、b的代数式表示)。
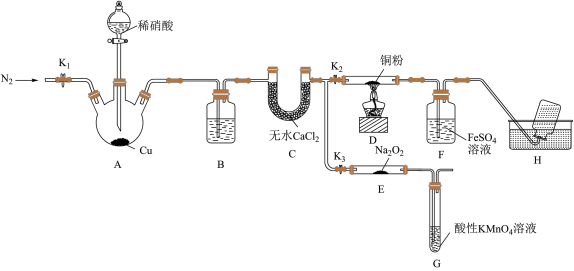
已知:①NO与Na2O2可发生反应2NO+Na2O2 =2NaNO2。
②NO、NO
 能被酸性高锰酸钾溶液氧化为
能被酸性高锰酸钾溶液氧化为
③在溶液中存在平衡FeSO4+NO
 Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是
(2)装置B中盛放的试剂为水,其作用是
(3)装置F中的实验现象为
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有NO2和
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO
 可将MnO
可将MnO 还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。①判断滴定终点的方法
②样品中NaNO2的质量分数为
您最近一年使用:0次
2020-11-04更新
|
690次组卷
|
5卷引用:新疆克拉玛依克拉玛依市独山子第二中学2021-2022学年高三上学期12月月考化学试题
5 . 三硫代碳酸钠(Na2CS3)在农业上用作杀菌剂和杀线虫剂,在工业上用于处理废水中的重金属离子。某化学兴趣小组对Na2CS3的一些性质进行了探究性实验。
实验I.探究Na2CS3的性质:
(1)H2CS3是___ (填“强”或“弱”)酸。
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为___ 。
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点并说明理由:___ 。
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0mol•L-1的稀H2SO4,关闭活塞。
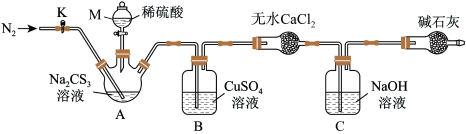
已知:CS32-+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是___ 。反应开始前需要先通入一段时间N2,其作用为___ 。
(5)B中发生反应的离子方程式为___ 。
(6)反应结束后打开活塞K,再缓慢通入一段时间的热N2,其目的是___ 。
(7)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是___ 。若B中生成沉淀的质量为8.4g,则Na2CS3溶液的物质的量浓度是___ 。
实验I.探究Na2CS3的性质:
| 步骤 | 操作及现象 |
| ① | 取少量Na2CS3固体溶于蒸馏水中,配制成溶液并分成两等份 |
| ② | 向其中一份溶液中滴加几滴酚酞试剂,溶液变成红色 |
| ③ | 向另一份溶液中滴加硫酸酸化的KMnO4溶液,紫色褪去 |
(2)已知步骤③中反应的氧化产物是SO42-,则该反应的离子方程式为
(3)某同学取步骤③反应后所得溶液于试管中,滴加足量盐酸和氯化钡溶液,他认为通过测定产生的白色沉淀的质量即可求出实验中所用的Na2CS3的质量。你是否同意他的观点并说明理由:
实验Ⅱ.测定Na2CS3溶液的浓度:
按如图所示装置进行实验:将50.0mLNa2CS3溶液置于三颈烧瓶中,打开仪器M的活塞,滴入足量2.0mol•L-1的稀H2SO4,关闭活塞。

已知:CS32-+2H+=CS2+H2S↑,CS2和H2S均有毒。(CS2不溶于水,沸点为46℃,与CO2的某些性质相似,与NaOH作用生成Na2COS2和H2O)
(4)仪器M的名称是
(5)B中发生反应的离子方程式为
(6)反应结束后打开活塞K,再缓慢通入一段时间的热N2,其目的是
(7)为了计算三硫代碳酸钠溶液的浓度,可通过测定B中生成沉淀的质量来计算。称量B中沉淀质量之前需要进行的实验操作是
您最近一年使用:0次
2020-02-03更新
|
247次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第101中学2022-2023学年高三上学期11月月考化学试题
名校
解题方法
6 . 某校学生课外活动小组的同学设计如图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题:【提示:C+CO2 2CO C+H2O(g)
2CO C+H2O(g) CO+H2】
CO+H2】

(1)写出装置A中所发生反应的离子方程式:____________ 。
(2)装置B中最适宜的试剂是________________ 。
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是________ 。
(4)按照如图装置进行实验时,首先进行的操作是__________ 。
(5)根据实验中的___________ 现象,可证明CO具有还原性,有关反应的化学方程式是:__________ 。
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在图中装置_____ 与________ 之间连接图中的________ 装置(填序号)。
① NaHCO3溶液 ②
NaHCO3溶液 ② 碱石灰 ③
碱石灰 ③ NaOH溶液 ④
NaOH溶液 ④ 浓H2SO4
浓H2SO4
 2CO C+H2O(g)
2CO C+H2O(g) CO+H2】
CO+H2】
(1)写出装置A中所发生反应的离子方程式:
(2)装置B中最适宜的试剂是
(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是
(4)按照如图装置进行实验时,首先进行的操作是
(5)根据实验中的
(6)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在图中装置
①
 NaHCO3溶液 ②
NaHCO3溶液 ② 碱石灰 ③
碱石灰 ③ NaOH溶液 ④
NaOH溶液 ④ 浓H2SO4
浓H2SO4
您最近一年使用:0次
2020-02-01更新
|
97次组卷
|
3卷引用:新疆五家渠市兵团二中金科实验中学2021-2022学年高一下学期开学考试化学试题
名校
7 . 用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
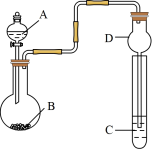
| A.若A为浓盐酸,B为Na2CO3,C中盛有Na2SiO3溶液,则C中溶液出现白色沉淀,证明酸性:H2CO3> H2SiO3 |
| B.若A为浓盐酸,B为KMnO4,C中盛石蕊试液,则C中溶液最终呈红色 |
| C.若A为较浓硫酸,B为Na2SO3固体,C中盛有Na2S溶液,则C中溶液变浑浊 |
| D.装置D起干燥气体作用 |
您最近一年使用:0次
2020-01-18更新
|
4052次组卷
|
16卷引用:新疆沙湾县第一中学2021-2022学年高一下学期期末考试化学试题
新疆沙湾县第一中学2021-2022学年高一下学期期末考试化学试题广东省汕头市金山中学2019-2020学年高一上学期期末考试化学试题【全国百强校】安徽省六安市第一中学2020届高三下学期自测(二)化学试题广东省珠海一中高一化学下学期综合测试试卷(已下线)小题必刷19 硫及其化合物——2021年高考化学一轮复习小题必刷(通用版)甘肃省兰州市第一中学2020-2021学年高一上学期期末考试化学(理)试题甘肃省嘉峪关市第一中学2021届高三上学期三模考试化学试题甘肃省天水市第一中学2021-2022高三上学期第三次考试化学试题辽宁省沈阳市第四十中学2021-2022年高一下学期4月份线上教学效果检测化学试题哈尔滨市第九中学校2021-2022学年高一下学期4月阶段性验收考试化学试题甘肃省靖远县第一中学2021-2022学年高一下学期4月月考化学试题河南省濮阳市元龙高级中学2021-2022学年高一下学期第二次质量检测化学试题湖南长沙麓山国际实验中学2022-2023学年高一上学期期末线上化学试题黑龙江省哈尔滨市第九中学校2021-2022学年高一下学期4月阶段性验收化学试题广东省揭阳市揭西县河婆中学2020-2021学年高一下学期期中质量检测化学试题陕西省商洛市商州区高级中学2023-2024学年高一下学期3月月考化学试题
8 . 为了探究硫酸亚铁的分解产物,进行了如下图装置所示的实验,打开K1和K2,缓缓通入N2,一段时间后加热,实验后反应管中残留固体为红色粉末,BaCl2溶液中有白色沉淀产生,品红溶液中红色褪去,检查氢氧化钠溶液出口处无氧气产生。下列说法错误的是
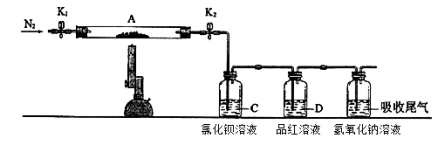
| A.氢氧化钠溶液的作用是吸收多余的SO2气体 |
| B.反应管内产生的红色粉末可能是Fe2O3 |
| C.BaCl2溶液的目的是检验SO3的存在,此处用Ba(NO3)2溶液也可以检验SO3 |
| D.反应管内得到的氧化产物和还原产物物质的量之比为1:1 |
您最近一年使用:0次
2017-12-30更新
|
1273次组卷
|
14卷引用:新疆乌鲁木齐市第八中学2020届高三第一次月考化学试题
新疆乌鲁木齐市第八中学2020届高三第一次月考化学试题山西省河南省2018届高三阶段性测评(四)晋豫省际大联考化学试题河北省定州中学2018届高中毕业班上学期第三次月考化学试题(已下线)二轮复习测试专项-专题11 金属及其化合物【全国百强校】辽宁省沈阳市东北育才学校2019届高三上学期联合考试化学试题河南省汝州市实验中学2019届高三上学期期末模拟化学试题河北省隆化县存瑞中学2020届高三上学期第一次质检化学试题河南省信阳市罗山县高级中学老校区2020届高三第七次模拟考试化学试题湖南省浏阳一中、株洲二中等湘东七校2020届高三12月联考化学试题2020届高考化学二轮题型对题必练—— 物质组成的探究实验题江西省南昌市安义中学2020届高三上学期第五次月考化学试题2020届高三《新题速递·化学》1月第01期(考点07-10)黑龙江省鹤岗市第一中学2021届高三上学期第一次月考(开学考试)化学试题河北省衡水中学2021届高三上学期期中考试化学 试题



