1 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的机化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成。
①写出3种含有不同价态铁元素的物质,并标出铁元素的化合价:__________ 、__________ 、__________ 。
②写出①中所列物质之间相互转化(含三种价态)的化学方程式:_______ 。
(2)利用实验室中提供的试剂:锌粒、铁粉、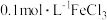 溶液、
溶液、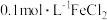 溶液、KSCN溶液、新制氯水,来探究
溶液、KSCN溶液、新制氯水,来探究 、
、 的氧化性、还原性。
的氧化性、还原性。
根据氧化还原反应的原理,小明认为 既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
(1)课前老师布置了下列预习作业,请你一起完成。
①写出3种含有不同价态铁元素的物质,并标出铁元素的化合价:
②写出①中所列物质之间相互转化(含三种价态)的化学方程式:
(2)利用实验室中提供的试剂:锌粒、铁粉、
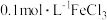 溶液、
溶液、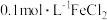 溶液、KSCN溶液、新制氯水,来探究
溶液、KSCN溶液、新制氯水,来探究 、
、 的氧化性、还原性。
的氧化性、还原性。根据氧化还原反应的原理,小明认为
 既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。| 探究内容 | 实验方案 | 实验现象 |
 具有还原性 具有还原性 | 取少量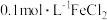 溶液,加入足量 溶液,加入足量 | 溶液变成红色 |
 具有氧化性 具有氧化性 | 取少量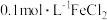 溶液,加入 溶液,加入 | 溶液由浅绿色变成无色,所发生反应的离子方程式为 |
您最近一年使用:0次
名校
解题方法
2 . 为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是( )
| 选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
| A | 在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有氧化性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Zn具有还原性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 棕黄色溶液变成蓝色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe3+具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-08更新
|
687次组卷
|
4卷引用:第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)专题9 本专题达标检测-高中化学必修第二册苏教版2019北京市2019—2020学年高一年级11月月考化学试题广东省汕头市金山中学2019-2020学年高一上学期期末考试化学试题
3 . 某化学小组在学习了 的实验室制法后,发现用加热浓盐酸与
的实验室制法后,发现用加热浓盐酸与 的方法制
的方法制 既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证
既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证 的部分性质,进行了如下探究活动。
的部分性质,进行了如下探究活动。
查阅资料: 和
和 的氧化性均比
的氧化性均比 的氧化性强,在不加热的条件下即可与浓盐酸反应制取
的氧化性强,在不加热的条件下即可与浓盐酸反应制取 。
。
(1)反应原理: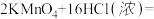
________________________ 。
(2)现有如图所示的装置:
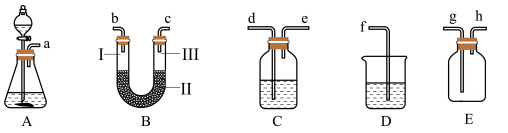
①实验时C中所装液体是______________ ,其作用是______________________ 。
②在制氯气前,必须进行的一项操作是_____________________________ 。
③D中所装液体是_____________________________ 。
④装置B的实验目的是验证氯气是否具有漂白性,因此B中Ⅰ、Ⅱ、Ⅲ处依次放入的物质的组合是________________________ (填序号)。
⑤装置的正确连接顺序为__________________ (用小写字母序号表示)。
 的实验室制法后,发现用加热浓盐酸与
的实验室制法后,发现用加热浓盐酸与 的方法制
的方法制 既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证
既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证 的部分性质,进行了如下探究活动。
的部分性质,进行了如下探究活动。查阅资料:
 和
和 的氧化性均比
的氧化性均比 的氧化性强,在不加热的条件下即可与浓盐酸反应制取
的氧化性强,在不加热的条件下即可与浓盐酸反应制取 。
。(1)反应原理:
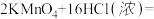
(2)现有如图所示的装置:

①实验时C中所装液体是
②在制氯气前,必须进行的一项操作是
③D中所装液体是
④装置B的实验目的是验证氯气是否具有漂白性,因此B中Ⅰ、Ⅱ、Ⅲ处依次放入的物质的组合是
编号 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
您最近一年使用:0次
2020-10-06更新
|
227次组卷
|
2卷引用:高一必修第一册(苏教2019版)高效手册 专题3 从海水中获得的化学物质
名校
4 . 实验小组探究某补铁口服液中铁元素的价态。
【查阅资料】
KSCN中的硫元素为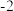 价,易被氧化为
价,易被氧化为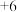 价。
价。
【实验过程】
【分析与解释】
(1)由实验Ⅰ可得出的结论是___________ 。
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是___________ ;小组同学为证实自己的猜想,设计如下对照实验:向1mL 0.1 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到___________ ,证实了小组同学的猜想是正确的。
【查阅资料】
KSCN中的硫元素为
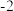 价,易被氧化为
价,易被氧化为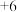 价。
价。【实验过程】
| 编号 | 实验操作 | 实验现象 |
| 实验Ⅰ |  | 无明显变化 |
| 实验Ⅱ |  | 溶液变红 |
(1)由实验Ⅰ可得出的结论是
(2)根据实验Ⅱ中的现象,可以断定该补铁口服液中铁元素的价态为
 价,滴加
价,滴加 溶液后
溶液后 发生反应的离子方程式为
发生反应的离子方程式为(3)一段时间后,发现实验Ⅱ中溶液红色褪去,可能的原因是
 KSCN溶液中加入足量5%
KSCN溶液中加入足量5%  溶液,再加入
溶液,再加入 溶液,观察到
溶液,观察到
您最近一年使用:0次
2021-06-20更新
|
612次组卷
|
5卷引用:第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
(已下线)第三章 铁 金属材料(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)北京市海淀区2020-2021学年高一下学期学业水平合格性考试适应练习化学试题(已下线)周末培优4 金属及其化合物的实验题和工艺流程题-2021-2022学年高一化学课后培优练(人教版2019必修第一册)(已下线)易错专题23 Fe2+和Fe3+的检验与转化-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)北京市第十一中学2021-2022学年高一下学期6月月考化学试题
5 . 氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。
(1)提出问题:
氯水中何种物质能使湿润的红色布条褪色?
(2)收集资料:
①氯气有强氧化性
②氯气与水反应生成盐酸和次氯酸
③次氯酸有强氧化性
(3)提出假设:
①__ ;
②__ ;
③___ ;
④水使红色布条褪色
(4)验证假设:
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:__ ;
实验③:把红色布条放在水里,布条不褪色。
(5)得出的实验结论__ 。
(1)提出问题:
氯水中何种物质能使湿润的红色布条褪色?
(2)收集资料:
①氯气有强氧化性
②氯气与水反应生成盐酸和次氯酸
③次氯酸有强氧化性
(3)提出假设:
①
②
③
④水使红色布条褪色
(4)验证假设:
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:
实验③:把红色布条放在水里,布条不褪色。
(5)得出的实验结论
您最近一年使用:0次
解题方法
6 . 资料显示:“氨气可在纯氧中安静燃烧……”。某校化学兴趣小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验对比。
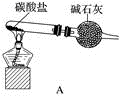

(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是____________________ ;碱石灰的作用是__________________________ 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式__________________ ;试管内气体变为红棕色,该反应的化学方程式是_______________________ 。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因________________________ 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是_____________ ,其理由是______________________ 。
②氨气燃烧的化学方程式是_______________


(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是
②氨气燃烧的化学方程式是
您最近一年使用:0次
2019-01-11更新
|
182次组卷
|
2卷引用:人教版高中化学必修1第四章《非金属及其化合物》测试卷1
解题方法
7 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是:_____________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应和现象是:_________________ 写离子方程式)、溶液由浅绿色变 ___________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选__________ 滴入小明所得的混合液中,并通过溶液出现___________ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:__________________ 。
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成_______ (填微粒符号,下同),若Fe2+在反应中表现出还原性应转化成__________ 。
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:______________ ,相关反应的离子方程式:_______________ 。
(1)实验前小明预测说:Fe2+肯定既有还原性又有氧化性。你认为他预测的依据是:
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的H2O2溶液、锌粒、铜片、0.1mol·L-1FeCl2溶液、KSCN溶液、新制氯水。
①若小明计划在0.1mol·L-1FeCl2溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应和现象是:
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入FeCl2溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为:
(3)小明分析H2O2中氧元素显-1价(中间价),并提出疑问:H2O2与FeCl2的反应时,Fe2+还作氧化剂吗?
①请你为小明梳理相关问题:若Fe2+在反应中表现出氧化性应转化成
②实际上Fe2+的还原性较强,实验室的FeCl2溶液常因氧化而变质。除杂的方法是:
您最近一年使用:0次
2016-12-09更新
|
560次组卷
|
3卷引用:第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)2015-2016学年四川省雅安市天全中学高一上学期12月月考化学试卷陕西省榆林市第十二中学2021届高三上学期第一次月考化学试题
名校
解题方法
8 . 某小组同学欲研究SO2及Na2S2O3的性质。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是_______ 。
(2)利用下图所示的装置研究SO2的性质:(熔点:SO2-76.1℃,SO316.8℃;沸点:SO2-10℃,SO345℃)

①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是_______ 。
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是_______ ;装置III中溶液逐渐褪色,生成Mn2+,则该反应的离子方程式是_______ 。
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL2.5mol•L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式_______ 。
(3)已知Na2S2O3溶液与Cl2反应时,1molNa2S2O3转移8mol电子。该反应的离子方程式是_______ 。甲同学设计如下实验流程探究Na2S2O3的化学性质。
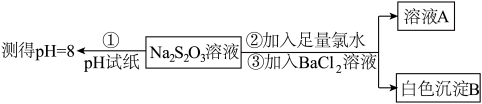
(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和_______ 性。
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是_______ 。
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是_______ (填“甲”或“乙”),理由是_______ 。
(1)将相关的含硫物质分为如下表所示3组,第2组中物质X的化学式是
| 第1组 | 第2组 | 第3组 |
| S(单质) | SO2、X、Na2SO3、NaHSO3 | SO3、H2SO4、Na2SO4、NaHSO4 |

①装置I模拟工业生产中SO2催化氧化的反应,其化学方程式是
②甲同学按I、II、III、IV的顺序连接装置,装置II的作用是
③乙同学按I、II、IV的顺序连接装置,若装置IV中有40mL2.5mol•L-1NaOH溶液,反应后增重4.8g,则装置IV中发生总反应的化学方程式
(3)已知Na2S2O3溶液与Cl2反应时,1molNa2S2O3转移8mol电子。该反应的离子方程式是

(Ⅰ)甲同学设计实验流程的目的是证明Na2S2O3溶液具有碱性和
(Ⅱ)加入BaCl2溶液生成白色沉淀B的离子方程式是
(Ⅲ)乙同学认为应将上述流程中②③所加试剂顺序颠倒,你认为甲、乙两同学的设计更合理的是
您最近一年使用:0次
2023-03-18更新
|
1129次组卷
|
3卷引用:第五章 化工生产中的重要非金属元素 单元测试
9 . 二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作____ 。
(2)某学习小组设计用如下图装置验证二氧化硫的化学性质。
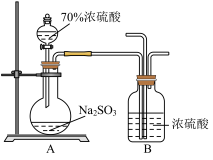

(3)能说明SO2具有氧化性的实验现象为_________________ 。
(4)为验证SO2的还原性,充分反应后,取试管b中溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色退去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________ (填“Ⅰ”“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为__________________ 。
(1)简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作
(2)某学习小组设计用如下图装置验证二氧化硫的化学性质。


(3)能说明SO2具有氧化性的实验现象为
(4)为验证SO2的还原性,充分反应后,取试管b中溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色退去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
您最近一年使用:0次
2020-01-28更新
|
148次组卷
|
2卷引用:鲁教版高中必修1化学第三章《自然界中的元素》测试卷
10 . 有关Na2O2性质实验如下:
②酚酞褪色原因与溶液的强碱性或强氧化性有关。
根据上述实验可以得出的结论是
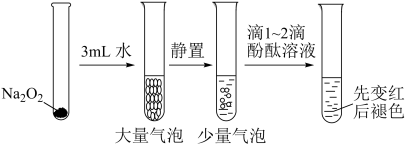
②酚酞褪色原因与溶液的强碱性或强氧化性有关。
根据上述实验可以得出的结论是
| A.双氧水能使酚酞褪色 |
| B.浓氢氧化钠能使酚酞褪色 |
| C.双氧水和浓氢氧化钠都能使酚酞褪色 |
| D.可利用二氧化锰和水来完善实验方案 |
您最近一年使用:0次
2022-06-14更新
|
2189次组卷
|
10卷引用:第二章《海水中的重要元素----钠和氯》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)
(已下线)第二章《海水中的重要元素----钠和氯》能力提升单元检测-【帮课堂】2022-2023学年高一化学同步精品讲义(人教版2019必修第一册)上海市浦东新区2021-2022学年高三下学期教学质量检测化学试题上海市川沙中学2021-2022学年高一下学期期末考试化学试题上海市育才中学2022-2023学年高三上学期10月月考化学试题(已下线)易错点05 钠及其化合物-备战2023年高考化学考试易错题内蒙古乌兰浩特第一中学2022-2023学年高一上学期第三次月考化学试题上海市建平中学2022-2023学年高一下学期期中考试化学试题湖北省十堰市郧阳中学2022-2023学年高一上学期10月月考化学试题河北省石家庄市第二十四中学2023-2024学年高一上学期期中考试化学试题江苏省盐城市亭湖高级中学2023-2024学年高一上学期期末考试化学试题



