名校
1 . 某研究小组为制备 并探究
并探究 溶液的性质,设计并完成了下列实验。
溶液的性质,设计并完成了下列实验。
请回答下列问题:
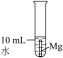
(1)模拟侯氏制碱工艺制备 。
。_______ ,仪器ii的作用为_______ 。
②各仪器接口的连接顺序为_______ 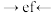
_______ (用字母表示,用→代表气流方向)。
(2)该小组为探究 与
与 溶液能快速反应产生
溶液能快速反应产生 的原因(实验中的镁条均经过打磨)进行了如下实验。
的原因(实验中的镁条均经过打磨)进行了如下实验。
查阅资料:与致密的 相比,
相比,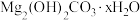 是质地疏松的难溶物。
是质地疏松的难溶物。
①与实验ii相比,实验i观察到镁条表面只有极微量气泡附着的原因为_______ 。
②该小组欲借助肥皂液等检验实验ii中产生的 ,写出相应的实验操作与现象:
,写出相应的实验操作与现象:_______ 。
③实验iii证实 对
对 与水反应起促进作用,试从化学平衡移动角度解释其原因:
与水反应起促进作用,试从化学平衡移动角度解释其原因:_______ 。
(3)查阅资料:水存在自耦电离,方程式为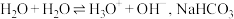 溶液中
溶液中 也存在类似水的电离[已知:常温下
也存在类似水的电离[已知:常温下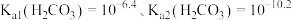 ]。
]。
用 传感器测量常温下不同浓度
传感器测量常温下不同浓度 溶液的
溶液的 ,结果如下表。
,结果如下表。
写出 自耦电离方程式:
自耦电离方程式:_______ ,理论上表格中的
_______ 。
 并探究
并探究 溶液的性质,设计并完成了下列实验。
溶液的性质,设计并完成了下列实验。请回答下列问题:
(1)模拟侯氏制碱工艺制备
 。
。
②各仪器接口的连接顺序为
(2)该小组为探究
 与
与 溶液能快速反应产生
溶液能快速反应产生 的原因(实验中的镁条均经过打磨)进行了如下实验。
的原因(实验中的镁条均经过打磨)进行了如下实验。| 实验组别 | 实验内容 | 实验现象 |
| i |
| 镁条表面有极微量气泡附着 |
| ii |
| 镁条表面持续产生大量气泡(经检验为 ),溶液变浑浊[经检验该浑浊物为 ),溶液变浑浊[经检验该浑浊物为 ] ] |
| iii | 将实验i中的镁条取出,立即加入到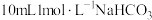 溶液中,很快镁条表面持续产生大量气泡 溶液中,很快镁条表面持续产生大量气泡 | |
 相比,
相比,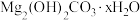 是质地疏松的难溶物。
是质地疏松的难溶物。①与实验ii相比,实验i观察到镁条表面只有极微量气泡附着的原因为
②该小组欲借助肥皂液等检验实验ii中产生的
 ,写出相应的实验操作与现象:
,写出相应的实验操作与现象:③实验iii证实
 对
对 与水反应起促进作用,试从化学平衡移动角度解释其原因:
与水反应起促进作用,试从化学平衡移动角度解释其原因:(3)查阅资料:水存在自耦电离,方程式为
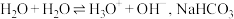 溶液中
溶液中 也存在类似水的电离[已知:常温下
也存在类似水的电离[已知:常温下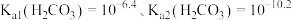 ]。
]。用
 传感器测量常温下不同浓度
传感器测量常温下不同浓度 溶液的
溶液的 ,结果如下表。
,结果如下表。 溶液的浓度/ 溶液的浓度/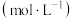 | 1 | 0.5 | 0.1 | 0.01 |
 | a | a | a | a |
 自耦电离方程式:
自耦电离方程式:
您最近一年使用:0次
7日内更新
|
102次组卷
|
5卷引用:四川省泸州市泸县第五中学2024-2025学年高三上学期开学考试化学试题
2 . 高氯酸氟( 或
或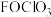 )易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取
)易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取 可采用特制的耐氟容器,使氟气(
可采用特制的耐氟容器,使氟气( )缓缓地与10%的
)缓缓地与10%的 溶液反应,实验装置如图。
溶液反应,实验装置如图。 、HF、
、HF、 的沸点依次为−188℃、19.54℃、−183.9℃;
的沸点依次为−188℃、19.54℃、−183.9℃; 的熔点为−167℃,沸点为−15.9℃。
的熔点为−167℃,沸点为−15.9℃。
Ⅱ.核磁共振碳谱中不同化学环境的碳出现不同的吸收峰。
回答下列问题:
(1) 中F元素的价态是
中F元素的价态是___________ 价,实验中生成 反应的化学方程式是
反应的化学方程式是___________ 。
(2)A中的环状填充物的作用是___________ ;实验中选用液氧分离 ,试分析原因:
,试分析原因:___________ 。
(3) 自身会分解生成
自身会分解生成 、
、 和一种氯的氧化物X,产物中
和一种氯的氧化物X,产物中 与X的化学计量数之比为1∶1,则
与X的化学计量数之比为1∶1,则 自身分解的化学方程式为
自身分解的化学方程式为___________ 。
(4) 可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:
可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:
假设1:产物只有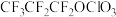 ;
;
假设2:产物只有___________ (填结构简式);
假设3:产物为两者的混合物。
为验证假设1是否成立,可采用的方法是___________ 。若假设1成立,现象是___________ 。
 或
或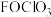 )易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取
)易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取 可采用特制的耐氟容器,使氟气(
可采用特制的耐氟容器,使氟气( )缓缓地与10%的
)缓缓地与10%的 溶液反应,实验装置如图。
溶液反应,实验装置如图。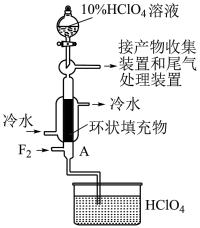
 、HF、
、HF、 的沸点依次为−188℃、19.54℃、−183.9℃;
的沸点依次为−188℃、19.54℃、−183.9℃; 的熔点为−167℃,沸点为−15.9℃。
的熔点为−167℃,沸点为−15.9℃。Ⅱ.核磁共振碳谱中不同化学环境的碳出现不同的吸收峰。
回答下列问题:
(1)
 中F元素的价态是
中F元素的价态是 反应的化学方程式是
反应的化学方程式是(2)A中的环状填充物的作用是
 ,试分析原因:
,试分析原因:(3)
 自身会分解生成
自身会分解生成 、
、 和一种氯的氧化物X,产物中
和一种氯的氧化物X,产物中 与X的化学计量数之比为1∶1,则
与X的化学计量数之比为1∶1,则 自身分解的化学方程式为
自身分解的化学方程式为(4)
 可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:
可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:假设1:产物只有
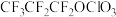 ;
;假设2:产物只有
假设3:产物为两者的混合物。
为验证假设1是否成立,可采用的方法是
您最近一年使用:0次
7日内更新
|
39次组卷
|
3卷引用:四川省雅安中学等部分校2024-2025学年高三上学期开学联考 化学试卷
名校
解题方法
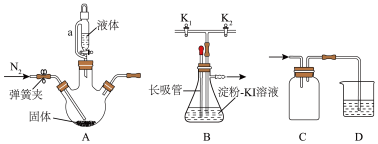
3 . 氧化还原反应在生产中有着广泛的应用,某化学兴趣小组设计实验探究氯气、二氧化硫和碘单质的氧化性强弱,装置(夹持装置省略)如下:
(1)仪器 a 的名称是:___________ ,若 A 装置固体是高锰酸钾,写出 A 中制氯气反应的化学方程式:___________ 。实验完成后,向 A 中持续通氮气的目的是___________ 。
(2)实验时,打开活塞K1 ,通入氯气,证明氯气的氧化性比碘单质强的现象是___________ 。
(3)若 A 装置固体是亚硫酸钠,液体应选用___________ (填选项字母)。
(4)一段时间后,关闭活塞K1,打开K2,通入二氧化硫气体,可观察颜色变化验证碘单质的氧化性比二氧化硫强,写出离子方程式:___________ 。
(5)淀粉―KI 溶液中c(I-) 的测定:取 20.00mL 淀粉―KI 溶液,加入足量的硫酸酸化的双氧水溶液,然后加入少量的二氧化锰粉末除去双氧水,然后用0.1000mol·L-1Na2S2O3标准溶液滴定(反应原理为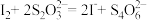 ),准确判断滴定终点的现象是滴入半滴标准溶液时,锥形瓶内
),准确判断滴定终点的现象是滴入半滴标准溶液时,锥形瓶内___________ 。三次测量平均消耗 Na2S2O3 标准溶液 25.00mL,则c(I-)为 ___________ mol·L-1(结果保留四位有效数字)。
(1)仪器 a 的名称是:
(2)实验时,打开活塞K1 ,通入氯气,证明氯气的氧化性比碘单质强的现象是
(3)若 A 装置固体是亚硫酸钠,液体应选用___________ (填选项字母)。
| A.稀盐酸 | B.稀硫酸 | C.98.3%浓硫酸 | D.70%浓硫酸 |
(4)一段时间后,关闭活塞K1,打开K2,通入二氧化硫气体,可观察颜色变化验证碘单质的氧化性比二氧化硫强,写出离子方程式:
(5)淀粉―KI 溶液中c(I-) 的测定:取 20.00mL 淀粉―KI 溶液,加入足量的硫酸酸化的双氧水溶液,然后加入少量的二氧化锰粉末除去双氧水,然后用0.1000mol·L-1Na2S2O3标准溶液滴定(反应原理为
 ),准确判断滴定终点的现象是滴入半滴标准溶液时,锥形瓶内
),准确判断滴定终点的现象是滴入半滴标准溶液时,锥形瓶内
您最近一年使用:0次
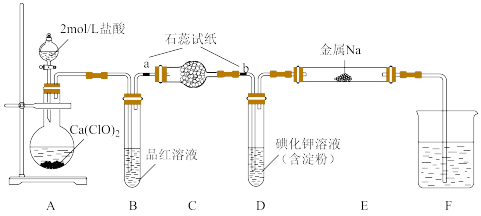
4 . 某研究性小组通过文献梳理,设计出下图装置制备氯气并完成氯气相关性质的验证实验。
回答下列问题:
(1)盛装2mol/L盐酸的仪器名称是_______ ,实验开始前应进行的操作是_______ 。
(2)实验时,A中发生反应的化学方程式为_______ 。实验结束后,加热装置B,通过观察实验现象可说明氯水的漂白性是_______ (填“可逆”或“不可逆”)的。
(3)通氯气后,石蕊试纸a的现象为_______ ,为确保石蕊试纸b得到预期的实验现象,C装置中应填充_______ (填写物质名称)。
(4)可观察到D中的现象是_______ ,发生反应的离子方程式为_______ 。
(5)通氯气后,用酒精灯对硬质玻管E加热,可观察到的实验现象是_______ 。
(6)F的作用是_______ ,可以选用试剂_______ 。
A.Na2S B.NaCl C.NaOH D.H2SO4
回答下列问题:
(1)盛装2mol/L盐酸的仪器名称是
(2)实验时,A中发生反应的化学方程式为
(3)通氯气后,石蕊试纸a的现象为
(4)可观察到D中的现象是
(5)通氯气后,用酒精灯对硬质玻管E加热,可观察到的实验现象是
(6)F的作用是
A.Na2S B.NaCl C.NaOH D.H2SO4
您最近一年使用:0次
名校
解题方法
5 . NO(一种新型生物信使分子)可用于医学临床实验辅助诊断及治疗。某化学研究性学习小组的同学根据理论分析推断出NO具有氧化性,他们设想利用如图所示装置验证NO的氧化性。(已知NO2+OH-→NO +NO
+NO +H2O,夹持及加热装置均已省略)
+H2O,夹持及加热装置均已省略)_______ 。
(2)实验开始前需进行_______ ,具体操作为_______ 。
(3)装置A中反应的离子方程式为_______ 。
(4)装置B的作用是_______ (任写一点);装置C的作用是_______ 。
(5)小组成员甲同学认为NaOH溶液不能吸收NO,你认为需采取的措施是_______ ;分析该措施有效的原因:_______ (用化学方程式表示)。
(6)反应结束后,装置D中固体仍为黑色,证明NO与Fe发生了反应的依据是_______ 。
 +NO
+NO +H2O,夹持及加热装置均已省略)
+H2O,夹持及加热装置均已省略)
(2)实验开始前需进行
(3)装置A中反应的离子方程式为
(4)装置B的作用是
(5)小组成员甲同学认为NaOH溶液不能吸收NO,你认为需采取的措施是
(6)反应结束后,装置D中固体仍为黑色,证明NO与Fe发生了反应的依据是
您最近一年使用:0次
6 . 某化学自主实验小组通过实验探究 、
、 的性质。
的性质。
探究Ⅰ:利用如图所示装置探究 能否被
能否被 还原(
还原( 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。___________ 。
(2)A装置中制取 的化学方程式是
的化学方程式是___________ ,实验室用两种固体混合加热制氨气的方程式是___________ 。
(3)E装置中制取 的离子方程式
的离子方程式___________ 。
(4)若 能够被
能够被 还原,预期C装置中能观察到的现象是
还原,预期C装置中能观察到的现象是___________ 。
探究Ⅱ:用下列装置探究 、
、 混合气体的喷泉实验。
混合气体的喷泉实验。___________ 右___________ (填“高”“低”)
(6)G装置中浓硫酸有三种作用:混合 、
、 气体;干燥
气体;干燥 、
、 ;
;___________ 。
(7)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为___________  (标准状况下,保留两位有效数字)。
(标准状况下,保留两位有效数字)。
 、
、 的性质。
的性质。探究Ⅰ:利用如图所示装置探究
 能否被
能否被 还原(
还原( 、
、 为止水夹,夹持固定装置略去)。
为止水夹,夹持固定装置略去)。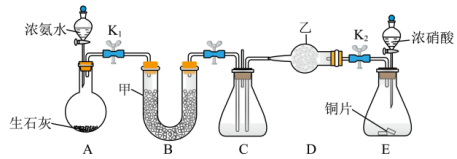
(2)A装置中制取
 的化学方程式是
的化学方程式是(3)E装置中制取
 的离子方程式
的离子方程式(4)若
 能够被
能够被 还原,预期C装置中能观察到的现象是
还原,预期C装置中能观察到的现象是探究Ⅱ:用下列装置探究
 、
、 混合气体的喷泉实验。
混合气体的喷泉实验。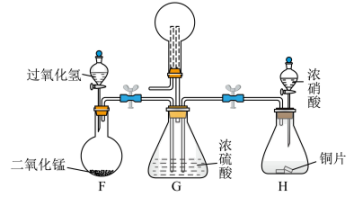
(6)G装置中浓硫酸有三种作用:混合
 、
、 气体;干燥
气体;干燥 、
、 ;
;(7)将G装置上面的圆底烧瓶收集满气体进行喷泉实验,若混合气体全部被吸收,则所得溶液物质的量浓度为
 (标准状况下,保留两位有效数字)。
(标准状况下,保留两位有效数字)。
您最近一年使用:0次
2024-08-26更新
|
69次组卷
|
2卷引用:四川省广安友实学校2023-2024学年高一下学期6月月考化学试题
7 . 某化学学习小组设计实验制取氨气并探究氨气的有关性质:
(1)该小组成员设计实验制备氨气并探究氨气的还原性及产物,提供实验装置如图:___________ 。
②根据上述提供的装置正确的连接顺序为___________ (用各接口序号表示)。
③该装置在设计上有一定的缺陷,你对该装置的改进措施是___________ 。
(2)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式___________ 。
(3)按下图装置进行NH3性质实验。___________ ,写出相关方程式___________ 。稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是___________ 。
(1)该小组成员设计实验制备氨气并探究氨气的还原性及产物,提供实验装置如图:
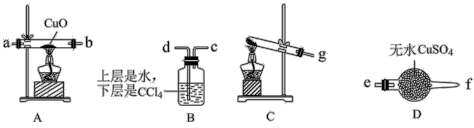
②根据上述提供的装置正确的连接顺序为
③该装置在设计上有一定的缺陷,你对该装置的改进措施是
(2)利用改进后的装置进行实验,观察到CuO全部变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式
(3)按下图装置进行NH3性质实验。
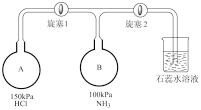
②再打开旋塞2,B瓶中的现象是
您最近一年使用:0次
解题方法
8 . 实验室可用图中装置(略去部分夹持仪器)制取 并验证其性质。
并验证其性质。___________ ,装置A中发生反应的化学方程式为___________ 。
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至___________ ,则整个装置气密性良好。
(3)装置B的作用之一是通过观察产生气泡的多少判断 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择___________ (填序号)。
a.蒸馏水 b.饱和 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和
溶液 d.饱和 溶液
溶液
(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为___________ 。
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案 :向第一份溶液中加入
:向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案 :向第二份溶液中加入
:向第二份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;
方案 :向第三份溶液中加入
:向第三份溶液中加入 溶液,有产生白色沉淀。
溶液,有产生白色沉淀。
上述方案中合理的是___________ 方案(填“ ”“
”“ ”或“
”或“ ”)。
”)。
(6) 中盛装的液体为
中盛装的液体为___________ 溶液,由此可以证明 是
是___________ 氧化物。
 并验证其性质。
并验证其性质。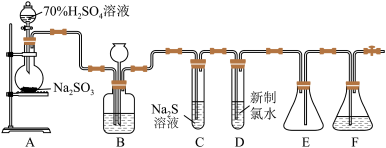
(2)仪器组装完成后,关闭两端活塞,向装置B的长颈漏斗内注入液体至
(3)装置B的作用之一是通过观察产生气泡的多少判断
 生成的快慢,其中的液体最好选择
生成的快慢,其中的液体最好选择a.蒸馏水 b.饱和
 溶液 c.饱和
溶液 c.饱和 溶液 d.饱和
溶液 d.饱和 溶液
溶液(4)C试管中的试剂可以验证二氧化硫的氧化性,现象为
(5)为验证二氧化硫的还原性,充分反应后,取试管D中的溶液分成三份,分别进行实验:
方案
 :向第一份溶液中加入
:向第一份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案
 :向第二份溶液中加入
:向第二份溶液中加入 溶液,有白色沉淀生成;
溶液,有白色沉淀生成;方案
 :向第三份溶液中加入
:向第三份溶液中加入 溶液,有产生白色沉淀。
溶液,有产生白色沉淀。上述方案中合理的是
 ”“
”“ ”或“
”或“ ”)。
”)。(6)
 中盛装的液体为
中盛装的液体为 是
是
您最近一年使用:0次
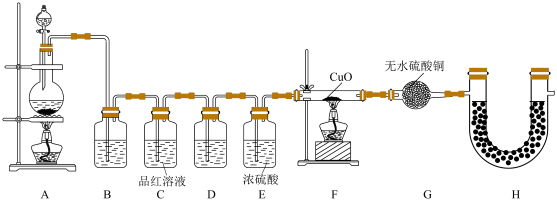
9 .  在生产生活中应用广泛。某化学兴趣小组在实验室设计系列与
在生产生活中应用广泛。某化学兴趣小组在实验室设计系列与 相关实验。
相关实验。
Ⅰ.制备 :小组同学用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制备
:小组同学用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制备 ,发现制得气体不纯,开展如下探究。
,发现制得气体不纯,开展如下探究。
(1)制得的 中可能混有气体杂质
中可能混有气体杂质 和
和__________ (填化学式,不考虑水蒸气)。
(2)小组同学设计了如图所示装置探究气体成分。______________ 。
②装置G的名称为__________ 。
Ⅱ.改进实验后,该小组设计如图装置验证 的化学性质。
的化学性质。 具有氧化性的实验现象为
具有氧化性的实验现象为____________ 。
(4)为验证 的还原性,取试管
的还原性,取试管 中充分反应后的溶液分成三份,分别进行如下实验:
中充分反应后的溶液分成三份,分别进行如下实验:
方案一:向第一份溶液加入品红溶液,红色褪去;
方案二:向第二份溶液加入 溶液,产生白色沉淀;
溶液,产生白色沉淀;
方案三:向第三份溶液中加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
上述方案中合理的是方案__________ 。
Ⅲ.小组欲探究 是否与
是否与 气体反应,设计了下列实验装置图。(已知:石棉绒是一种耐火材料,不参与反应)
气体反应,设计了下列实验装置图。(已知:石棉绒是一种耐火材料,不参与反应)__________ 。
(6)实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的 气体,则镁与
气体,则镁与 除了发生反应:
除了发生反应: ,还可能发生的反应方程式为
,还可能发生的反应方程式为__________ 。
(7)若实验中用一定质量的铜片和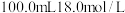 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为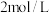 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾__________ 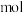 。
。
 在生产生活中应用广泛。某化学兴趣小组在实验室设计系列与
在生产生活中应用广泛。某化学兴趣小组在实验室设计系列与 相关实验。
相关实验。Ⅰ.制备
 :小组同学用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制备
:小组同学用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制备 ,发现制得气体不纯,开展如下探究。
,发现制得气体不纯,开展如下探究。(1)制得的
 中可能混有气体杂质
中可能混有气体杂质 和
和(2)小组同学设计了如图所示装置探究气体成分。
②装置G的名称为
Ⅱ.改进实验后,该小组设计如图装置验证
 的化学性质。
的化学性质。
 具有氧化性的实验现象为
具有氧化性的实验现象为(4)为验证
 的还原性,取试管
的还原性,取试管 中充分反应后的溶液分成三份,分别进行如下实验:
中充分反应后的溶液分成三份,分别进行如下实验:方案一:向第一份溶液加入品红溶液,红色褪去;
方案二:向第二份溶液加入
 溶液,产生白色沉淀;
溶液,产生白色沉淀;方案三:向第三份溶液中加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。上述方案中合理的是方案
Ⅲ.小组欲探究
 是否与
是否与 气体反应,设计了下列实验装置图。(已知:石棉绒是一种耐火材料,不参与反应)
气体反应,设计了下列实验装置图。(已知:石棉绒是一种耐火材料,不参与反应)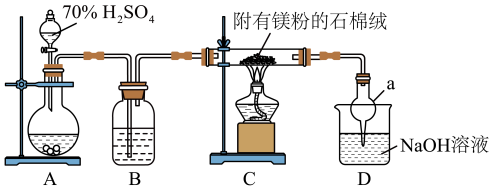
(6)实验完毕后观察到石棉绒上有黄色物质生成,将石棉绒及其附着物投入到稀盐酸中,会产生具有臭鸡蛋气味的
 气体,则镁与
气体,则镁与 除了发生反应:
除了发生反应: ,还可能发生的反应方程式为
,还可能发生的反应方程式为(7)若实验中用一定质量的铜片和
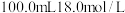 的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为
的浓硫酸在加热条件充分反应,最终铜片与硫酸均有剩余。假定反应前后溶液的体积不变,设剩余硫酸的浓度为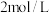 ,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾
,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾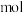 。
。
您最近一年使用:0次
10 . 在古代中国,稀硫酸被称为“绿矾油”。炼丹家孤刚子在其所著《黄帝九鼎神丹经诀》卷九中就记载着“炼石胆取精华法”,即干馏石胆(胆矾)而获得硫酸。
Ⅰ.目前工业上主要采用接触法制备硫酸,其流程如下:___________ ,黄铁矿燃烧的化学反应方程式为___________ 。
Ⅱ.硫酸的性质:某化学兴趣小组为了探究足量铁质材料(碳素钢 )和浓硫酸反应的产物,利用下列装置进行了实验探究活动。___________ ;请写出碳参与反应的化学方程式___________ 。
(3)若观察到___________ 现象时,说明有 气体生成。实验过程中观察到
气体生成。实验过程中观察到___________ 现象时,说明反应产物中还有 生成。
生成。
(4)装置I中碱石灰的作用___________ 。
Ⅰ.目前工业上主要采用接触法制备硫酸,其流程如下:

Ⅱ.硫酸的性质:某化学兴趣小组为了探究足量铁质材料(

(3)若观察到
 气体生成。实验过程中观察到
气体生成。实验过程中观察到 生成。
生成。(4)装置I中碱石灰的作用
您最近一年使用:0次