名校
解题方法
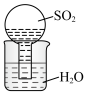
1 . 较活泼金属与硝酸反应,产物复杂。如一定浓度的硝酸与镁反应,可同时得到 、
、 、
、 三种气体。某同学欲用下列仪器组装装置来直接验证有
三种气体。某同学欲用下列仪器组装装置来直接验证有 、
、 生成并制取氮化镁。(假设实验中每步转化均是完全的)
生成并制取氮化镁。(假设实验中每步转化均是完全的)
已知:① 沸点是21.1℃、熔点是
沸点是21.1℃、熔点是 ℃;
℃; 的沸点是
的沸点是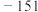 ℃、熔点是
℃、熔点是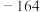 ℃;
℃;
②氮化镁遇水会发生水解。
回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是_________ (填序号)
a.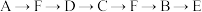 b.
b.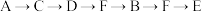
c.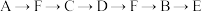 d.
d.
(2)实验中两次使用装置 ,第二次使用装置
,第二次使用装置 的作用是
的作用是_________ 。
(3)实验前需先打开开关 ,向装置内通
,向装置内通 气体,其目的是
气体,其目的是_________ ,当_________ 时停止通入 。
。
(4)实验过程中,发现在 中产生预期现象的同时,
中产生预期现象的同时, 中溶液颜色慢慢褪去,试写出
中溶液颜色慢慢褪去,试写出 中反应的离子方程式
中反应的离子方程式_________ 。
 、
、 、
、 三种气体。某同学欲用下列仪器组装装置来直接验证有
三种气体。某同学欲用下列仪器组装装置来直接验证有 、
、 生成并制取氮化镁。(假设实验中每步转化均是完全的)
生成并制取氮化镁。(假设实验中每步转化均是完全的)
已知:①
 沸点是21.1℃、熔点是
沸点是21.1℃、熔点是 ℃;
℃; 的沸点是
的沸点是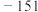 ℃、熔点是
℃、熔点是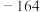 ℃;
℃;②氮化镁遇水会发生水解。
回答下列问题:
(1)为达到上述实验目的,所选用的仪器的正确连接方式是
a.
 b.
b.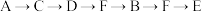
c.
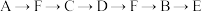 d.
d.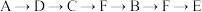
(2)实验中两次使用装置
 ,第二次使用装置
,第二次使用装置 的作用是
的作用是(3)实验前需先打开开关
 ,向装置内通
,向装置内通 气体,其目的是
气体,其目的是 。
。(4)实验过程中,发现在
 中产生预期现象的同时,
中产生预期现象的同时, 中溶液颜色慢慢褪去,试写出
中溶液颜色慢慢褪去,试写出 中反应的离子方程式
中反应的离子方程式
您最近一年使用:0次
名校
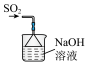
2 . 实验室进行 制备和性质探究,下列实验原理和装置
制备和性质探究,下列实验原理和装置不 能达到实验目的的是
 制备和性质探究,下列实验原理和装置
制备和性质探究,下列实验原理和装置| A | B | C | D |
|
|
|
|
制备 | 探究 溶解性 溶解性 | 探究 氧化性 氧化性 | 吸收尾气 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-12-05更新
|
546次组卷
|
6卷引用:江苏省镇江市2023-2024学年高三上学期期中考试化学试题
江苏省镇江市2023-2024学年高三上学期期中考试化学试题江苏省镇江第一中学2023-2024学年高一上学期12月月考化学试题江苏省徐州华杰高级中学有限公司2023-2024学年高一上学期12月月考化学试题广东省梅州市大埔县虎山中学2023-2024学年高一下学期4月期中考试化学试题山东省淄博第七中学2023-2024学年高一下学期期中学分认定考试化学试题(平行班)(已下线)实验01 探究二氧化硫的性质-【同步实验课】2023-2024学年高一化学教材实验大盘点(人教版2019必修第二册)
名校
3 . 某研究性学习小组利用如图所示的装置制备无水氯化铁。
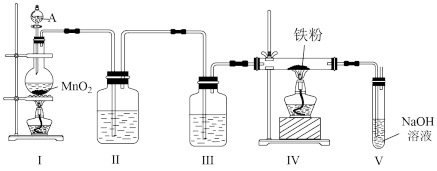
(1)装置Ⅰ中仪器A的名称是_______ ,写出装置Ⅰ中制备氯气的离子方程式_______ 。
(2)装置Ⅱ的作用是_______ 。
(3)写出在装置V中发生的反应的化学方程式_______ 。
(4)实验结束后将装置Ⅳ中的固体加水溶解并过滤,往滤液中滴加KSCN溶液,观察到_______ ,即可证明滤液中含有 。
。
(5)另一组同学发现,在装置Ⅳ和装置Ⅴ之间还需要增加一个装置才能制得无水氯化铁。为了达到这一实验目的,你认为还需在装置Ⅳ和装置Ⅴ之间添加下图中的_______ 装置(填序号)。


(1)装置Ⅰ中仪器A的名称是
(2)装置Ⅱ的作用是
(3)写出在装置V中发生的反应的化学方程式
(4)实验结束后将装置Ⅳ中的固体加水溶解并过滤,往滤液中滴加KSCN溶液,观察到
 。
。(5)另一组同学发现,在装置Ⅳ和装置Ⅴ之间还需要增加一个装置才能制得无水氯化铁。为了达到这一实验目的,你认为还需在装置Ⅳ和装置Ⅴ之间添加下图中的

您最近一年使用:0次
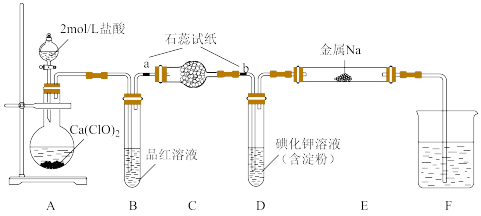
4 . 某研究性小组通过文献梳理,设计出下图装置制备氯气并完成氯气相关性质的验证实验。
回答下列问题:
(1)盛装2mol/L盐酸的仪器名称是_______ ,实验开始前应进行的操作是_______ 。
(2)实验时,A中发生反应的化学方程式为_______ 。实验结束后,加热装置B,通过观察实验现象可说明氯水的漂白性是_______ (填“可逆”或“不可逆”)的。
(3)通氯气后,石蕊试纸a的现象为_______ ,为确保石蕊试纸b得到预期的实验现象,C装置中应填充_______ (填写物质名称)。
(4)可观察到D中的现象是_______ ,发生反应的离子方程式为_______ 。
(5)通氯气后,用酒精灯对硬质玻管E加热,可观察到的实验现象是_______ 。
(6)F的作用是_______ ,可以选用试剂_______ 。
A.Na2S B.NaCl C.NaOH D.H2SO4
回答下列问题:
(1)盛装2mol/L盐酸的仪器名称是
(2)实验时,A中发生反应的化学方程式为
(3)通氯气后,石蕊试纸a的现象为
(4)可观察到D中的现象是
(5)通氯气后,用酒精灯对硬质玻管E加热,可观察到的实验现象是
(6)F的作用是
A.Na2S B.NaCl C.NaOH D.H2SO4
您最近一年使用:0次
5 . 某化学兴趣小组同学利用以下装置制备纯净的、干燥的氯气并对氯气的性质进行探究。___________ 。
(2)仪器A中发生反应的离子方程式为___________ ,根据氯气的性质D中的收集装置可以选择___________ (填序号)。___________ 。
A.E处的紫色石蕊试剂最后变红
B.含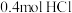 的浓盐酸与足量的
的浓盐酸与足量的 充分反应,反应中转移的电子数小于
充分反应,反应中转移的电子数小于
C.装置F可用于制漂白粉,漂白粉的有效成分为 和
和
(4)当有少量 通过后,观察到装置G中现象为
通过后,观察到装置G中现象为___________ ,用化学方程式表示出现该现象的原因___________ 。实验开始时打开分液漏斗活塞后先点燃A处酒精灯,让氯气充满整个装置,然后再点燃I处酒精灯,目的是___________ 。
(5)I处氯气和碳粉发生反应生成 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(6)将 通入热的烧碱溶液中,可以得到
通入热的烧碱溶液中,可以得到 、
、 和
和 的混合液。当
的混合液。当 和
和 的物质的量之比为
的物质的量之比为 时,
时, 与
与 的物质的量之比为
的物质的量之比为___________ 。
(2)仪器A中发生反应的离子方程式为
A.E处的紫色石蕊试剂最后变红
B.含
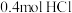 的浓盐酸与足量的
的浓盐酸与足量的 充分反应,反应中转移的电子数小于
充分反应,反应中转移的电子数小于
C.装置F可用于制漂白粉,漂白粉的有效成分为
 和
和
(4)当有少量
 通过后,观察到装置G中现象为
通过后,观察到装置G中现象为(5)I处氯气和碳粉发生反应生成
 和
和 ,写出该反应的化学方程式
,写出该反应的化学方程式(6)将
 通入热的烧碱溶液中,可以得到
通入热的烧碱溶液中,可以得到 、
、 和
和 的混合液。当
的混合液。当 和
和 的物质的量之比为
的物质的量之比为 时,
时, 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
解题方法
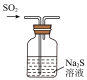
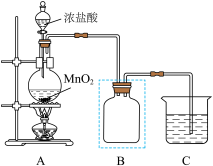
6 . 氯气是一种重要的化工原料,某实验小组的同学为制备并探究氯气的性质,进行了如下实验。回答下列问题:
(1)该小组同学利用如下装置制备
_______ 。
②装置B用于收集 ,请将图中装置B的导气管补充完整
,请将图中装置B的导气管补充完整_______ 。
③欲在 B中收集纯净干燥的 应在装置A与B之间添加除杂装置, 以除去
应在装置A与B之间添加除杂装置, 以除去_______ 。
④装置C中发生反应的离子方程式为_______ 。
(2)该小组同学将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,一段时间后观的现象为_______ 。
(3)该小组同学将( 通入冷的石灰乳中制得漂白粉,写出反应的化学方程式:
通入冷的石灰乳中制得漂白粉,写出反应的化学方程式:_______ 。漂白粉置于空气中易发生反应,写出存白粉的合理建议:_______ 。
(4)目前很多自来水厂用( 来杀菌、消毒,该小组同学欲检验自来水中是否有
来杀菌、消毒,该小组同学欲检验自来水中是否有 残留,需要用到的试剂为
残留,需要用到的试剂为_______ 。
(1)该小组同学利用如下装置制备

②装置B用于收集
 ,请将图中装置B的导气管补充完整
,请将图中装置B的导气管补充完整③欲在 B中收集纯净干燥的
 应在装置A与B之间添加除杂装置, 以除去
应在装置A与B之间添加除杂装置, 以除去④装置C中发生反应的离子方程式为
(2)该小组同学将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片,一段时间后观的现象为
(3)该小组同学将(
 通入冷的石灰乳中制得漂白粉,写出反应的化学方程式:
通入冷的石灰乳中制得漂白粉,写出反应的化学方程式:(4)目前很多自来水厂用(
 来杀菌、消毒,该小组同学欲检验自来水中是否有
来杀菌、消毒,该小组同学欲检验自来水中是否有 残留,需要用到的试剂为
残留,需要用到的试剂为
您最近一年使用:0次
解题方法
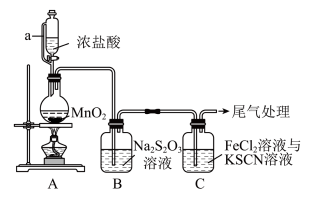
7 . 某同学用如图装置制备Cl2并探究其性质。
i. 是一种较强的还原剂。
是一种较强的还原剂。 在酸性条件下与H+迅速反应生成S和SO2。
在酸性条件下与H+迅速反应生成S和SO2。
ii.Fe3+遇 呈血红色,而Fe2+遇
呈血红色,而Fe2+遇 不变色。
不变色。
(1)装置A中a的作用是_______ 。
(2)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是_______ 。
(3)改进实验装置后,B中 被氧化为
被氧化为 ,写出检验
,写出检验 的操作
的操作_______ 。
(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
某同学对褪色原因提出假设:
假设1:Fe3+被Cl2氧化为更高价态;
假设2: 被Cl2氧化失效。
被Cl2氧化失效。
为进一步探究,该同学取装置C褪色后的溶液少许于试管中,_______ (写出操作及现象)说明假设2成立。
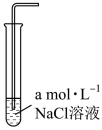
II.为探究NaCl对Cl2溶解性的影响,进行如下实验。
已知Cl2在常温下溶解度为0.092mol/L。测定不同浓度NaCl溶液中的Cl2溶解度,结果如下:
(5)根据数据,NaCl溶液浓度大于_______ mol/L时,增加NaCl溶液浓度对Cl2溶解度变化无明显影响。
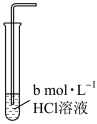
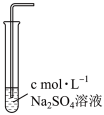
(6)为进一步探究食盐水中哪些微粒能降低Cl2溶解度,可采用控制变量法进行实验探究,过程如下:取三支试管,分别加入一定浓度NaCl溶液、HCl溶液、Na2SO4溶液,通入足量Cl2后,测定Cl2溶解度。
①a=_______ ,b=_______ ,c=_______ 。
②对比实验1和实验2可以得到的结论是_______ 。
③对比实验1和实验3可以得到的结论是_______ 。
④实验结论:食盐水中能够降低Cl2溶解度的主要微粒是_______ 。
i.
 是一种较强的还原剂。
是一种较强的还原剂。 在酸性条件下与H+迅速反应生成S和SO2。
在酸性条件下与H+迅速反应生成S和SO2。ii.Fe3+遇
 呈血红色,而Fe2+遇
呈血红色,而Fe2+遇 不变色。
不变色。(1)装置A中a的作用是
(2)上述装置中存在一处缺陷,会干扰Cl2和Na2S2O3性质的探究,改进的方法是
(3)改进实验装置后,B中
 被氧化为
被氧化为 ,写出检验
,写出检验 的操作
的操作(4)装置C中溶液颜色先变为血红色,一段时间后褪色。
某同学对褪色原因提出假设:
假设1:Fe3+被Cl2氧化为更高价态;
假设2:
 被Cl2氧化失效。
被Cl2氧化失效。为进一步探究,该同学取装置C褪色后的溶液少许于试管中,
II.为探究NaCl对Cl2溶解性的影响,进行如下实验。
已知Cl2在常温下溶解度为0.092mol/L。测定不同浓度NaCl溶液中的Cl2溶解度,结果如下:
| c(NaCl) | 0.50 | 1.00 | 3.00 | 4.00 | 5.00 |
Cl2溶解度/ | 0.0658 | 0.0580 | 0.0416 | 0.0360 | 0.0360 |
(5)根据数据,NaCl溶液浓度大于
(6)为进一步探究食盐水中哪些微粒能降低Cl2溶解度,可采用控制变量法进行实验探究,过程如下:取三支试管,分别加入一定浓度NaCl溶液、HCl溶液、Na2SO4溶液,通入足量Cl2后,测定Cl2溶解度。
| 实验编号 | 1 | 2 | 3 |
| 实验装置 |
|
|
|
Cl2溶解度/ | 0.0580 | 0.0665 | 0.0800 |
②对比实验1和实验2可以得到的结论是
③对比实验1和实验3可以得到的结论是
④实验结论:食盐水中能够降低Cl2溶解度的主要微粒是
您最近一年使用:0次
解题方法
8 . 为了验证在实验室制备 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明
挥发出来,同时证明 的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。
的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。
已知:① 可溶解在
可溶解在 中;
中;
②装置中的试剂均足量。
(1)仪器a的名称为______ 。
(2)实验开始前应先______ 。
(3)装置Ⅰ中发生反应的化学方程式为____________ ,该反应中参与反应的氧化剂与还原剂的物质的量之比为______ 。
(4)装置Ⅲ中浓硫酸的作用为______ 。
(5)实验进行一段时间后,装置Ⅳ和Ⅴ的现象______ (填“相同”或“不相同”),原因为____________ 。
 的过程中有水蒸气和
的过程中有水蒸气和 挥发出来,同时证明
挥发出来,同时证明 的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。
的某些性质,甲同学设计了如图所示的实验装置(夹持装置已略去)。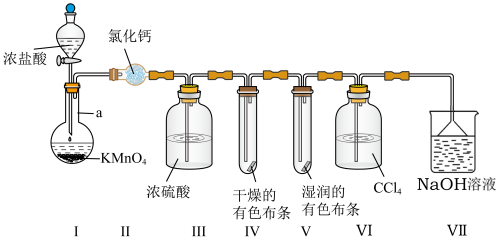
已知:①
 可溶解在
可溶解在 中;
中;②装置中的试剂均足量。
(1)仪器a的名称为
(2)实验开始前应先
(3)装置Ⅰ中发生反应的化学方程式为
(4)装置Ⅲ中浓硫酸的作用为
(5)实验进行一段时间后,装置Ⅳ和Ⅴ的现象
您最近一年使用:0次
9 .  常作有机反应的催化剂。某实验小组拟制备
常作有机反应的催化剂。某实验小组拟制备 并探究其性质。
并探究其性质。
实验(一)制备 。
。
装置如图1所示。已知: 沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。_______ (填“溴水”或“液溴”)。用铁粉替代铁片的目的是_______ 。
(2)装置中利用到的四氯化碳的性质是_______ 。实验完毕后,将烧瓶中混合物经_______ (填实验操作名称)得到 固体。
固体。
实验(二)探究性质。
为了探究的稳定性,进行如图2实验。_______ (填实验现象)时,可以确认 发生分解反应,生成了
发生分解反应,生成了 。
。
(4)实验过程中,先通入一会儿 ,再点燃酒精灯,这样操作的目的是
,再点燃酒精灯,这样操作的目的是_______ 。
(5)为确认玻璃管中残留物有 ,宜选择试剂
,宜选择试剂_______ (填标号)。
a. 溶液 b.酸性
溶液 b.酸性 溶液
溶液
c.KSCN溶液,氯水 d. 溶液
溶液
(6)为了探究浓度对 氧化性的影响,实验操作及现象如下:
氧化性的影响,实验操作及现象如下:
已知: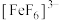 呈无色。
呈无色。
写出实验ⅰ中离子反应方程式:_______ 。
实验ⅱ“不变蓝色”的原因是_______ (结合必要化学用语和文字解释)。
 常作有机反应的催化剂。某实验小组拟制备
常作有机反应的催化剂。某实验小组拟制备 并探究其性质。
并探究其性质。实验(一)制备
 。
。装置如图1所示。已知:
 沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
沸点为58.8℃。实验中,观察到烧瓶中产生红棕色气体。
(2)装置中利用到的四氯化碳的性质是
 固体。
固体。实验(二)探究性质。
为了探究的稳定性,进行如图2实验。
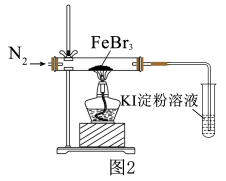
 发生分解反应,生成了
发生分解反应,生成了 。
。(4)实验过程中,先通入一会儿
 ,再点燃酒精灯,这样操作的目的是
,再点燃酒精灯,这样操作的目的是(5)为确认玻璃管中残留物有
 ,宜选择试剂
,宜选择试剂a.
 溶液 b.酸性
溶液 b.酸性 溶液
溶液c.KSCN溶液,氯水 d.
 溶液
溶液(6)为了探究浓度对
 氧化性的影响,实验操作及现象如下:
氧化性的影响,实验操作及现象如下:实验 | 操作 | 现象 |
ⅰ | 向2mL0.1mol 溶液中滴加KI淀粉溶液 溶液中滴加KI淀粉溶液 | 溶液变蓝色 |
ⅱ | 向2mL0.1mol 溶液中先加入适量NaF固体,后滴加KI淀粉溶液 溶液中先加入适量NaF固体,后滴加KI淀粉溶液 | 溶液不变蓝色 |
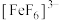 呈无色。
呈无色。写出实验ⅰ中离子反应方程式:
实验ⅱ“不变蓝色”的原因是
您最近一年使用:0次
2024-09-11更新
|
200次组卷
|
2卷引用:湖南省名校联考联合体2025届高三上学期第一次联考(暨入学检测)化学试题
10 . 碱式碳酸铜[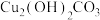 ]俗称铜绿,是一种蓝绿色固体,难溶于水,应用广泛。化学兴趣小组以“碱式碳酸铜的组成、结构、性质、应用和制备”为主题,开展项目式学习。
]俗称铜绿,是一种蓝绿色固体,难溶于水,应用广泛。化学兴趣小组以“碱式碳酸铜的组成、结构、性质、应用和制备”为主题,开展项目式学习。
【任务一】认识铜绿的组成与结构
(1)铜绿的结构如图1所示,其中“ ”表示铜离子,“
”表示铜离子,“ ”,表示碳酸根离子,则“
”,表示碳酸根离子,则“ ”表示
”表示___________ (填微粒名称)。
(2)探究铜绿的性质与转化
①铜绿呈蓝绿色,易被发现和识别,这利用的是铜绿的___________ (选填“物理”或“化学”)性质。
② 。X的化学式为
。X的化学式为___________ 。
③兴趣小组基于“结构决定性质”的学科观念,猜想铜绿能与盐酸反应生成 气体:猜想的依据是铜绿中含有
气体:猜想的依据是铜绿中含有___________ (填离子符号)。
④兴趣小组用图2所示装置进行验证。若猜想正确,能观察到的现象是___________ 。
铜绿是一种农业上常用的杀菌剂,可用硫酸铜和碳酸钠溶液混合加热进行制备:
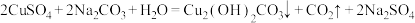 。
。
为了探究适宜反应温度,进行如下三个实验:
【实验分析】
(3)实验2中所用 溶液的体积x为
溶液的体积x为___________ mL。
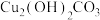 ]俗称铜绿,是一种蓝绿色固体,难溶于水,应用广泛。化学兴趣小组以“碱式碳酸铜的组成、结构、性质、应用和制备”为主题,开展项目式学习。
]俗称铜绿,是一种蓝绿色固体,难溶于水,应用广泛。化学兴趣小组以“碱式碳酸铜的组成、结构、性质、应用和制备”为主题,开展项目式学习。【任务一】认识铜绿的组成与结构
(1)铜绿的结构如图1所示,其中“
 ”表示铜离子,“
”表示铜离子,“ ”,表示碳酸根离子,则“
”,表示碳酸根离子,则“ ”表示
”表示
(2)探究铜绿的性质与转化
①铜绿呈蓝绿色,易被发现和识别,这利用的是铜绿的
②
 。X的化学式为
。X的化学式为③兴趣小组基于“结构决定性质”的学科观念,猜想铜绿能与盐酸反应生成
 气体:猜想的依据是铜绿中含有
气体:猜想的依据是铜绿中含有④兴趣小组用图2所示装置进行验证。若猜想正确,能观察到的现象是

铜绿是一种农业上常用的杀菌剂,可用硫酸铜和碳酸钠溶液混合加热进行制备:
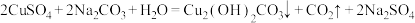 。
。为了探究适宜反应温度,进行如下三个实验:
| 编号 |  溶液体积/mL 溶液体积/mL |  溶液体积/mL 溶液体积/mL | 反应温度℃ | 实验现象 |
| 1 | 2.4 | 2.0 | 20 | 反应速度慢,得到蓝色沉淀 |
| 2 | x | 2.0 | 50 | 反应速度适中,得到蓝绿色沉淀 |
| 3 | 2.4 | 2.0 | 90 | 反应速度快,得到浅蓝色沉淀,逐渐变为黑褐色 |
(3)实验2中所用
 溶液的体积x为
溶液的体积x为
您最近一年使用:0次