1 . 某化学活动小组想通过如图所示装置(夹持装置已略去)进行实验,探究Na2O2与NO反应的产物。
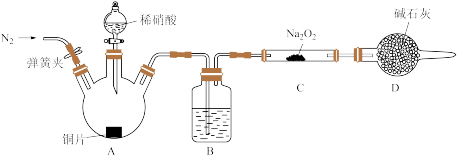
实验前,他们查阅有关资料得到如下信息:
①2NaNO3 2NaNO2+O2↑;
2NaNO2+O2↑;
②NaNO2为白色粉末状固体,既有氧化性又有还原性;
③NaNO2溶液显弱碱性。
请回答下列问题:
(1)实验开始时,打开弹簧夹,通入N2一段时间后,关闭弹簧夹,目的是___ 。装置B中的试剂是___ ,装置D的作用是___ 。
(2)如何检验反应中是否有氧气生成?___ 。
(3)假设Na2O2已反应完全,为确定装置C中固体产物的成分,甲、乙同学分别进行如下实验。
甲同学将固体溶于水后,经测定发现溶液显强碱性,再向溶液中加入酸性KMnO4溶液,紫色褪去。由此现象推断固体产物中可能含有的物质是___ (填化学式)。乙同学取适量固体于试管中密闭加热,发现白色固体部分变为淡黄色。此现象说明固体中还可能含有的成分是___ (填化学式)。根据以上推测,请写出Na2O2与NO反应的化学方程式:__ 。

实验前,他们查阅有关资料得到如下信息:
①2NaNO3
 2NaNO2+O2↑;
2NaNO2+O2↑;②NaNO2为白色粉末状固体,既有氧化性又有还原性;
③NaNO2溶液显弱碱性。
请回答下列问题:
(1)实验开始时,打开弹簧夹,通入N2一段时间后,关闭弹簧夹,目的是
(2)如何检验反应中是否有氧气生成?
(3)假设Na2O2已反应完全,为确定装置C中固体产物的成分,甲、乙同学分别进行如下实验。
甲同学将固体溶于水后,经测定发现溶液显强碱性,再向溶液中加入酸性KMnO4溶液,紫色褪去。由此现象推断固体产物中可能含有的物质是
您最近一年使用:0次
解题方法
2 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
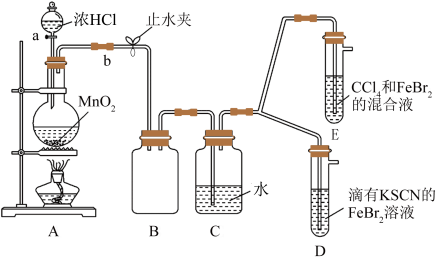
(1)①装置A中发生反应的离子方程式是______________ 。
②整套实验装置存在一处明显的不足,请指出_______________________ 。
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加____________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因_________________________ 。

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
Ⅰ.Fe3++3SCN- Fe(SCN)3是一个可逆反应。 Fe(SCN)3是一个可逆反应。Ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2  (SCN)2。 (SCN)2。Ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点 约5  C,它与水能发生水解反应,且该反应为非氧化还原反应。 C,它与水能发生水解反应,且该反应为非氧化还原反应。Ⅳ.AgClO、AgBrO均可溶于水。 |
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因
您最近一年使用:0次
3 . 某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
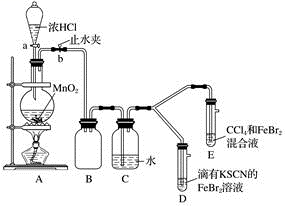
(1)①装置A中发生反应的离子方程式是____________________ 。
②整套实验装置存在一处明显的不足,请指出__________________ 。
(2)用改正后的装置进行实验,实验过程如下:_______ 。
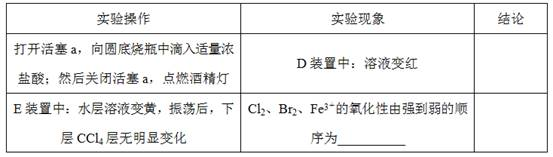
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN- Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。
ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因_______ ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加___________ 溶液,若溶液颜色________ ,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:__________________ 。

(1)①装置A中发生反应的离子方程式是
②整套实验装置存在一处明显的不足,请指出
(2)用改正后的装置进行实验,实验过程如下:

(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
i.Fe3+3SCN-
 Fe(SCN)3是一个可逆反应。
Fe(SCN)3是一个可逆反应。ii.(SCN)2性质与卤素单质类似、氧化性:Cl2>(SCN)2。
iii.Cl2和Br2反应生辰BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
iv.AgClO、AgBrO均可溶于水。
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀的原因:
您最近一年使用:0次
2018-12-24更新
|
254次组卷
|
6卷引用:人教版高中化学必修1第二章《化学物质及其变化》测试卷4
4 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的机化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成。
①写出3种含有不同价态铁元素的物质,并标出铁元素的化合价:__________ 、__________ 、__________ 。
②写出①中所列物质之间相互转化(含三种价态)的化学方程式:_______ 。
(2)利用实验室中提供的试剂:锌粒、铁粉、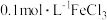 溶液、
溶液、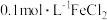 溶液、KSCN溶液、新制氯水,来探究
溶液、KSCN溶液、新制氯水,来探究 、
、 的氧化性、还原性。
的氧化性、还原性。
根据氧化还原反应的原理,小明认为 既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
(1)课前老师布置了下列预习作业,请你一起完成。
①写出3种含有不同价态铁元素的物质,并标出铁元素的化合价:
②写出①中所列物质之间相互转化(含三种价态)的化学方程式:
(2)利用实验室中提供的试剂:锌粒、铁粉、
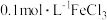 溶液、
溶液、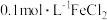 溶液、KSCN溶液、新制氯水,来探究
溶液、KSCN溶液、新制氯水,来探究 、
、 的氧化性、还原性。
的氧化性、还原性。根据氧化还原反应的原理,小明认为
 既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。
既有还原性又有氧化性,为验证小明所提出的假设,请你和小明一起设计实验方案,并描述实验现象,完成下列表格。| 探究内容 | 实验方案 | 实验现象 |
 具有还原性 具有还原性 | 取少量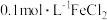 溶液,加入足量 溶液,加入足量 | 溶液变成红色 |
 具有氧化性 具有氧化性 | 取少量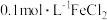 溶液,加入 溶液,加入 | 溶液由浅绿色变成无色,所发生反应的离子方程式为 |
您最近一年使用:0次
名校
解题方法
5 . 为了探究铁及其化合物的氧化性和还原性,某同学设计如下实验方案,其中符合实验要求且正确的是( )
| 选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
| A | 在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有氧化性 |
| B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Zn具有还原性 |
| C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
| D | 在氯化铁溶液中加入铜粉 | 棕黄色溶液变成蓝色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe3+具有还原性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-12-08更新
|
687次组卷
|
4卷引用:第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)
(已下线)第03章 铁 金属材料(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)北京市2019—2020学年高一年级11月月考化学试题广东省汕头市金山中学2019-2020学年高一上学期期末考试化学试题专题9 本专题达标检测-高中化学必修第二册苏教版2019
解题方法
6 . 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___ 。
(2)调节pH,实验记录如下:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___ 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__ 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___ 。
②根据实验现象分析,X的成分是___ 。
③Ⅱ中反应的化学方程式是___ 。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):
(2)调节pH,实验记录如下:
| 实验序号 | pH | 实验现象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是
②根据实验现象分析,X的成分是
③Ⅱ中反应的化学方程式是
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。
您最近一年使用:0次
2019-12-14更新
|
294次组卷
|
4卷引用:人教版(2019)高中化学必修第二册第五章《化学生产中的重要非金属元素》检测题
7 . 某化学小组在学习了 的实验室制法后,发现用加热浓盐酸与
的实验室制法后,发现用加热浓盐酸与 的方法制
的方法制 既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证
既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证 的部分性质,进行了如下探究活动。
的部分性质,进行了如下探究活动。
查阅资料: 和
和 的氧化性均比
的氧化性均比 的氧化性强,在不加热的条件下即可与浓盐酸反应制取
的氧化性强,在不加热的条件下即可与浓盐酸反应制取 。
。
(1)反应原理: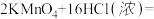
________________________ 。
(2)现有如图所示的装置:
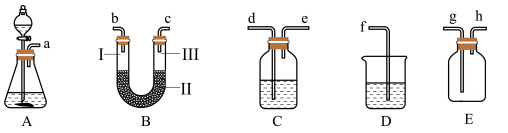
①实验时C中所装液体是______________ ,其作用是______________________ 。
②在制氯气前,必须进行的一项操作是_____________________________ 。
③D中所装液体是_____________________________ 。
④装置B的实验目的是验证氯气是否具有漂白性,因此B中Ⅰ、Ⅱ、Ⅲ处依次放入的物质的组合是________________________ (填序号)。
⑤装置的正确连接顺序为__________________ (用小写字母序号表示)。
 的实验室制法后,发现用加热浓盐酸与
的实验室制法后,发现用加热浓盐酸与 的方法制
的方法制 既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证
既浪费能源又不宜控制温度,他们现欲对该实验进行改进并验证 的部分性质,进行了如下探究活动。
的部分性质,进行了如下探究活动。查阅资料:
 和
和 的氧化性均比
的氧化性均比 的氧化性强,在不加热的条件下即可与浓盐酸反应制取
的氧化性强,在不加热的条件下即可与浓盐酸反应制取 。
。(1)反应原理:
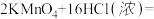
(2)现有如图所示的装置:

①实验时C中所装液体是
②在制氯气前,必须进行的一项操作是
③D中所装液体是
④装置B的实验目的是验证氯气是否具有漂白性,因此B中Ⅰ、Ⅱ、Ⅲ处依次放入的物质的组合是
编号 | Ⅰ | Ⅱ | Ⅲ |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
您最近一年使用:0次
2020-10-06更新
|
227次组卷
|
2卷引用:高一必修第一册(苏教2019版)高效手册 专题3 从海水中获得的化学物质
8 . 氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确结论。
(1)提出问题:
氯水中何种物质能使湿润的红色布条褪色?
(2)收集资料:
①氯气有强氧化性
②氯气与水反应生成盐酸和次氯酸
③次氯酸有强氧化性
(3)提出假设:
①__ ;
②__ ;
③___ ;
④水使红色布条褪色
(4)验证假设:
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:__ ;
实验③:把红色布条放在水里,布条不褪色。
(5)得出的实验结论__ 。
(1)提出问题:
氯水中何种物质能使湿润的红色布条褪色?
(2)收集资料:
①氯气有强氧化性
②氯气与水反应生成盐酸和次氯酸
③次氯酸有强氧化性
(3)提出假设:
①
②
③
④水使红色布条褪色
(4)验证假设:
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色;
实验②:
实验③:把红色布条放在水里,布条不褪色。
(5)得出的实验结论
您最近一年使用:0次
解题方法
9 . 资料显示:“氨气可在纯氧中安静燃烧……”。某校化学兴趣小组学生设计如下装置(图中铁夹等夹持装置已略去)进行氨气与氧气在不同条件下反应的实验对比。
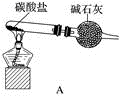

(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是____________________ ;碱石灰的作用是__________________________ 。
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式__________________ ;试管内气体变为红棕色,该反应的化学方程式是_______________________ 。
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因________________________ 。
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是_____________ ,其理由是______________________ 。
②氨气燃烧的化学方程式是_______________


(1)用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:
①氨催化氧化的化学方程式
②停止反应后,立即关闭B中两个活塞。一段时间后,将试管浸入冰水中,试管内气体颜色变浅,请说明可能的原因
(3)将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气生成氮气和水:
①两气体通入的先后顺序是
②氨气燃烧的化学方程式是
您最近一年使用:0次
2019-01-11更新
|
182次组卷
|
2卷引用:人教版高中化学必修1第四章《非金属及其化合物》测试卷1
2019高三·全国·专题练习
名校
10 . 某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。请你填出该同学实验中出现了以下现象时应得出的结论:
(1)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,结论是_______ 。
(2)若滴入酸性高锰酸钾溶液后不褪色,滴入KSCN溶液变红,结论是_______ 。
(3)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液变红,结论是____ 。
(4)不能将KMnO4和KSCN滴入到同一试管中进行验证,试进行解释_______ 。
(1)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,结论是
(2)若滴入酸性高锰酸钾溶液后不褪色,滴入KSCN溶液变红,结论是
(3)若滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液变红,结论是
(4)不能将KMnO4和KSCN滴入到同一试管中进行验证,试进行解释
您最近一年使用:0次
2019-06-11更新
|
251次组卷
|
4卷引用:鲁科版高中化学必修1第二章《元素与物质世界》测试卷
鲁科版高中化学必修1第二章《元素与物质世界》测试卷(已下线)【走进新高考】(人教版必修一)3.2.2几种重要金属化合物——铁的重要化合物 同步练习01福建省南安市侨光中学2018-2019学年高一5月月考化学试题(已下线)3.1.1 铁及其化合物练习(1)——《高中新教材同步备课》(鲁科版 必修第一册)



