名校
解题方法
1 . 某化学小组为测定有机物G的组成和结构,设计如图实验装置:
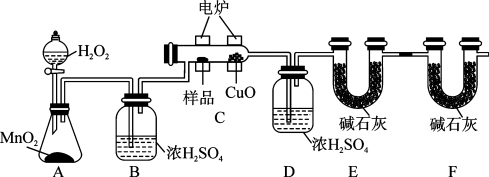
回答下列问题:
(1)实验开始时,先打开分液漏斗活塞,一段时间后再加热反应管C,目的是_______ 。
(2)装置B和装置D中浓硫酸的作用分别是_______ 和_______ 。
(3)装置E和装置F中碱石灰的作用分别是_______ 和_______ 。
(4)若准确称取2.2g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),装置D质量增加1.8g,U形管E质量增加4.4g。又知有机物G的质谱图如图所示。

该有机物的分子式为_______ 。
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为1:1:6。综上所述,G的结构简式为_______ 。

回答下列问题:
(1)实验开始时,先打开分液漏斗活塞,一段时间后再加热反应管C,目的是
(2)装置B和装置D中浓硫酸的作用分别是
(3)装置E和装置F中碱石灰的作用分别是
(4)若准确称取2.2g样品G(只含C、H、O三种元素),经充分燃烧后(CuO的作用是确保有机物充分氧化,最终生成CO2和H2O),装置D质量增加1.8g,U形管E质量增加4.4g。又知有机物G的质谱图如图所示。

该有机物的分子式为
(5)已知有机物G中含有羧基,经测定其核磁共振氢谱有3组峰,且峰面积之比为1:1:6。综上所述,G的结构简式为
您最近一年使用:0次
2022-05-28更新
|
316次组卷
|
9卷引用:陕西省西安市长安区第一中学2020-2021学年高二上学期期末考试化学(理)试题
陕西省西安市长安区第一中学2020-2021学年高二上学期期末考试化学(理)试题(已下线)1.2 研究有机化合物的一般方法(B级能力练)-2020-2021学年高二化学章节分层检测ABC(人教版2019选择性必修3)(已下线)专题二 研究有机化合物的一般方法-2020-2021学年高二《新题速递·化学》(人教版2019选择性必修3)2月刊 (同步课堂必刷题)(已下线)1.2.2 确定有机化合物的实验式与分子结构-2020-2021学年高二化学课时同步练(人教版2019选择性必修3)湖北省部分示范高中六校联考2021-2022学年高二下学期期中考试化学试题江苏省盐城市响水中学2021-2022学年高一下学期第二次学情分析考试化学试题安徽省蚌埠市第二中学2022-2023学年高一上学期第一次月考化学试题江西省铜鼓中学2022-2023学年高二下学期4月月考化学试题广东省广州市第十六中学2022-2023学年高二下学期5月月考化学试题
解题方法
2 . 硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
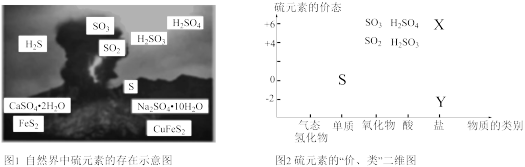
(1)从图1中选择符合图2要求的X、Y代表的物质:X_______ ,Y_______ 。
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
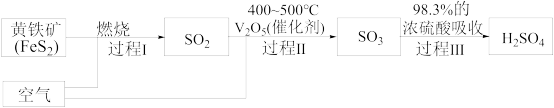
①上述过程中,没有发生氧化还原反应的是_______ (填“Ⅰ”、“Ⅱ”或“Ⅲ”)。
②过程Ⅰ的化学反应方程式为_______ 。
③下列对浓硫酸的叙述正确的是_______ (填字母)。
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性
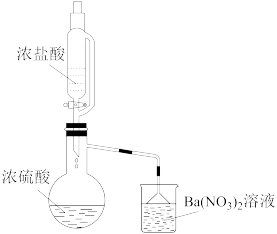
(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是_______ ;烧杯中出现白色沉淀,原因是_______ 。

(1)从图1中选择符合图2要求的X、Y代表的物质:X
(2)硫酸是重要的化工原料,查阅资料,工业制硫酸的过程如图:
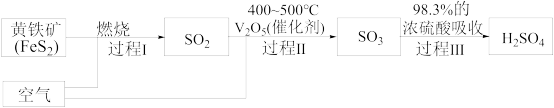
①上述过程中,没有发生氧化还原反应的是
②过程Ⅰ的化学反应方程式为
③下列对浓硫酸的叙述正确的是
A.常温下,浓硫酸与铁、铝不反应,所以铁质、铝质容器能盛放浓硫酸
B.浓硫酸具有吸水性,故能使蔗糖炭化
C.浓硫酸和铜片加热既表现出酸性,又表现出氧化性
D.浓硫酸与亚硫酸钠反应制取
 时,浓硫酸表现出强氧化性
时,浓硫酸表现出强氧化性(3)某兴趣小组为验证浓硫酸的性质进行实验,如图实验中观察到蒸馏烧瓶内有白雾,原因是

您最近一年使用:0次
解题方法
3 . 已知常温下,浓盐酸与高锰酸钾反应可以生成氯气。如图甲、乙、丙三处分别是沾有NaBr溶液的棉花、润湿的淀粉-KI试纸、润湿的品红试纸,下列说法正确的是
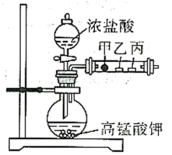

A.该实验通过现象可以证明氧化性: |
| B.沾有品红溶液的试纸会褪色,若再对丙微热则恢复红色 |
C.甲的现象也可以证明 的还原性强于 的还原性强于 |
D. 与NaBr溶液反应的实质与 与NaBr溶液反应的实质与 与NaBr溶液反应类似 与NaBr溶液反应类似 |
您最近一年使用:0次
2021-07-13更新
|
512次组卷
|
4卷引用:陕西省延安市新区高级中学2021-2022学年高一上学期期末考试化学试题
陕西省延安市新区高级中学2021-2022学年高一上学期期末考试化学试题河南省信阳市2020-2021学年高一下学期期末教学质量检测化学试题专题八 原子结构与元素周期表(A卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)(已下线)第四章 物质结构 元素周期律(A卷·知识通关练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第一册)
4 . 为探究Na2O2与H2O的反应,进行了如下实验:
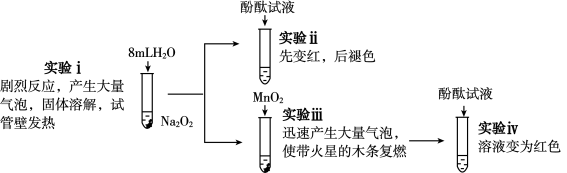
有关说法不正确的是( )

有关说法不正确的是( )
| A.实验ⅰ中发生反应的化学方程式为2Na2O2+2H2O===4NaOH+O2↑ |
| B.实验ⅲ中MnO2做H2O2分解反应的催化剂 |
| C.综合实验ⅰ和ⅲ可以说明Na2O2与H2O反应有H2O2生成 |
| D.综合实验ⅱ和ⅲ可以说明使酚酞褪色的是O2 |
您最近一年使用:0次
2019-04-18更新
|
688次组卷
|
14卷引用:陕西省泾阳县2020-2021学年高三上学期期中考试化学试题
陕西省泾阳县2020-2021学年高三上学期期中考试化学试题(已下线)专题卷三 钠及其化合物(B卷)-2021-2022学年高一化学优选好题单元专题双测卷(人教版2019必修第一册)北京市第九中学2021-2022学年高一上学期期中考试化学试题黑龙江省佳木斯市汤原县高级中学2021-2022学年高一上学期期中考试化学试题(已下线)2019年4月16日 《每日一题》三轮复习-碱金属元素及其化合物四川省三台中学2019-2020学年高一上学期第三次月考化学试题河北省衡水市阜城中学2019-2020高一上学期期中考试化学(人教版)试题(已下线)第10讲 钠及其重要化合物(精练)——2021年高考化学一轮复习讲练测苏教版(2020)高一必修第一册专题3第二单元 综合训练河南省安阳市第一中学2019-2020学年高一上学期期末考试化学试题北京市铁路第二中学2022-2023学年高一上学期期中考试化学试题北京市铁路第二中学2023-2024学年高一上学期期中考试化学试题北京市顺义区第九中学2023-2024学年高一上学期期中考试化学试题北京市第三十一中学2023-2024学年高一上学期期中考试化学试题
5 . 如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。
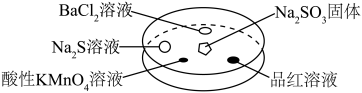
| 选项 | 实验现象 | 解释 |
| A | BaCl2溶液变浑浊 | SO2与BaCl2溶液反应产生了BaSO3沉淀 |
| B | Na2S溶液变浑浊 | SO2与Na2S溶液反应产生了S单质 |
| C | 酸性KMnO4溶液褪色 | SO2具有还原性 |
| D | 品红溶液褪色 | SO2具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2019-03-05更新
|
968次组卷
|
29卷引用:陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题
陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题(已下线)5.1.1 硫与二氧化硫(练好题)(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)天津市第三中学2020-2021学年高一下学期期中考试化学试题(已下线)【浙江新东方】【2021.5.19】【SX】【高三下】【高中化学】【SX00144】青海省西宁市海湖中学2021-2022学年高二上学期开学考试化学试题(已下线)2012届高三上学期化学一轮复习《硫、氮和可持续发展》专题综合测试(苏教版)2016届湖南省衡阳市第八中学高三上学期第二次月考化学试卷2015-2016学年山东寿光现代中学高一上12月月考化学卷2015-2016学年四川省资阳市高一下学期期末化学试卷湖南省长郡中学2018届高三月考试题(二)化学试题1山东省寿光现代中学2017-2018学年高一12月月考化学试题河南省郑州市第一中学2017-2018学年高一下学期入学考试化学试题甘肃省兰州市第一中学2017-2018学年高一下学期第一次月考化学试题甘肃省静宁县第一中学2017-2018学年高一下学期第二次月考化学试题【全国百强校】广西南宁市第二中学2017-2018学年高一下学期期中考试(理)化学试题【全国百强校】宁夏回族自治区吴忠中学2019届高三上学期第三次月考(期中)化学试题安徽省定远重点中学2018-2019学年高一下学期开学考试化学试题天津市宁河区芦台二中2019-2020学年高一下学期第一次阶段测试化学试题安徽省六安市舒城中学2019-2020学年高一下学期第一次月考化学试题宁夏青铜峡市高级中学2021届高三上学期期中考试化学试题山西省临汾市第一中学2021-2022学年高一上学期期末化学试题四川省什邡中学2021-2022学年高一下学期第二次月考化学试题四川省遂宁市射洪中学2021-2022学年高一下学期第一次月考化学试题(强基班)四川省广安市邻水县邻水实验学校2021-2022学年高一下学期5月第二次月考化学试题新疆伊犁哈萨克自治州伊犁州华—伊十校联盟2022-2023学年高一下学期4月期中联考化学试题云南省玉溪市民族中学2022-2023学年高一下学期6月考试化学试题云南省红河哈尼族彝族自治州第一中学2023-2024学年高一下学期3月月考化学试题北师大附属实验中学2023-2024学年度第二学期期中试卷北京师范大学附属实验中学2023-2024学年高一下学期期中考试化学试题
名校
6 . 鉴别CH4、C2H4、C2H2三种气体可采用的方法是( )
| A.通入溴水中,观察溴水是否褪色 | B.通入酸化的KMnO4溶液中,观察颜色变化 |
| C.点燃,检验燃烧产物 | D.点燃,观察火焰明亮程度及产生黑烟的量多少 |
您最近一年使用:0次
2018-07-24更新
|
950次组卷
|
13卷引用:陕西省咸阳百灵学校2020-2021学年高二下学期期中考试化学试题
陕西省咸阳百灵学校2020-2021学年高二下学期期中考试化学试题高二选择性必修3(人教版2019)第二章 烃 第二节 烯烃 炔烃 课时2 炔烃宁夏中宁县中宁中学2020-2021学年高二下学期第一次月考化学(B卷)试题宁夏中宁县中宁中学2020-2021学年高二下学期第一次月考化学(A卷)试题青海省海南州中学、海南州贵德中学2021-2022学年高二上学期期中考试化学试题(已下线)2014年高二人教化学选修五2-1-2脂肪烃炔烃脂肪烃来源及应用练习卷2016-2017学年吉林省毓文中学高二上期中化学卷2017-2018学年上海杨浦高级中学高二上期末考化学试卷福建省南安市侨光中学2019-2020学年高一下学期第一次阶段考化学试题课中-2.2.2 炔烃-人教2019选择性必修3(已下线)7.2.2 烃及有机高分子材料——同步学习必备知识(已下线)2.2 烯烃、炔烃-同步学习必备知识第2课时 烃 有机高分子材料1
7 . 小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是_______________ 。
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是______________________________ ,可能观察到的现象是溶液由浅绿色变为________ 色。
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选_________ 滴入小明所得的混合液中,并通过溶液出现______ 色的现象,证明小明的观点和实验方案都是正确的。
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为__________ (填化学式)。
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是______ ,相关反应的离子方程式是_____________ 。
(1)实验前小明预测Fe2+既有还原性又有氧化性。你认为他预测的依据是
(2)小明欲用实验证明他的预测。实验室提供了下列试剂:3%的过氧化氢溶液、锌粒、铜片、0.1 mol·L-1氯化亚铁溶液、硫氰化钾溶液、新制氯水。
①若小明计划在0.1 mol·L-1氯化亚铁溶液滴入新制氯水,探究Fe2+的还原性,你预计可能发生的反应的离子方程式是
②实验中,小明发现现象不太明显,老师分析可能是产物的含量太低,建议可以通过检验Fe2+被氧化的产物Fe3+的存在以获取证据。你认为可选
③对于证明Fe2+具有氧化性,小明认为金属单质都具有还原性,并分别将铜片、锌粒投入氯化亚铁溶液中,结果铜片没变化,锌粒逐渐变小。由此说明三种金属的还原性由强至弱的顺序为
④实际上Fe2+的还原性较强,实验室的氯化亚铁溶液常因氧化而变质,除去杂质的方法是
您最近一年使用:0次
2018-05-06更新
|
432次组卷
|
7卷引用:陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题
陕西省渭南市华州区咸林中学2021-2022学年高一上学期第三阶段质量检测化学试题陕西省铜川市耀州中学2022-2023学年高一上学期期末考试化学试题贵州省遵义航天高级中学2017-2018学年高一下学期期中考试理科综合化学试题云南省彝良县民中2018-2019学年高一上学期12月份考试化学试题(已下线)专题10 性质探究类综合实验-2022年高考化学毕业班二轮热点题型归纳与变式演练(全国通用)作业(十八) 铁盐和亚铁盐河南省南阳市六校2023-2024学年高一上学期12月月考化学试题
8 . 某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。
(1)装置A中盛放亚硫酸钠的仪器名称是____ ,其中发生反应的化学方程式为_____ 。
(2)实验过程中,装置B、C中发生的现象分别是_______ 、_______ ;这些现象分别说明SO2具有的性质是_______ 和_______ ;装置B中发生反应的离子方程式为_______ 。
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象_______ 。
(4)尾气可采用_______ 溶液吸收。
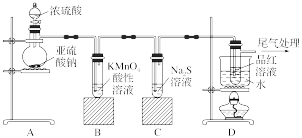
(1)装置A中盛放亚硫酸钠的仪器名称是
(2)实验过程中,装置B、C中发生的现象分别是
(3)装置D的目的是探究SO2与品红反应的可逆性,请写出实验操作及现象
(4)尾气可采用
您最近一年使用:0次
2016-12-09更新
|
5749次组卷
|
57卷引用:陕西省榆林市第十二中学2020-2021学年高一下学期第一次月考化学试题
陕西省榆林市第十二中学2020-2021学年高一下学期第一次月考化学试题(已下线)5.1.1 硫与二氧化硫(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)吉林省汪清县第四中学2020-2021学年高一下学期第一次阶段考试化学试题甘肃省金昌市第一中学2020-2021学年高一下学期期中考试化学(理)试题(已下线)广东省深圳中学2020-2021学年高一下学期期中考试化学试题云南省楚雄天人中学2020-2021学年高一下学期3月月考化学(B)试题(已下线)微专题22 二氧化硫性质四重性探究-备战2022年高考化学考点微专题黑龙江省大兴安岭呼玛县高级中学2021-2022学年高三上学期第一次月考化学试题内蒙古自治区第二地质中学2020-2021学年高一下学期第一次阶段检测化学试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期中考试化学试题2010年普通高等学校招生全国统一考试理综化学部分(新课标全国I卷)2010年普通高等学校招生全国统一考试(课标Ⅰ卷)理综化学部分全解全析2010年普通高等学校招生全国统一考试(湖南卷)理综化学部分全解全析2010年高考化学试题分项专题四 离子共存和离子反应2010年高考化学试题分项专题十二 非金属元素及其化合物2010年高考化学试题分项专题十五 化学实验(已下线)2012-2013学年广东省汕头市金山中学高一下学期期末考试化学试卷(已下线)2014届贵州省六盘水市六校上学期期末联合统考理综化学试卷(已下线)2014年化学高考总复习课时演练 4-3硫及其重要化合物练习卷(已下线)2015届黑龙江省哈尔滨市第32中学高三上学期期中考试化学试卷(已下线)2015届黑龙江省绥化市三校高三上学期期中联考化学试卷2014-2015海南省文昌中学高一下学期期中段考化学(理)试卷2014-2015学年四川省成都市树德中学高一下学期期末考试化学试卷2015-2016学年广东省汕头市金山中学高一下期末化学试卷四川省资阳市2016-2017学年高一下学期期末考试化学试题黑龙江省哈尔滨市第三十二中学2018届高三上学期期中考试化学试题广西陆川县中学2018届高三期中考试化学试题云南省腾冲市第八中学2017-2018学年高一下学期第一次月考化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第3讲 硫及其化合物【教学案】成都龙泉第二中学2019-2020学年高二上学期入学考试化学试题黑龙江省牡丹江市第三高级中学2020届高三上学期第一次月考化学试题(已下线)考点06 典型的非金属元素及其化合物——《备战2020年高考精选考点专项突破题集》步步为赢 高一化学寒假作业:作业十四 硫和氮的氧化物2020届高三化学一轮复习 化学基础实验(选择题和大题训练)安徽省淮北市第一中学2019-2020学年高一下学期2月在线测试化学试题福建省福州市第一中学2020年高一在线自测自评质检化学试题江西省南昌市第二中学2019-2020学年高一下学期第一次月考化学试题江苏省邗江中学2019-2020学年高二(新疆班)下学期期中考试化学试题甘肃省西北师范大学附属中学2019-2020学年高一上学期期末考试化学试题云南省普洱市景东彝族自治县第一中学2019-2020学年高二下学期期中考试理综化学试题辽宁省锦州市凌海市第三高级中学2019-2020学年高一6月月考化学试题(已下线)第15讲 硫及其化合物(精讲)——2021年高考化学一轮复习讲练测山东省济南市长清第一中学2020-2021学年高一上学期第三次月考化学试题新疆伊犁市奎屯市第一高级中学2019-2020学年高二上学期期中考试化学试题湖北省安陆市第一高级中学2021-2022学年高一下学期开学考试化学试题(已下线)【期中复习】必刷题-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)甘肃省会宁县第一中学2021-2022学年高一下学期期中(等级考)化学试题(已下线)【教材实验热点】06 二氧化硫的漂白性辽宁省朝阳市建平县实验中学2021-2022学年高一下学期第一次月考化学试题河南省平顶山市龙河实验高级中学2021-2022学年高一下学期期中考试化学试题安徽省池州市贵池区2021-2022学年高一下学期期中考试化学试题海南省海口嘉勋高级中学2021-2022学年高一下学期5月校考(高考班)化学试题(已下线)第01练 硫及其化合物-2023年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)第3讲 硫及其重要化合物山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 云南省腾冲市第八中学2023-2024学年高一下学期开学化学试题湖南省衡阳市衡阳县第一中学2023-2024学年高一下学期4月期中考试化学试题



