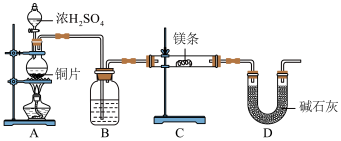
1 . 某研究性学习小组利用下列有关装置,对二氧化疏的性质及空气中二氧化疏的含量进行探究(装置的气密性已检查):___________ 。
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间 ,再关闭弹簧夹,此操作的目的是:
,再关闭弹簧夹,此操作的目的是:___________ 。
(3)实验过程中装置B中没有明显变化。实验结束后取下装置B,从中取少量溶液于洁净试管中,向试管中滴加适量___________出现白色沉淀。
(4)装置C中的溶液中出现___________ 浑浊,发生的反应方程式为___________ 。
(5)装置D中溶液是___________ 。
(6)如果用硫酸溶液和 固体反应制取
固体反应制取 装置如图所示,其中a导管的作用是
装置如图所示,其中a导管的作用是___________ 。 含量(假设空气中无其他还原性气体)。
含量(假设空气中无其他还原性气体)。
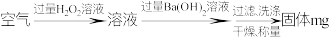
实验中若通过空气的体积为 (标准状况下),最终所得固体质量为
(标准状况下),最终所得固体质量为 ,通过计算确定该空气中二氧化硫的含量是
,通过计算确定该空气中二氧化硫的含量是___________ 。(结果精确到 )
)

(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间
 ,再关闭弹簧夹,此操作的目的是:
,再关闭弹簧夹,此操作的目的是:(3)实验过程中装置B中没有明显变化。实验结束后取下装置B,从中取少量溶液于洁净试管中,向试管中滴加适量___________出现白色沉淀。
| A.氨水 | B. | C.氯水 | D.盐酸 |
(5)装置D中溶液是
(6)如果用硫酸溶液和
 固体反应制取
固体反应制取 装置如图所示,其中a导管的作用是
装置如图所示,其中a导管的作用是
 含量(假设空气中无其他还原性气体)。
含量(假设空气中无其他还原性气体)。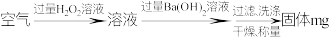
实验中若通过空气的体积为
 (标准状况下),最终所得固体质量为
(标准状况下),最终所得固体质量为 ,通过计算确定该空气中二氧化硫的含量是
,通过计算确定该空气中二氧化硫的含量是 )
)
您最近一年使用:0次
名校
解题方法
2 . 小组根据 既有还原性又有氧化性,探究能否实现
既有还原性又有氧化性,探究能否实现 或
或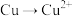 的转化。
的转化。
已知:ⅰ.水合 既易被氧化也易被还原,因此水溶液中无法生成水合
既易被氧化也易被还原,因此水溶液中无法生成水合 ;
;
ⅱ. 为白色固体,难溶于水,可溶于
为白色固体,难溶于水,可溶于 较大的溶液生成
较大的溶液生成 ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。
ⅲ. 可被氧化生成
可被氧化生成 (深蓝色)。
(深蓝色)。
Ⅰ. 与
与 的反应
的反应
向试管中通入足量 (尾气处理装置已略),记录如下。
(尾气处理装置已略),记录如下。
(1)基态 的价层电子排布式为
的价层电子排布式为___________ 。
(2)将 所得沉淀过滤,充分洗涤,进行如图实验,证实该沉淀为
所得沉淀过滤,充分洗涤,进行如图实验,证实该沉淀为 。
。 ,推理过程是
,推理过程是___________ 。
②实验ⅲ排除了实验ⅰ中过量氨水对于 检验的干扰。
检验的干扰。
写出ⅲ中反应的离子方程式___________ ; 。
。
(3)进一步证实 中
中 作还原剂,补全实验方案和预期现象:取
作还原剂,补全实验方案和预期现象:取 中反应后的上层清液于试管中,
中反应后的上层清液于试管中,___________ 。
(4)由实验Ⅰ可推知,该条件下:
① 中
中 不能将
不能将 还原为
还原为 或
或 ;
;
②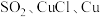 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为___________ 。
综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ. 与
与 的反应
的反应
向试管中通入足量 (尾气处理装置已略),记录如下。
(尾气处理装置已略),记录如下。
(5)经检验,证明 所得棕色溶液中含有
所得棕色溶液中含有 ,且铜表面黑色沉淀为
,且铜表面黑色沉淀为 。补全
。补全 中反应的离子方程式:
中反应的离子方程式:___________ 。
___________ ___________
___________ ___________
___________ ___________
___________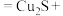 ___________
___________ ___________
___________
 既有还原性又有氧化性,探究能否实现
既有还原性又有氧化性,探究能否实现 或
或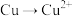 的转化。
的转化。已知:ⅰ.水合
 既易被氧化也易被还原,因此水溶液中无法生成水合
既易被氧化也易被还原,因此水溶液中无法生成水合 ;
;ⅱ.
 为白色固体,难溶于水,可溶于
为白色固体,难溶于水,可溶于 较大的溶液生成
较大的溶液生成 ,也可溶于氨水生成
,也可溶于氨水生成 (无色)。
(无色)。ⅲ.
 可被氧化生成
可被氧化生成 (深蓝色)。
(深蓝色)。Ⅰ.
 与
与 的反应
的反应向试管中通入足量
 (尾气处理装置已略),记录如下。
(尾气处理装置已略),记录如下。| 装置 | 编号 | 试剂 | 实验现象 |
|  | 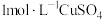 溶液 溶液 | 始终无明显变化 |
 | 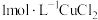 溶液 溶液 | 溶液变绿,进而变棕黄色,一段时间后出现白色沉淀 |
(1)基态
 的价层电子排布式为
的价层电子排布式为(2)将
 所得沉淀过滤,充分洗涤,进行如图实验,证实该沉淀为
所得沉淀过滤,充分洗涤,进行如图实验,证实该沉淀为 。
。
 ,推理过程是
,推理过程是②实验ⅲ排除了实验ⅰ中过量氨水对于
 检验的干扰。
检验的干扰。写出ⅲ中反应的离子方程式
 。
。(3)进一步证实
 中
中 作还原剂,补全实验方案和预期现象:取
作还原剂,补全实验方案和预期现象:取 中反应后的上层清液于试管中,
中反应后的上层清液于试管中,(4)由实验Ⅰ可推知,该条件下:
①
 中
中 不能将
不能将 还原为
还原为 或
或 ;
;②
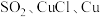 的还原性由强到弱的顺序为
的还原性由强到弱的顺序为综上所述,改变还原产物的价态或形态可以影响氧化还原反应能否发生。
Ⅱ.
 与
与 的反应
的反应向试管中通入足量
 (尾气处理装置已略),记录如下。
(尾气处理装置已略),记录如下。| 装置 | 编号 | 试剂 | 实验现象 |
|  |  稀硫酸 稀硫酸 | 始终无明显变化 |
 |  稀盐酸 稀盐酸 | 铜片表面变黑,溶液变为棕色 |
(5)经检验,证明
 所得棕色溶液中含有
所得棕色溶液中含有 ,且铜表面黑色沉淀为
,且铜表面黑色沉淀为 。补全
。补全 中反应的离子方程式:
中反应的离子方程式:___________
 ___________
___________ ___________
___________ ___________
___________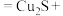 ___________
___________ ___________
___________
您最近一年使用:0次
名校
解题方法
3 . 二氯化硫 是一种红棕色液体,可用作于制造杀虫剂。
是一种红棕色液体,可用作于制造杀虫剂。 与水反应可生成
与水反应可生成 、
、 和
和 。为验证
。为验证 与水反应的产物,某小组设计如图所示装置进行实验:
与水反应的产物,某小组设计如图所示装置进行实验: 溶液能吸收
溶液能吸收 难溶于饱和
难溶于饱和 溶液。
溶液。
(1) 分子中,各原子均满足最外层8电子稳定结构。
分子中,各原子均满足最外层8电子稳定结构。 的电子式为
的电子式为___________ 。
(2)装置D中产生气泡,反应的离子方程式为___________ 。
(3)装置B、C中的实验现象分别为___________ 和___________ 。
(4)若溶液 为
为 和氨水的混合液,则实验后装置
和氨水的混合液,则实验后装置 中有沉淀生成,该沉淀为
中有沉淀生成,该沉淀为___________ 。
 是一种红棕色液体,可用作于制造杀虫剂。
是一种红棕色液体,可用作于制造杀虫剂。 与水反应可生成
与水反应可生成 、
、 和
和 。为验证
。为验证 与水反应的产物,某小组设计如图所示装置进行实验:
与水反应的产物,某小组设计如图所示装置进行实验:
 溶液能吸收
溶液能吸收 难溶于饱和
难溶于饱和 溶液。
溶液。(1)
 分子中,各原子均满足最外层8电子稳定结构。
分子中,各原子均满足最外层8电子稳定结构。 的电子式为
的电子式为(2)装置D中产生气泡,反应的离子方程式为
(3)装置B、C中的实验现象分别为
(4)若溶液
 为
为 和氨水的混合液,则实验后装置
和氨水的混合液,则实验后装置 中有沉淀生成,该沉淀为
中有沉淀生成,该沉淀为
您最近一年使用:0次
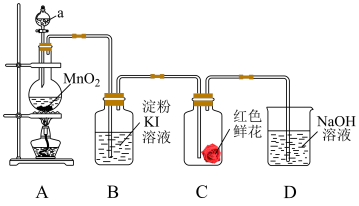
4 . 下图是二氧化锰和浓盐酸反应制取氯气、并验证其部分化学性质的实验装置,请回答下列问题:_____ 色气体。
(2)装置 中,仪器
中,仪器 中盛装的试剂是
中盛装的试剂是_____ (填“浓硫酸”或“浓盐酸”)。
(3)当有少量氯气通过后,可观察到装置 中溶液变成
中溶液变成____ 色。
(4)当氯气持续通过时,装置 中红色鲜花颜色
中红色鲜花颜色______ 。
(5)装置 的作用是
的作用是_____ 。
(2)装置
 中,仪器
中,仪器 中盛装的试剂是
中盛装的试剂是(3)当有少量氯气通过后,可观察到装置
 中溶液变成
中溶液变成(4)当氯气持续通过时,装置
 中红色鲜花颜色
中红色鲜花颜色(5)装置
 的作用是
的作用是
您最近一年使用:0次
2024-07-06更新
|
158次组卷
|
2卷引用:2023年吉林省普通高中学业水平合格性考试化学试卷
名校
解题方法
5 . 回答下列问题。
Ⅰ.利用如图所示装置测定中和热的实验步骤如下: 盐酸倒入量热计的内筒,测出盐酸温度,用水将温度计上的酸冲洗干净,擦干备用;
盐酸倒入量热计的内筒,测出盐酸温度,用水将温度计上的酸冲洗干净,擦干备用;
②用另一量筒量取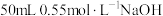 溶液,用温度计测出其温度;
溶液,用温度计测出其温度;
③将NaOH溶液分次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的平均温度;
④重复测量2~3次,准确记录数据。
回答下列问题:
(1)上述步骤中错误是_______ 。
(2)假设盐酸和氢氧化钠溶液的密度都是 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容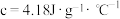 。为了计算中和热,某学生实验记录数据如下:
。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热
_______ (结果保留1位小数)。
(3)上述实验结果与中和热数值 有偏差,产生偏差的原因不可能为
有偏差,产生偏差的原因不可能为_______ (填序号)。
①实验装置保温、隔热效果差
②用量筒量取盐酸溶液体积时仰视读数
③分多次把NaOH溶液倒入内筒中
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
Ⅱ.化学小组为探究 在酸性
在酸性 溶液中的反应,利用如图装置进行实验:
溶液中的反应,利用如图装置进行实验: 的流速,向丁装置中通入
的流速,向丁装置中通入 和
和 的混合气体。
的混合气体。
Ⅱ.一段时间后,溶液变黄并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入 和
和 混合气体,溶液变为无色。
混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加 溶液,产生白色沉淀。
溶液,产生白色沉淀。
回答下列问题:
(4)苯的作用为_______ 。排出装置内空气的具体操作为_______ 。
(5)步骤Ⅲ反应的离子方程式为_______ 。
(6)实验的总反应为_______ ,KI 和 HI 在反应中的作用为_______ 。
Ⅰ.利用如图所示装置测定中和热的实验步骤如下:

 盐酸倒入量热计的内筒,测出盐酸温度,用水将温度计上的酸冲洗干净,擦干备用;
盐酸倒入量热计的内筒,测出盐酸温度,用水将温度计上的酸冲洗干净,擦干备用;②用另一量筒量取
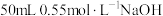 溶液,用温度计测出其温度;
溶液,用温度计测出其温度;③将NaOH溶液分次缓慢倒入量热计的内筒中,搅拌使之混合均匀,测得混合液的平均温度;
④重复测量2~3次,准确记录数据。
回答下列问题:
(1)上述步骤中错误是
(2)假设盐酸和氢氧化钠溶液的密度都是
 ,又知中和反应后生成溶液的比热容
,又知中和反应后生成溶液的比热容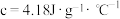 。为了计算中和热,某学生实验记录数据如下:
。为了计算中和热,某学生实验记录数据如下:起始温度 | 终止温度 | ||
实验序号 | 盐酸 | 氢氧化钠溶液 | 混合溶液 |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |

(3)上述实验结果与中和热数值
 有偏差,产生偏差的原因不可能为
有偏差,产生偏差的原因不可能为①实验装置保温、隔热效果差
②用量筒量取盐酸溶液体积时仰视读数
③分多次把NaOH溶液倒入内筒中
④测量稀盐酸的温度计未洗净直接测定NaOH溶液的温度
Ⅱ.化学小组为探究
 在酸性
在酸性 溶液中的反应,利用如图装置进行实验:
溶液中的反应,利用如图装置进行实验:
 的流速,向丁装置中通入
的流速,向丁装置中通入 和
和 的混合气体。
的混合气体。Ⅱ.一段时间后,溶液变黄并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入
 和
和 混合气体,溶液变为无色。
混合气体,溶液变为无色。Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加
 溶液,产生白色沉淀。
溶液,产生白色沉淀。回答下列问题:
(4)苯的作用为
(5)步骤Ⅲ反应的离子方程式为
(6)实验的总反应为
您最近一年使用:0次
6 . 《物理小识·金石类》记载:“青矾厂气熏人,衣服当之易烂,载木不盛”,“青矾强热,得赤色固体,气凝即得矾油”。“青矾”是指 ,“青矾厂气”是指
,“青矾厂气”是指 和
和 ,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行
,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行 性质探究。
性质探究。 熔点
熔点 ,沸点
,沸点 熔点
熔点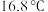 ,沸点
,沸点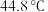 。
。
回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。
(1)盛放钡盐溶液仪器的名称为_______ 。A装置中反应后所得固体的化学式为_______ 。
(2)B装置的作用_______ 。
(3)D的作用是_______ (用离子方程式表示)。
Ⅱ.探究 的性质
的性质
在装置 中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入
中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图:_______ 。
(5) 图中,②的曲线出现骤降,这是因为
图中,②的曲线出现骤降,这是因为 _______ (用化学方程式表示)。对比分析上述两组数据,可得出的结论是_______ 。
 ,“青矾厂气”是指
,“青矾厂气”是指 和
和 ,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行
,“矾油”是指硫酸溶液。实验室模拟古法制硫酸并进行 性质探究。
性质探究。
 熔点
熔点 ,沸点
,沸点 熔点
熔点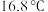 ,沸点
,沸点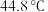 。
。回答下列问题:
Ⅰ.制取硫酸
实验开始前打开活塞
 ,关闭活塞
,关闭活塞 ,通入一段时间
,通入一段时间 后,关闭活塞
后,关闭活塞 ,打开活塞
,打开活塞 ,用酒精喷灯高温加热青矾。
,用酒精喷灯高温加热青矾。(1)盛放钡盐溶液仪器的名称为
(2)B装置的作用
(3)D的作用是
Ⅱ.探究
 的性质
的性质在装置
 中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入
中先后使用同体积的蒸馏水(①已预先煮沸,②未预先煮沸),控制食用油油层厚度一致、通入 流速一致。两次实验分别得到如图
流速一致。两次实验分别得到如图 图:
图:
(5)
 图中,②的曲线出现骤降,这是因为
图中,②的曲线出现骤降,这是因为
您最近一年使用:0次
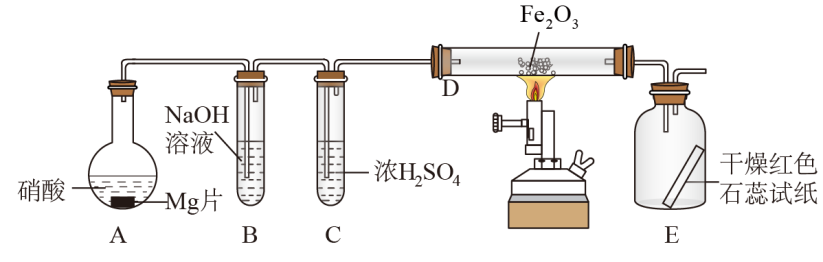
7 . 硝酸与金属反应时,浓度不同生成的还原产物也可能不同,某兴趣小组进行了如下图所示的实验探究,实验现象及相关数据如下:
②从C进入D中的气体有两种,且体积比为1∶1;
③将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)装置中仪器A的名称___________ ;硝酸与Mg片反应生成的气体成分是___________ (用化学式表示)。
(2)硝酸在装置A的反应中所表现的性质有___________ 。
(3)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明B中生成的这种盐在酸性条件下具有氧化性___________ 。
(4)写出D中发生反应的化学方程式___________ 。
(5)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的 (同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式___________ 。
②从C进入D中的气体有两种,且体积比为1∶1;
③将D加热一段时间后,E中干燥的红色石蕊试纸逐渐变蓝。(设实验前,装置中的空气已排尽;气体的体积均在同温同压下测定)
已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O,且水蒸气的体积忽略不计,实验中的液体药品均过量。请回答:
(1)装置中仪器A的名称
(2)硝酸在装置A的反应中所表现的性质有
(3)利用所提供的试剂(NaNO2溶液、KMnO4溶液、KI溶液、稀硫酸、淀粉溶液)设计实验,证明B中生成的这种盐在酸性条件下具有氧化性
(4)写出D中发生反应的化学方程式
(5)若向反应后的A中加入足量的NaOH固体,使产生的气体全部逸出,其体积为硝酸与Mg片反应生成的气体体积的
 (同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
(同温同压),写出符合上述实验事实的硝酸与Mg片反应的离子方程式
您最近一年使用:0次
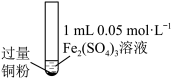
8 . 某小组同学通过实验研究 溶液与铜粉发生的氧化还原反应。实验记录如下:
溶液与铜粉发生的氧化还原反应。实验记录如下:
下列说法不正确的是
 溶液与铜粉发生的氧化还原反应。实验记录如下:
溶液与铜粉发生的氧化还原反应。实验记录如下:序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
|
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及 被还原 被还原 |
| B.对比实验Ⅰ、Ⅱ说明白色沉淀的产生与铜粉的量有关 |
C.实验Ⅱ、Ⅲ中加入蒸馏水后 相同 相同 |
| D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀 |
您最近一年使用:0次
2024-04-15更新
|
255次组卷
|
21卷引用:专题9 本专题复习提升-高中化学必修第二册苏教版2019
专题9 本专题复习提升-高中化学必修第二册苏教版2019北京市第二十中学2022-2023学年高三下学期开学检测化学试题(已下线)【2023】【高一下】【其他】【余高2】【高中化学】【刘尼尼收集】2023届湖北省荆门市龙泉中学、荆州中学·、宜昌一中三校高三下学期5月第二次联考化学试题【区级联考】北京市海淀区2019届高三5月期末练习(二模)理综化学试题安徽省合肥一中2019-2020学年高三上学期9月月考化学试题广东省北大附中深圳南山分校2020届高三上学期期中考试化学试题(已下线)考点21 定量探究实验设计综合——《备战2020年高考精选考点专项突破题集》福建省厦门双十中学2020届高三上学期期中考试化学试题江西省赣州市赣县三中2020届高三上学期补习班期末适应性考试化学试题北京市石景山区精华学校2019-2020学年高三上学期二次月考化学试题四川省成都市树德中学 2020届高三三诊模拟考试理科综合化学试题福建省福州市八县(市)一中2021届高三上学期期中联考化学试题北京市北京理工大学附属中学2022届高三十月月考化学试题北京师范大学附属中学2021-2022学年高一下学期期末考试化学试题山东省滨州市沾化区实验高级中学2022-2023学年高三上学期第二次月考化学试题黑龙江省佳木斯市第八中学2021-2022学年高三上学期第二次调研(期中)考试化学试题广东省深圳外国语学校高中园2023-2024学年高一上学期期末考试 化学试卷湖南省长沙市第一中学2023-2024学年高三下学期4月月考化学试题北京市第五十七中学2023-2024学年高一下学期期末考试化学试题广东省吴川市两校联考2023-2024学年高一下学期期中考试化学试卷
名校
解题方法
9 . 某中学化学兴趣小组利用如下实验装置(部分加热装置已省略)探究SO2与Mg的反应及SO2的某些性质。据此回答相关问题:_______ ,A装置中产生的SO2可能混有少量的 ,B装置中的试剂可以是
,B装置中的试剂可以是_______ 。(填写序号)
a.NaOH溶液 b.浓硫酸 c.饱和 溶液
溶液
(2)类比分析、模型认知与证据推理是中学化学学习的重要方法之一、从物质分类上分析,SO2和CO2都是酸性氧化物,从化合价态角度分析,SO2和CO2都具有_______ (填具体的化学性质)。
(3)实验小组查阅相关资料整理出硫及其部分化合物的性质:①S单质难溶于水、非氧化性的酸溶液,微溶于酒精、易溶于 ;②MgS在冷水中易水解生成
;②MgS在冷水中易水解生成 、
、 、热水中易水解生成
、热水中易水解生成 、
、 ;③
;③ 是一种具有特殊臭味的气体。
是一种具有特殊臭味的气体。
实验1:取少量装置C的剩余固体样品加入稀盐酸,样品部分溶解,有黄色固体剩余,并伴有刺激性气味气体产生。
实验小组结合实验1现象,认为剩余固体中一定有S单质、MgO和MgS,MgS产生的原因点燃是:2Mg+SO2 2MgO+S;
2MgO+S;_______ (用化学方程式表示)。并对实验1产生气体的组成提出以下猜想:
猜想1:气体为H2
猜想2:气体为H2S
猜想3:气体为H2、H2S的混合气体
写出实验1中产生刺激性气味气体的化学方程式_______ ;由实验1现象可知_______ 不成立(填“猜想1”、或“猜想2”、或“猜想3”);
实验2:取少量装置C的剩余固体样品加入热水溶解、过滤,并往洗涤过后的滤渣加入足量稀盐酸,无气泡产生。由实验2现象可知_______ 不成立(填“猜想1”、或“猜想2”、或“猜想3”)。
 ,B装置中的试剂可以是
,B装置中的试剂可以是a.NaOH溶液 b.浓硫酸 c.饱和
 溶液
溶液(2)类比分析、模型认知与证据推理是中学化学学习的重要方法之一、从物质分类上分析,SO2和CO2都是酸性氧化物,从化合价态角度分析,SO2和CO2都具有
(3)实验小组查阅相关资料整理出硫及其部分化合物的性质:①S单质难溶于水、非氧化性的酸溶液,微溶于酒精、易溶于
 ;②MgS在冷水中易水解生成
;②MgS在冷水中易水解生成 、
、 、热水中易水解生成
、热水中易水解生成 、
、 ;③
;③ 是一种具有特殊臭味的气体。
是一种具有特殊臭味的气体。实验1:取少量装置C的剩余固体样品加入稀盐酸,样品部分溶解,有黄色固体剩余,并伴有刺激性气味气体产生。
实验小组结合实验1现象,认为剩余固体中一定有S单质、MgO和MgS,MgS产生的原因点燃是:2Mg+SO2
 2MgO+S;
2MgO+S;猜想1:气体为H2
猜想2:气体为H2S
猜想3:气体为H2、H2S的混合气体
写出实验1中产生刺激性气味气体的化学方程式
实验2:取少量装置C的剩余固体样品加入热水溶解、过滤,并往洗涤过后的滤渣加入足量稀盐酸,无气泡产生。由实验2现象可知
您最近一年使用:0次
2024-04-04更新
|
82次组卷
|
4卷引用:福建省泉州市泉港区第一中学、厦门外国语学校石狮分校两校联考2023-2024学年高一上学期12月月考化学试题
10 . 如图所示,在 处通入未经干燥的氯气。当关闭
处通入未经干燥的氯气。当关闭 阀时,
阀时, 处的红色布条不褪色;当打开
处的红色布条不褪色;当打开 阀后,
阀后, 处的红色布条逐渐褪色。则
处的红色布条逐渐褪色。则 瓶中盛放的溶液可以是
瓶中盛放的溶液可以是 溶液 ②
溶液 ② 溶液 ③
溶液 ③ ④浓硫酸
④浓硫酸
 处通入未经干燥的氯气。当关闭
处通入未经干燥的氯气。当关闭 阀时,
阀时, 处的红色布条不褪色;当打开
处的红色布条不褪色;当打开 阀后,
阀后, 处的红色布条逐渐褪色。则
处的红色布条逐渐褪色。则 瓶中盛放的溶液可以是
瓶中盛放的溶液可以是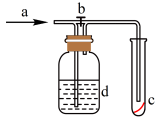
 溶液 ②
溶液 ② 溶液 ③
溶液 ③ ④浓硫酸
④浓硫酸| A.①② | B.①③ | C.②④ | D.③④ |
您最近一年使用:0次
2024-03-18更新
|
205次组卷
|
59卷引用:天津市和平区2022-2023学年高一上学期期末考试化学试题
天津市和平区2022-2023学年高一上学期期末考试化学试题内蒙古呼和浩特市2022-2023学年高一下学期3月质量监测化学试题北京市顺义一中2023届高三下学期保温练习模拟考试化学试题(已下线)专题突破卷04?非金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)【精品卷】2.2.1 氯气的性质课堂例题-人教版2023-2024学年必修第一册江苏省兴化中学、泗洪中学2023-2024学年高一上学期10月学情调研(强基班)化学试题浙江省台州八校联盟2023-2024学年高一上学期期中联考化学试题广东实验中学越秀学校2023-2024学年高一上学期11月期中考试化学试题河南省新乡市原阳县第一高级中学2023-2024学年高一上学期12月月考化学试题云南省宣威市第六中学2023-2024学年高一上学期12月月考化学试题广东省江门市广雅中学2023-2024学年高一上学期12月月考化学试题B卷河南省商丘市柘城县德盛高级中学2023-2024学年高一上学期11月月考化学试题湖南省岳阳市湘阴县知源高级中学等多校2023-2024学年高一上学期12月月考化学试题2016届福建省大田市第一中学高三上学期第一次月考化学试卷2016届福建省福州格致中学高三上学期半期考试化学试卷(已下线)4.2.1 氯气高中化学人教版 必修1 第四章 非金属及其化合物 2.富集在海水中的元素——氯 活泼的黄绿色气体——氯气湖北省长阳县第一高级中学2017-2018学年高一上学期期末考试化学试题(已下线)2018年11月20日 《每日一题》人教必修1-氯气的性质山东省济宁市实验中学2019-2020学年高一上学期期中考试化学试题河北省承德第一中学2019-2020学年高一上学期期中考试化学试题(已下线)【新东方】2019新中心五地005高中化学云南省施甸县第三中学2019-2020学年高一12月月考化学试题夯基提能2020届高三化学选择题对题专练——常见无机物及其性质应用——氯及其化合物 (强化练)天津市西青区2019-2020学年高一上学期期末考试化学试题(已下线)第二节 氯及其化合物(一)-2020-2021学年高一化学必修第一册课时同步练(新人教)高一必修第一册(苏教2019版)高效手册 专题3 从海水中获得的化学物质福建省厦门第一中学2020-2021学年高一上学期10月月考化学试题辽宁省辽南协作体2020-2021学年高一上学期期中考试化学试题山东省邹城第一中学2020-2021学年高一上学期期中质量检测化学试题安徽省利辛县阚疃金石中学2020-2021学年高二上学期期中考试化学试题湖南省湘潭市第一中学2020-2021学年高一上学期期中考试化学试题湖南省长沙市周南中学2020-2021学年高一上学期期末考试化学试题云南省文山州砚山县第三高级中学2020-2021学年高一上学期期中考试化学试题河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题黑龙江省双鸭山市第一中学2020-2021学年高一第二次月考化学试题安徽省宿州市砀山中学2021-2022学年高一上学期第一次质量检测化学试题福建省厦门同安一中2021-2022学年高一上学期(10月)第一次月考化学试题人教2019版必修第一册第二章第二节 氯及其化合物课后习题安徽省马鞍山第二中学2021-2022学年高一上学期期中考试化学试题 新疆吐鲁番市2021-2022学年高一上学期期末考试化学试题湖南省长郡中学2021-2022学年高一上学期期末考试化学试题广东省广州市华南师范大学附属中学2021-2022学年高一上学期期末考试化学试题黑龙江省密山市第四中学2021-2022学年高一上学期期中考试化学试题北京市第三中学2022-2023学年高一上学期期中考试化学试题辽宁省重点高中沈阳市郊联体2022-2023学年高一上学期期中考试化学试题辽宁省沈阳市辽中区第二高级中学2022-2023学年高一上学期期中考试化学试题广西桂林市第十九中学2021-2022学年高一上学期期中质量检测化学试题广东省广州市第九十七中学2022-2023学年高一上学期期末考试化学试题【2022】【高一上】【杭师大附中】【期中考】【高中化学】【徐外兰收集】(已下线)广东省广州市第一中学2022-2023学年高一上学期期中考试化学试题广东省惠州市龙门县高级中学2021-2022学年高一下学期开学测试化学试题河北省石家庄市第二中学西校区2023-2024学年高一上学期12月月考化学试题青海省西宁市大通县2023-2024学年高一上学期期末考试化学试题江苏省无锡市第一中学2023-2024学年高一上学期艺术班期末化学试题安徽省合肥市六校联盟2023-2024学年高一上学期1月期末化学试题湖南省长沙市雅礼中学2023-2024学年高一下学期入学考试化学试卷 2.2.1 氯气的性质(巩固)2.2.1 氯气的性质课堂例题