真题
名校
1 . 医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
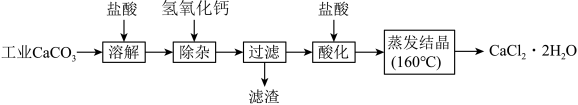
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是________________ 。
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③_______________ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有:____________________ 。
②计算上述样品中CaCl2·2H2O的质量分数为:____________________ 。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:__________ ;___________ 。

(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是
(2)酸化操作是加入盐酸,调节溶液的pH为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测液于锥形瓶中;c.用0.05000mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①上述测定过程中需用溶液润洗的仪器有:
②计算上述样品中CaCl2·2H2O的质量分数为:
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有:
您最近一年使用:0次
2019-01-30更新
|
1152次组卷
|
5卷引用:2009年普通高等学校招生统一考试化学试题(江苏卷)
2009年普通高等学校招生统一考试化学试题(江苏卷)2009高考真题汇编-化学实验常用仪器和基本操作(已下线)2011届湖北省天门市高三模拟考试(三)(理综)化学部分河北省黄骅中学2018-2019学年高二上学期第二次月考化学试题2020年安徽省全省教学质量检测统一考试(练习检测一)
2 . 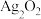 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在 溶液中加入适量
溶液中加入适量 溶液,生成
溶液,生成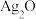 沉淀,保持反应温度为80
沉淀,保持反应温度为80 ,边搅拌边将一定量
,边搅拌边将一定量 溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8
溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8 Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。
Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。
回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是___________ 。
(2)银锌碱性电池的电解质溶液为 溶液,电池放电时正极的
溶液,电池放电时正极的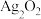 转化为
转化为 ,负极的
,负极的 转化为
转化为 ,写出该电池反应方程式:
,写出该电池反应方程式:___________ 。
(3)准确称取上述制备的样品(设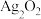 仅含和
仅含和 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为 和
和 ,得到224.0mL
,得到224.0mL (标准状况下)。计算样品中
(标准状况下)。计算样品中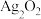 的质量分数
的质量分数_____ (计算结果精确到小数点后两位)。
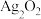 是银锌碱性电池的正极活性物质,可通过下列方法制备:在
是银锌碱性电池的正极活性物质,可通过下列方法制备:在 溶液中加入适量
溶液中加入适量 溶液,生成
溶液,生成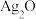 沉淀,保持反应温度为80
沉淀,保持反应温度为80 ,边搅拌边将一定量
,边搅拌边将一定量 溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8
溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品。反应方程式为2AgNO3+ 4KOH+K2S2O8 Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。
Ag2O2↓+ 2KNO3+ 2K2SO4+ 2H2O。回答下列问题:
(1)上述制备过程中,检验洗涤是否完全的方法是
(2)银锌碱性电池的电解质溶液为
 溶液,电池放电时正极的
溶液,电池放电时正极的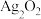 转化为
转化为 ,负极的
,负极的 转化为
转化为 ,写出该电池反应方程式:
,写出该电池反应方程式:(3)准确称取上述制备的样品(设
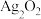 仅含和
仅含和 )2.558g,在一定的条件下完全分解为
)2.558g,在一定的条件下完全分解为 和
和 ,得到224.0mL
,得到224.0mL (标准状况下)。计算样品中
(标准状况下)。计算样品中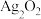 的质量分数
的质量分数
您最近一年使用:0次
2016-12-09更新
|
1400次组卷
|
4卷引用:2011年普通高等学校招生全国统一考试化学卷(江苏)
2011年普通高等学校招生全国统一考试化学卷(江苏)(已下线)2012-2013学年陕西省西安市第一中学高二上学期期末考试理科化学卷(已下线)2014-2015学年河南省南阳市新野三中上学期10月月考高二化学试卷【全国百强校】湖南师范大学附属中学2017-2018学年高一下学期期末考试化学试题
真题
3 . 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是_______________ 。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
(ClO2-)。2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。
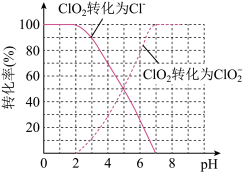
当pH≤2.0时,ClO2-也能被I-还原成Cl-。
反应生成的I2用标准Na2S2O3溶液滴定: Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式______________________ 。
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:______________________ 。
步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水样中ClO2-浓度为_____________ mol·L-1用含字母的代数式表示)
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,该反应的氧化产物是___________ (填化学式)。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
(ClO2-)。2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。

当pH≤2.0时,ClO2-也能被I-还原成Cl-。
反应生成的I2用标准Na2S2O3溶液滴定: Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:
步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水样中ClO2-浓度为
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,该反应的氧化产物是
您最近一年使用:0次
2016-12-09更新
|
242次组卷
|
3卷引用:2009年普通高等学校招生统一考试化学试题(江苏卷)



