解题方法
1 . 某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。
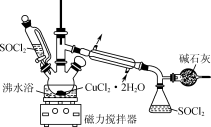
已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈反应生成两种酸性气体。
回答下列问题:
(1)CuCl2·2H2O晶体和SOCl2发生反应的化学方程式是___ 。
(2)碱石灰除了能吸收SO2、HCl等酸性气体,还能起到的作用为__ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,操作步骤如下:
步骤1:取0.2500g试样溶于水,加入过量KI固体充分反应,生成白色CuI沉淀。
步骤2:滴入几滴淀粉溶液。
步骤3:再滴入0.1000mol·L-1Na2S2O3溶液,发生的反应为2S2O32-+I2=S4O62-+2I-,恰好完全反应时,消耗Na2S2O3溶液18.00mL。
①恰好完全反应时的实验现象为__ 。
②计算试样中铜元素的质量分数__ (写出计算过程)。

已知:SOCl2的熔点为-105℃,沸点为76℃,遇水剧烈反应生成两种酸性气体。
回答下列问题:
(1)CuCl2·2H2O晶体和SOCl2发生反应的化学方程式是
(2)碱石灰除了能吸收SO2、HCl等酸性气体,还能起到的作用为
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,操作步骤如下:
步骤1:取0.2500g试样溶于水,加入过量KI固体充分反应,生成白色CuI沉淀。
步骤2:滴入几滴淀粉溶液。
步骤3:再滴入0.1000mol·L-1Na2S2O3溶液,发生的反应为2S2O32-+I2=S4O62-+2I-,恰好完全反应时,消耗Na2S2O3溶液18.00mL。
①恰好完全反应时的实验现象为
②计算试样中铜元素的质量分数
您最近一年使用:0次
2020-03-09更新
|
87次组卷
|
2卷引用:江苏省连云港市2019-2020学年高二学业水平合格性考试模拟试卷(12月) 化学试题
名校
2 . 草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O 是一种光敏材料,见光易分解,下面是一种制备草酸合铁酸钾晶体的实验流程。
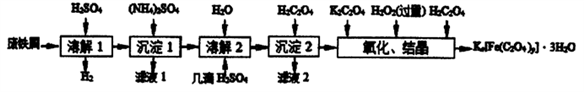
已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是___________________ 。
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、_________ 、过滤、用乙醇洗涤、干燥。用乙醇洗涤的目的是_________ 。
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是_____ 。
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是_________ 。
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为_____ (写出计算过程)。

已知:(NH4)SO4、FeSO4·7H2O、莫尔盐[(NH4)2SO4·FeSO4·6H2O]的溶解度如表:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| (NH4)SO4/g | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 |
| FeSO4·7H2O/g | 40.0 | 48.0 | 60.0 | 73.3 | — |
| (NH4)2SO4·FeSO4·6H2O/g | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 |
(1)废铁屑在进行“溶解1”前,得用在5%Na2CO3溶液中加热数分钟,并洗涤干净.Na2CO3溶液的作用是
(2)“复分解”制备莫尔盐晶体的基本实验步骤是: 蒸发浓缩、
(3)“沉淀2"时得到的FeC2O4·2H2O 沉淀需用水洗涤干净.检验沉淀是否洗涤干净的方法是
(4)“结晶”时应将溶液放在黑暗处等待晶体的析出,这样操作的原因是
(5)为测定该晶体中铁的含量,某实验小组做了如下实验:
步骤1: 准确称量5.00g 草酸合铁酸钾晶体,配制成250mL 溶液
步骤2:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+。向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性。
步骤3:用0.010mol/L KMnO4溶液滴定步骤2所得溶液至终点,消耗KMnO4溶液20.02mL,滴定中MnO4-被还原成Mn2+.重复步骤2、步骤3 操作,滴定消耗 0.010mol/LKMnO4溶液19.98mL,实验测得该晶体中铁的质量分数为
您最近一年使用:0次
3 . 亚硝酸钠( )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:_____ 。
(2)还原:若硝酸在“还原”阶段只生成 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:____ 。
(3)测定产品中 纯度。实验操作如下:
纯度。实验操作如下:
ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: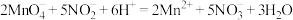 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。
ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会___________ (填“偏大”或“偏小”)。
②该亚硝酸钠晶体产品中可能含有的杂质有:___________ 、 和
和 。
。
③试计算产品中 纯度(即
纯度(即 的质量分数)是
的质量分数)是___________ (写出计算过程)。
 )是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。
)是一种白色结晶状粉末,易溶于水,易被氧化,可用作织物染色的媒染剂、漂白剂等;工业制取亚硝酸钠晶体的基本流程如图所示。现设计相关实验测定其产品纯度。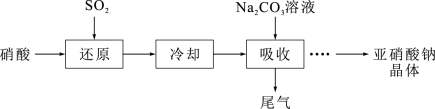
 溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:
溶液从设备顶部以雾状喷下吸收从底部通入的尾气,其优点是:(2)还原:若硝酸在“还原”阶段只生成
 ,则氧化剂与还原剂的物质的量之比为:
,则氧化剂与还原剂的物质的量之比为:(3)测定产品中
 纯度。实验操作如下:
纯度。实验操作如下:ⅰ.用电子天平称取7.500g样品,配成500mL样品溶液。
ⅱ.向锥形瓶中准确移入50.00mL样品溶液,滴加适量的
 溶液酸化,加热至40~50℃,冷却后,用0.10
溶液酸化,加热至40~50℃,冷却后,用0.10
 溶液进行滴定(已知:
溶液进行滴定(已知: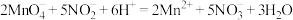 ),至恰好完全反应,消耗
),至恰好完全反应,消耗 溶液40.00mL。
溶液40.00mL。ⅲ.重复滴定三次。
①测定时操作时间不宜过长,否则测定的结果将会
②该亚硝酸钠晶体产品中可能含有的杂质有:
 和
和 。
。③试计算产品中
 纯度(即
纯度(即 的质量分数)是
的质量分数)是
您最近一年使用:0次
2023-12-22更新
|
194次组卷
|
2卷引用: 江苏省盐城市2023-2024学年高二学业水平合格性考试模拟预测化学试题
名校
解题方法
4 . 氯化亚铜(CuCl)微溶于水,易被氧化,广泛应用于医药等行业。以废铜渣(铜单质的质量分数为64%,CuO的质量分数为8%,其他杂质不含铜元素)为原料,可制备CuCl并获得副产品(NH4)2SO4,流程如下:
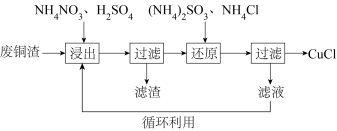
(1)“浸出”时发生的主要反应有:
反应Ⅰ. CuO + H2SO4 = CuSO4 + H2O
反应Ⅱ. 4Cu + NH4NO3 + 5H2SO4 = 4CuSO4 + (NH4)2SO4 + 3H2O
①浸出温度为20℃时,铜元素浸出率随时间的变化如图所示。铜元素浸出率 =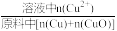 ×100%
×100%

结合图像,从反应速率的角度分析,可得出的结论是_______ 。
②实际浸出温度选择65℃,可提高单位时间内铜元素浸出率。若温度过高,会产生红棕色气体,该气体的化学式为_______ 。
(2)充分浸出后,“还原”时加入的(NH4)2SO3溶液需略过量,“还原”后的滤液经多次循环可提取一定量的(NH4)2SO4(忽略转化流程中杂质参与的反应)。
①“还原”时(NH4)2SO3溶液过量的原因是_______ (写出两点)。
②假设铜元素完全浸出,忽略过量的(NH4)2SO3,计算100 g废铜渣理论上可制得CuCl与(NH4)2SO4的物质的量______ (写出计算过程)。

(1)“浸出”时发生的主要反应有:
反应Ⅰ. CuO + H2SO4 = CuSO4 + H2O
反应Ⅱ. 4Cu + NH4NO3 + 5H2SO4 = 4CuSO4 + (NH4)2SO4 + 3H2O
①浸出温度为20℃时,铜元素浸出率随时间的变化如图所示。铜元素浸出率 =
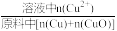 ×100%
×100%
结合图像,从反应速率的角度分析,可得出的结论是
②实际浸出温度选择65℃,可提高单位时间内铜元素浸出率。若温度过高,会产生红棕色气体,该气体的化学式为
(2)充分浸出后,“还原”时加入的(NH4)2SO3溶液需略过量,“还原”后的滤液经多次循环可提取一定量的(NH4)2SO4(忽略转化流程中杂质参与的反应)。
①“还原”时(NH4)2SO3溶液过量的原因是
②假设铜元素完全浸出,忽略过量的(NH4)2SO3,计算100 g废铜渣理论上可制得CuCl与(NH4)2SO4的物质的量
您最近一年使用:0次
2023-04-19更新
|
579次组卷
|
3卷引用:江苏省2023年普通高中学业水平合格性考试化学试题
江苏省2023年普通高中学业水平合格性考试化学试题江苏省盐城市响水中学2023-2024学年高二上学期期中考试化学(必修)试题(已下线)题型三 工艺流程中的答题规范-备战2024年高考化学答题技巧与模板构建
5 . 氯化铜在工农业生产中具有重要的用途。某化学兴趣小组设计如图所示装置,用CuCl2·2H2O晶体和SOCl2获取无水CuCl2并回收过量的SOCl2。回答下列问题:
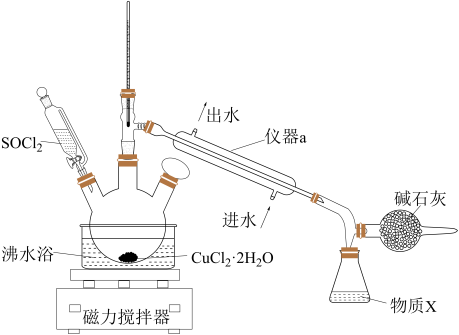
已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑
(1)仪器a的名称是______ ,锥形瓶中得到的物质X的化学式为______ 。
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是______ 。
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2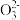 =S4
=S4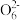 +2I-)。
+2I-)。
①滴定到终点时的现象是______ 。
②该试样中铜元素的百分含量为______ 。

已知:①SOCl2的熔点为-105 ℃,沸点为76 ℃,遇水剧烈水解生成两种酸性气体。②三颈烧瓶中发生反应的化学方程式是CuCl2·2H2O+2SOCl2
 CuCl2+2SO2↑+4HCl↑
CuCl2+2SO2↑+4HCl↑(1)仪器a的名称是
(2)碱石灰中含有CaO和NaOH,碱石灰的作用是
(3)某同学用“间接碘量法”测定无水CuCl2样品中铜元素的百分含量,过程如下:取0.2800 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀。滴入几滴淀粉溶液作指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL(滴定反应为I2+2S2
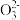 =S4
=S4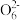 +2I-)。
+2I-)。①滴定到终点时的现象是
②该试样中铜元素的百分含量为
您最近一年使用:0次
2020-12-30更新
|
189次组卷
|
3卷引用:江苏省海安高级中学2020-2021学年高二上学期高中合格性考试化学试题
解题方法
6 . 过氧化钙晶体(CaO2·8H2O)常温下为白色,能溶于酸,难溶于水、乙醇,是一种温和的氧化剂,常用于鱼类长途运输的增氧剂等。
(1)过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。

①装置A中发生反应的化学方程式为_______ ; 仪器X的名称为________ 。
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ.该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.________________________
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为__________________ 。
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴__________ 溶液。
步骤三:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体积为V mL。产品中CaO2·8H2O的质量分数为_________ (用字母表示)[已知: ]
]
(3)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能会生成CaO2。请限用下列试剂,设计实验检验钙在空气中燃烧所得固体中是否含有CaO2:______________ (简要说明实验步骤、现象和结论)。限用试剂:稀盐酸、MnO2。
(1)过氧化钙晶体可用下列方法制备:
CaCl2+H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4Cl。
用如下制取装置制备过氧化钙晶体。

①装置A中发生反应的化学方程式为
②装置C采用冰水浴控制温度在0℃左右,可能的原因主要有:
Ⅰ.该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
Ⅱ.
③反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。检验晶体已洗涤干净的操作为
(2)测定产品中CaO2·8H2O含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入2mol·L—1的硫酸溶液,充分反应。
步骤二:向上述锥形瓶中加入几滴
步骤三:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3溶液体积为V mL。产品中CaO2·8H2O的质量分数为
 ]
](3)钙在空气中燃烧生成氮化钙(Ca3N2),同时可能会生成CaO2。请限用下列试剂,设计实验检验钙在空气中燃烧所得固体中是否含有CaO2:
您最近一年使用:0次
2017-02-27更新
|
230次组卷
|
2卷引用:2016~2017学年江苏省镇江市高二年级学业水平测试(必修)化学试卷



