解题方法
1 . 开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级ZrO2.用锆石ZrSiO4(含少量FeO、Al2O3、SiO2和CuO)制备纳米级ZrO2的流程设计如图:
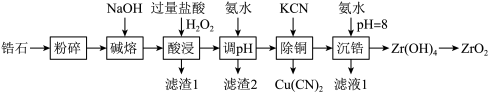
回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为___________ ,锆石杂质中含铁元素,已知Fe2+易被氧化为Fe3+,原因是___________ 。(从原子结构角度解释)
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式___________ 。
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为___________ ,滤渣1经回收加工后有多种用途,写出其中一种___________ 。
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:___________ mol/L。
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式___________ 。
(6)ZrO2的晶胞结构如图所示。
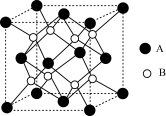
①其中B表示___________ (填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为___________ g/cm3(列算式用NA表示阿伏加德罗常数的值)。

回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式
(6)ZrO2的晶胞结构如图所示。

①其中B表示
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为
您最近一年使用:0次
2024-01-18更新
|
554次组卷
|
2卷引用:河南省商丘市宁陵县东关高中2023-2024学年高二下学期第一次月考 化学试题
名校
2 . I.实验室以K2MnO4为原料,用两种方法制备高锰酸钾。已知:K2MnO4在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应:3 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。
(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知_______ 。
②停止通入CO2,过滤除去_______ (填化学式,下同),将滤液蒸发浓缩、冷却结晶,抽滤得到KMnO4粗品。若CO2通入过多,产品中可能混有的杂质是_______ 。
(2)电解法:实验装置如图。

①阳极的电极反应式为_______ ,阴极产生的气体为_______ (填化学式)。
②与CO2法相比,电解法的主要优点是_______ (写一条)。,
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为_______ 。
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为_______ 。
 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知
②停止通入CO2,过滤除去
(2)电解法:实验装置如图。

①阳极的电极反应式为
②与CO2法相比,电解法的主要优点是
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为
您最近一年使用:0次
3 . I.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2· xH2O) 并测量其结晶水含量。已知: 在pH 为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:

回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A 中Fe2+的试剂____ (填编号)
①KMnO4②K3[Fe(CN)6]③NaOH④KSCN
(2)试剂①是_____ ,试剂②是_____ 。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2· xH2O) 中x的值,某兴趣小组设计了以下实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。沉淀洗涤的操作方法是________ ,根据实验数据测得x=_____ (用含m、n的代数式表示)。
II.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。回答下列问题:

(4)所选仪器接口的连接顺序是A接______,______接______;B接______,______接______;___________ 请用离子方程式说明淀粉KI溶液变蓝的原因_____________________________ 。
(5)若装入的饱和食盐水为75mL (氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL (已转换成标准状况下的体积) 时停止通电。将U 形管内的溶液倒入烧杯,常温时测得溶液的pH 约为___________________ 。

回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A 中Fe2+的试剂
①KMnO4②K3[Fe(CN)6]③NaOH④KSCN
(2)试剂①是
(3)为了测定制得的氯化铜晶体(CuCl2· xH2O) 中x的值,某兴趣小组设计了以下实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。沉淀洗涤的操作方法是
II.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。回答下列问题:

(4)所选仪器接口的连接顺序是A接______,______接______;B接______,______接______;
(5)若装入的饱和食盐水为75mL (氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL (已转换成标准状况下的体积) 时停止通电。将U 形管内的溶液倒入烧杯,常温时测得溶液的pH 约为
您最近一年使用:0次



