名校
解题方法
1 . 某实验小组设计如图所示实验装置来制取乙炔,并粗略测定电石(含有N、P、S等元素)中碳化钙的质量分数。回答下列问题:___________ 。
(2)仪器b中发生反应的化学方程式为___________ ,实验过程中为了减缓水与电石的反应速率,可采取的措施是___________ (写一条即可)。
(3)将生成的气体通入酸性 溶液中,观察到酸性
溶液中,观察到酸性 溶液褪色。
溶液褪色。
___________ (填“能”或“不能”)说明生成的气体全部为乙炔,原因是___________ 。
(4)装置c中盛放的试剂为___________ (填化学式)。
(5)为了安全,点燃乙炔前应___________ ,乙炔燃烧时的现象是___________ 。
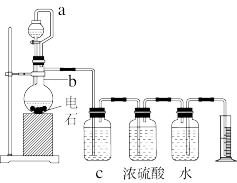
(2)仪器b中发生反应的化学方程式为
(3)将生成的气体通入酸性
 溶液中,观察到酸性
溶液中,观察到酸性 溶液褪色。
溶液褪色。(4)装置c中盛放的试剂为
(5)为了安全,点燃乙炔前应
您最近一年使用:0次
2024-04-03更新
|
335次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二下学期3月月考化学试题
解题方法
2 . 开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级ZrO2.用锆石ZrSiO4(含少量FeO、Al2O3、SiO2和CuO)制备纳米级ZrO2的流程设计如图:
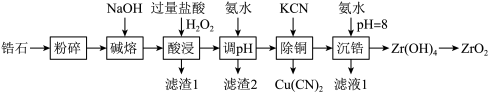
回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为___________ ,锆石杂质中含铁元素,已知Fe2+易被氧化为Fe3+,原因是___________ 。(从原子结构角度解释)
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式___________ 。
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为___________ ,滤渣1经回收加工后有多种用途,写出其中一种___________ 。
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:___________ mol/L。
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式___________ 。
(6)ZrO2的晶胞结构如图所示。
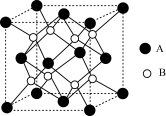
①其中B表示___________ (填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为___________ g/cm3(列算式用NA表示阿伏加德罗常数的值)。

回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式
(6)ZrO2的晶胞结构如图所示。

①其中B表示
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为
您最近一年使用:0次
2024-01-18更新
|
526次组卷
|
2卷引用:河南省商丘市宁陵县东关高中2023-2024学年高二下学期第一次月考 化学试题
名校
3 . 硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为 ,其中硫元素的化合价为
,其中硫元素的化合价为_______ 。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有_______ (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用 作催化剂
作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收
(3)在硫酸工业中,常采用“二转二吸法”,即将第一次转化生成的 分离后,将未转化的
分离后,将未转化的 进行二次转化,假若两次
进行二次转化,假若两次 的转化率均为95%,则最终
的转化率均为95%,则最终 的转化率为
的转化率为___________ 。
(4)工业生产中常用氨酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理(只写出2个方程式即可)___________ 、___________ 。
(1)工业制硫酸时所用硫铁矿的主要成分为
 ,其中硫元素的化合价为
,其中硫元素的化合价为(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有
A.矿石加入沸腾炉之前先粉碎 B.使用
 作催化剂
作催化剂C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收

(3)在硫酸工业中,常采用“二转二吸法”,即将第一次转化生成的
 分离后,将未转化的
分离后,将未转化的 进行二次转化,假若两次
进行二次转化,假若两次 的转化率均为95%,则最终
的转化率均为95%,则最终 的转化率为
的转化率为(4)工业生产中常用氨酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理(只写出2个方程式即可)
您最近一年使用:0次
名校
解题方法
4 . 有机物样品在如图电炉中充分燃烧,通过测定生成的 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
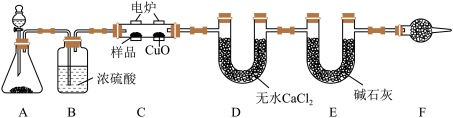
请回答下列问题:
(1)锥形瓶内的固体 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是___________ 。
(2)C装置中CuO的作用是___________ ,F装置内的试剂为___________ ,F装置的作用为___________ 。
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为___________ ,若该有机物的密度是相同条件下 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为___________ 。若该物质是一种能与Na反应的链状有机物,则它的结构简式为___________ 。
(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会___________ (填“偏大”、“偏小”或“不变”)。
 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
请回答下列问题:
(1)锥形瓶内的固体
 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是(2)C装置中CuO的作用是
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为
 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会
您最近一年使用:0次
5 .  的转化是资源利用和环境保护的重要研究课题。
的转化是资源利用和环境保护的重要研究课题。
(1)通过电化学循环法可将 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: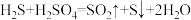 、
、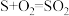 。
。
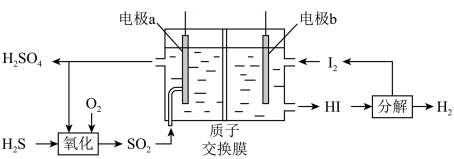
①电极a上发生反应的电极反应式为_______ 。
②理论上1mol 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为_______ 。
(2) 可用作脱除
可用作脱除 气体的脱硫剂。以赤铁矿渣(主要成分为
气体的脱硫剂。以赤铁矿渣(主要成分为 、
、 和少量
和少量 )为原料制备
)为原料制备 晶体,已知
晶体,已知 易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣,
易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣,_______ ,向滤液中加乙醇,在恒温水浴槽中冷却结晶,过滤,用丙酮洗涤,干燥。(已知该实验中pH=3.5时, 沉淀完全;pH=4.1时,
沉淀完全;pH=4.1时, 开始沉淀。实验中必须使用的试剂:1.0
开始沉淀。实验中必须使用的试剂:1.0
 、1.0
、1.0 NaOH、铁粉。)
NaOH、铁粉。)
 的转化是资源利用和环境保护的重要研究课题。
的转化是资源利用和环境保护的重要研究课题。(1)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: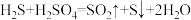 、
、 。
。
①电极a上发生反应的电极反应式为
②理论上1mol
 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(2)
 可用作脱除
可用作脱除 气体的脱硫剂。以赤铁矿渣(主要成分为
气体的脱硫剂。以赤铁矿渣(主要成分为 、
、 和少量
和少量 )为原料制备
)为原料制备 晶体,已知
晶体,已知 易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣,
易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣, 沉淀完全;pH=4.1时,
沉淀完全;pH=4.1时, 开始沉淀。实验中必须使用的试剂:1.0
开始沉淀。实验中必须使用的试剂:1.0
 、1.0
、1.0 NaOH、铁粉。)
NaOH、铁粉。)
您最近一年使用:0次
6 . 有机化合物A常用于配制香水、精油,为测定A的结构,某化学兴趣小组进行如下实验。回答下列问题:
(1)13.6g有机物A置于氧气流中充分燃烧,生成17.92L (标准状况)和7.2g
(标准状况)和7.2g ,通过质谱仪测得A的相对分子质量为136,则A的分子式为
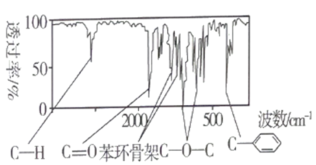
,通过质谱仪测得A的相对分子质量为136,则A的分子式为_______ 。有机物A的红外光谱如图所示,则A可能的结构简式为_______ 、_______ 。
(2)请设计简单实验,确定A的结构简式_______ 。(可选用的试剂:银氨溶液,氢氧化钠溶液,稀硫酸,限选一种试剂)
(3)探究制备A的最佳反应条件:
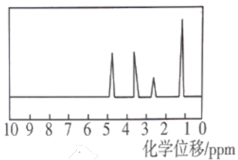
①该小组成员通过核磁共振仪测定A的核磁共振氢谱如图所示。在实验室中,利用有机酸B和醇C,通过酯化反应制备A的化学方程式为_______ 。反应结束后,可用_______ (填序号)洗涤粗产品A。
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇 D.水
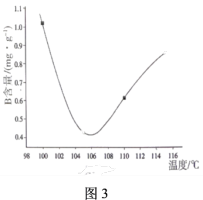
②该小组通过监测混合物中有机酸B的含量,探究制备A的最佳反应温度。已知:A、B、C的熔沸点如表-1所示,有机酸B的含量如图3。该反应的最佳温度为_______ (填序号)。温度超过106℃后,B的含量逐渐增大的原因为_______ 。
A.100℃ B.106℃ C.116℃
(1)13.6g有机物A置于氧气流中充分燃烧,生成17.92L
 (标准状况)和7.2g
(标准状况)和7.2g ,通过质谱仪测得A的相对分子质量为136,则A的分子式为
,通过质谱仪测得A的相对分子质量为136,则A的分子式为
(2)请设计简单实验,确定A的结构简式
(3)探究制备A的最佳反应条件:
①该小组成员通过核磁共振仪测定A的核磁共振氢谱如图所示。在实验室中,利用有机酸B和醇C,通过酯化反应制备A的化学方程式为

A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇 D.水
②该小组通过监测混合物中有机酸B的含量,探究制备A的最佳反应温度。已知:A、B、C的熔沸点如表-1所示,有机酸B的含量如图3。该反应的最佳温度为
| 物质 | 熔点 | 沸点 |
| A | -12.3 | 199.6 |
| B | 122.4 | 249 |
| C | - 97 | 64.3 |

A.100℃ B.106℃ C.116℃
您最近一年使用:0次
解题方法
7 . 二氧化氯(ClO2)是一种高效的灭菌消毒剂,受热或浓度过大时易发生分解甚至爆炸。工业上常将ClO2制备成NaClO2固体以便运输和贮存,流程如下:
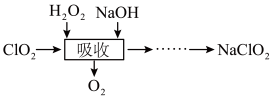
(1)“吸收”过程中发生反应的离子方程式是_______ 。
(2)“吸收”过程,温度控制在25℃的目的是_______ (填字母)。
a.保持适当的反应速率 b.促进H2O2分解 c.防止温度过高引起爆炸
(3)NaClO2的溶解度曲线如图所示,由NaClO2溶液得到无水NaClO2的操作如下:

①减压,55℃蒸发结晶;
②_______ ;
③38℃~60℃热水洗涤;
④低于60℃干燥。

(1)“吸收”过程中发生反应的离子方程式是
(2)“吸收”过程,温度控制在25℃的目的是
a.保持适当的反应速率 b.促进H2O2分解 c.防止温度过高引起爆炸
(3)NaClO2的溶解度曲线如图所示,由NaClO2溶液得到无水NaClO2的操作如下:

①减压,55℃蒸发结晶;
②
③38℃~60℃热水洗涤;
④低于60℃干燥。
您最近一年使用:0次
名校
8 . I.实验室以K2MnO4为原料,用两种方法制备高锰酸钾。已知:K2MnO4在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应:3 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。
(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知_______ 。
②停止通入CO2,过滤除去_______ (填化学式,下同),将滤液蒸发浓缩、冷却结晶,抽滤得到KMnO4粗品。若CO2通入过多,产品中可能混有的杂质是_______ 。
(2)电解法:实验装置如图。

①阳极的电极反应式为_______ ,阴极产生的气体为_______ (填化学式)。
②与CO2法相比,电解法的主要优点是_______ (写一条)。,
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为_______ 。
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为_______ 。
 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知
②停止通入CO2,过滤除去
(2)电解法:实验装置如图。

①阳极的电极反应式为
②与CO2法相比,电解法的主要优点是
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为
您最近一年使用:0次
20-21高二下·浙江·阶段练习
解题方法
9 . I.电镀废水中常含有阴离子A,排放前可加CuSO4溶液处理,使之转化为沉淀B,按如图流程进行实验。
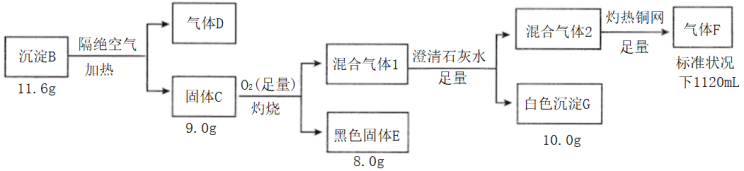
已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是___ 气体,D的分子式是___ 。
(2)写出C足量氧气中灼烧的方程式是___ 。
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是___ 。
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。
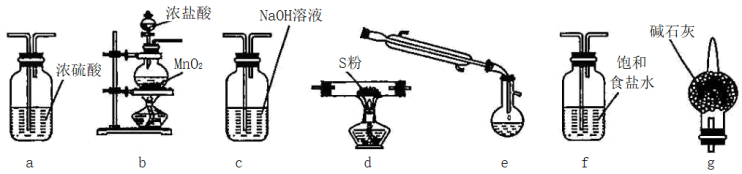
请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2___ 。
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___ 。

已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是
(2)写出C足量氧气中灼烧的方程式是
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。

请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式
您最近一年使用:0次
10 . 铁酸H2FeO4是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)H2FeO4中Fe的化合价为________ 。
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为________ 。
(3)在工业上制备H2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:2FeSO4+6Na2O2=aNa2FeO4+bM↑+2Na2O+2Na2SO4
①b=________ 。
②每生成1molM,该反应转移电子的物质的量为________ mol。
Ⅱ.湿法制备的工艺流程如下;
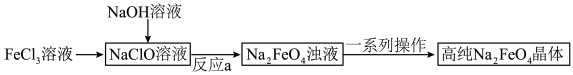
已知:H2FeO4在强碱性溶液中的溶解度较小,高温易分解。
③反应a中,生成物除了H2FeO4外,另一种盐的化学式为________ 。
④一系列操作包括过滤、________ 、________ 。
(1)H2FeO4中Fe的化合价为
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为
(3)在工业上制备H2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:2FeSO4+6Na2O2=aNa2FeO4+bM↑+2Na2O+2Na2SO4
①b=
②每生成1molM,该反应转移电子的物质的量为
Ⅱ.湿法制备的工艺流程如下;
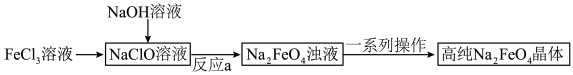
已知:H2FeO4在强碱性溶液中的溶解度较小,高温易分解。
③反应a中,生成物除了H2FeO4外,另一种盐的化学式为
④一系列操作包括过滤、
您最近一年使用:0次



