名校
解题方法
1 . 某实验小组设计如图所示实验装置来制取乙炔,并粗略测定电石(含有N、P、S等元素)中碳化钙的质量分数。回答下列问题:___________ 。
(2)仪器b中发生反应的化学方程式为___________ ,实验过程中为了减缓水与电石的反应速率,可采取的措施是___________ (写一条即可)。
(3)将生成的气体通入酸性 溶液中,观察到酸性
溶液中,观察到酸性 溶液褪色。
溶液褪色。
___________ (填“能”或“不能”)说明生成的气体全部为乙炔,原因是___________ 。
(4)装置c中盛放的试剂为___________ (填化学式)。
(5)为了安全,点燃乙炔前应___________ ,乙炔燃烧时的现象是___________ 。
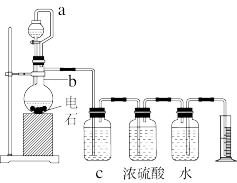
(2)仪器b中发生反应的化学方程式为
(3)将生成的气体通入酸性
 溶液中,观察到酸性
溶液中,观察到酸性 溶液褪色。
溶液褪色。(4)装置c中盛放的试剂为
(5)为了安全,点燃乙炔前应
您最近一年使用:0次
2024-04-03更新
|
400次组卷
|
2卷引用:辽宁省朝阳市建平县实验中学2023-2024学年高二下学期3月月考化学试题
解题方法
2 . 开发新型材料是现在科学研究的一项重要工作,科学家开发一种形状记忆陶瓷,它的主要原材料是纳米级ZrO2.用锆石ZrSiO4(含少量FeO、Al2O3、SiO2和CuO)制备纳米级ZrO2的流程设计如图:
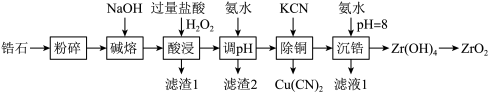
回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为___________ ,锆石杂质中含铁元素,已知Fe2+易被氧化为Fe3+,原因是___________ 。(从原子结构角度解释)
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式___________ 。
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为___________ ,滤渣1经回收加工后有多种用途,写出其中一种___________ 。
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:___________ mol/L。
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式___________ 。
(6)ZrO2的晶胞结构如图所示。
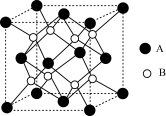
①其中B表示___________ (填O2-或Zr4+)。
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为___________ g/cm3(列算式用NA表示阿伏加德罗常数的值)。

回答下列问题:
(1)锆石杂质中含锆元素,基态Cu的价电子排布式为
(2)碱熔过程中有多种物质能发生反应,写出其中一个反应方程式
(3)“酸浸”过程中FeO发生氧化还原反应的离子方程式为
(4)久置H2O2浓度需要标定。取xmLH2O2溶液,用amol/LCe(SO4)2溶液滴定H2O2,完全反应转化为Ce2(SO4)3时,消耗bmLCe(SO4)2溶液。则H2O2溶液的浓度为:
(5)易溶氰化物有剧毒,需对滤液1中的氰化物进行处理,选用次氯酸钠溶液在碱性条件下将其氧化,其中一种产物为空气的主要成分,写出其离子反应方程式
(6)ZrO2的晶胞结构如图所示。

①其中B表示
②ZrO2晶胞的棱长分别为anm、anm、cnm,其晶体密度为
您最近一年使用:0次
2024-01-18更新
|
564次组卷
|
2卷引用:河南省商丘市宁陵县东关高中2023-2024学年高二下学期第一次月考 化学试题
名校
解题方法
3 . 有机物样品在如图电炉中充分燃烧,通过测定生成的 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
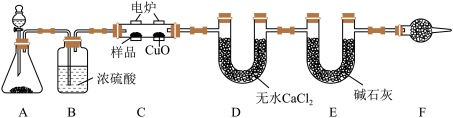
请回答下列问题:
(1)锥形瓶内的固体 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是___________ 。
(2)C装置中CuO的作用是___________ ,F装置内的试剂为___________ ,F装置的作用为___________ 。
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为___________ ,若该有机物的密度是相同条件下 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为___________ 。若该物质是一种能与Na反应的链状有机物,则它的结构简式为___________ 。
(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会___________ (填“偏大”、“偏小”或“不变”)。
 和
和 的质量,来确定有机物的分子式。
的质量,来确定有机物的分子式。
请回答下列问题:
(1)锥形瓶内的固体
 作催化剂,还可以作为该反应催化剂的是
作催化剂,还可以作为该反应催化剂的是(2)C装置中CuO的作用是
(3)准确称取11.6g样品,充分反应后,D装置质量增加10.8g,E装置质量增加26.4g,则该样品的最简式为
 的29倍,且能发生银镜反应,则其结构简式为
的29倍,且能发生银镜反应,则其结构简式为(4)若少了B装置,则所得样品的分子式中氢元素的质量分数会
您最近一年使用:0次
4 .  的转化是资源利用和环境保护的重要研究课题。
的转化是资源利用和环境保护的重要研究课题。
(1)通过电化学循环法可将 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: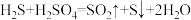 、
、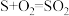 。
。
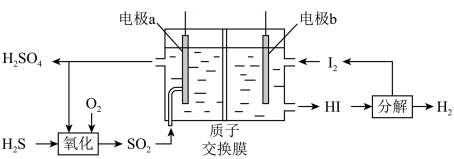
①电极a上发生反应的电极反应式为_______ 。
②理论上1mol 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为_______ 。
(2) 可用作脱除
可用作脱除 气体的脱硫剂。以赤铁矿渣(主要成分为
气体的脱硫剂。以赤铁矿渣(主要成分为 、
、 和少量
和少量 )为原料制备
)为原料制备 晶体,已知
晶体,已知 易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣,
易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣,_______ ,向滤液中加乙醇,在恒温水浴槽中冷却结晶,过滤,用丙酮洗涤,干燥。(已知该实验中pH=3.5时, 沉淀完全;pH=4.1时,
沉淀完全;pH=4.1时, 开始沉淀。实验中必须使用的试剂:1.0
开始沉淀。实验中必须使用的试剂:1.0
 、1.0
、1.0 NaOH、铁粉。)
NaOH、铁粉。)
 的转化是资源利用和环境保护的重要研究课题。
的转化是资源利用和环境保护的重要研究课题。(1)通过电化学循环法可将
 转化为
转化为 和
和 (如图所示)。其中氧化过程发生如下两步反应:
(如图所示)。其中氧化过程发生如下两步反应: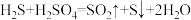 、
、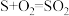 。
。
①电极a上发生反应的电极反应式为
②理论上1mol
 参加反应可产生
参加反应可产生 的物质的量为
的物质的量为(2)
 可用作脱除
可用作脱除 气体的脱硫剂。以赤铁矿渣(主要成分为
气体的脱硫剂。以赤铁矿渣(主要成分为 、
、 和少量
和少量 )为原料制备
)为原料制备 晶体,已知
晶体,已知 易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣,
易溶于水难溶于乙醇,请补充完整相应的实验方案:取一定量的赤铁矿渣, 沉淀完全;pH=4.1时,
沉淀完全;pH=4.1时, 开始沉淀。实验中必须使用的试剂:1.0
开始沉淀。实验中必须使用的试剂:1.0
 、1.0
、1.0 NaOH、铁粉。)
NaOH、铁粉。)
您最近一年使用:0次
5 . 有机化合物A常用于配制香水、精油,为测定A的结构,某化学兴趣小组进行如下实验。回答下列问题:
(1)13.6g有机物A置于氧气流中充分燃烧,生成17.92L (标准状况)和7.2g
(标准状况)和7.2g ,通过质谱仪测得A的相对分子质量为136,则A的分子式为
,通过质谱仪测得A的相对分子质量为136,则A的分子式为_______ 。有机物A的红外光谱如图所示,则A可能的结构简式为_______ 、_______ 。
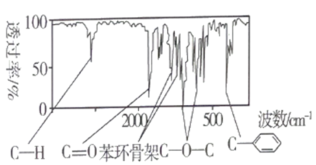
(2)请设计简单实验,确定A的结构简式_______ 。(可选用的试剂:银氨溶液,氢氧化钠溶液,稀硫酸,限选一种试剂)
(3)探究制备A的最佳反应条件:
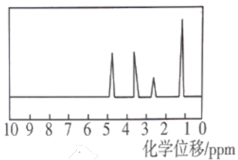
①该小组成员通过核磁共振仪测定A的核磁共振氢谱如图所示。在实验室中,利用有机酸B和醇C,通过酯化反应制备A的化学方程式为_______ 。反应结束后,可用_______ (填序号)洗涤粗产品A。
A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇 D.水
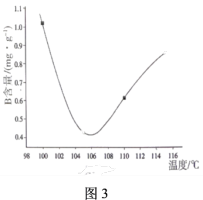
②该小组通过监测混合物中有机酸B的含量,探究制备A的最佳反应温度。已知:A、B、C的熔沸点如表-1所示,有机酸B的含量如图3。该反应的最佳温度为_______ (填序号)。温度超过106℃后,B的含量逐渐增大的原因为_______ 。
A.100℃ B.106℃ C.116℃
(1)13.6g有机物A置于氧气流中充分燃烧,生成17.92L
 (标准状况)和7.2g
(标准状况)和7.2g ,通过质谱仪测得A的相对分子质量为136,则A的分子式为
,通过质谱仪测得A的相对分子质量为136,则A的分子式为
(2)请设计简单实验,确定A的结构简式
(3)探究制备A的最佳反应条件:
①该小组成员通过核磁共振仪测定A的核磁共振氢谱如图所示。在实验室中,利用有机酸B和醇C,通过酯化反应制备A的化学方程式为

A.稀硫酸 B.饱和碳酸钠溶液 C.乙醇 D.水
②该小组通过监测混合物中有机酸B的含量,探究制备A的最佳反应温度。已知:A、B、C的熔沸点如表-1所示,有机酸B的含量如图3。该反应的最佳温度为
| 物质 | 熔点 | 沸点 |
| A | -12.3 | 199.6 |
| B | 122.4 | 249 |
| C | - 97 | 64.3 |

A.100℃ B.106℃ C.116℃
您最近一年使用:0次
20-21高二下·浙江·阶段练习
解题方法
6 . I.电镀废水中常含有阴离子A,排放前可加CuSO4溶液处理,使之转化为沉淀B,按如图流程进行实验。
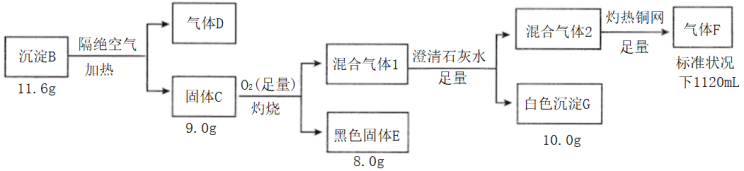
已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是___ 气体,D的分子式是___ 。
(2)写出C足量氧气中灼烧的方程式是___ 。
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是___ 。
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。
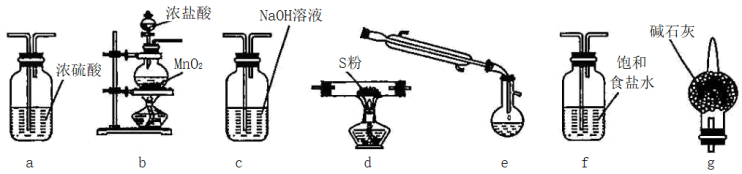
请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2___ 。
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___ 。

已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是
(2)写出C足量氧气中灼烧的方程式是
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。

请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式
您最近一年使用:0次
7 . 铁酸H2FeO4是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)H2FeO4中Fe的化合价为________ 。
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为________ 。
(3)在工业上制备H2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:2FeSO4+6Na2O2=aNa2FeO4+bM↑+2Na2O+2Na2SO4
①b=________ 。
②每生成1molM,该反应转移电子的物质的量为________ mol。
Ⅱ.湿法制备的工艺流程如下;
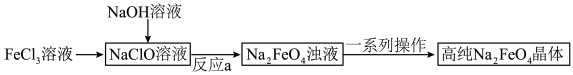
已知:H2FeO4在强碱性溶液中的溶解度较小,高温易分解。
③反应a中,生成物除了H2FeO4外,另一种盐的化学式为________ 。
④一系列操作包括过滤、________ 、________ 。
(1)H2FeO4中Fe的化合价为
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为
(3)在工业上制备H2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:2FeSO4+6Na2O2=aNa2FeO4+bM↑+2Na2O+2Na2SO4
①b=
②每生成1molM,该反应转移电子的物质的量为
Ⅱ.湿法制备的工艺流程如下;
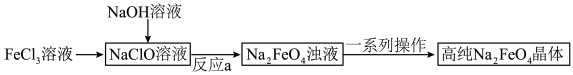
已知:H2FeO4在强碱性溶液中的溶解度较小,高温易分解。
③反应a中,生成物除了H2FeO4外,另一种盐的化学式为
④一系列操作包括过滤、
您最近一年使用:0次
名校
解题方法
8 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
783次组卷
|
10卷引用:广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题
广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题河南省顶级名校2023届高三上学期10月月考化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷2021年河北省高考化学试卷变式题10-18题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第1讲 钠及其重要化合物
11-12高二下·安徽六安·课时练习
名校
9 . 工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?___ ,理由是___ 。
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是____ 。(填序号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?___ ,理由是___ 。
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有___ (多选)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有___ (多选)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
您最近一年使用:0次
2019-11-06更新
|
349次组卷
|
6卷引用:江苏省南京师大苏州实验学校2019-2020学年高二9月月考化学试题
江苏省南京师大苏州实验学校2019-2020学年高二9月月考化学试题(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试5化学试卷(已下线)2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷福建省宁德市2017-2018学年高二上学期期末模拟质量检测化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题
名校
10 . 碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
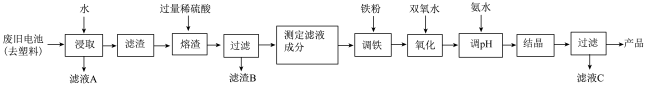
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________ 。
(2)滤液A中溶质的电子式为___________ 。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:___________________________________ 。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:__________________ 、_______________ 。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为___________ kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化”工序中,加入双氧水的目的是_________________ ,生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________ 。
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_____________ 。

(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为
(2)滤液A中溶质的电子式为
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为
(5)在“氧化”工序中,加入双氧水的目的是
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为
您最近一年使用:0次
2019-07-04更新
|
253次组卷
|
2卷引用:四川省成都市蒲江县蒲江中学2021-2022学年高二下学期5月月考化学试题



