辽宁省大连市第四十八中学2019届高三高考考前模拟理综化学试题
辽宁
高三
对口高考
2021-09-30
228次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、有机化学基础、物质结构与性质、化学实验基础
辽宁省大连市第四十八中学2019届高三高考考前模拟理综化学试题
辽宁
高三
对口高考
2021-09-30
228次
整体难度:
适中
考查范围:
化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、有机化学基础、物质结构与性质、化学实验基础
一、单选题 添加题型下试题
单选题
|
较难(0.4)
名校
1. 化学与生活紧密联系在一起,下列说法不正确的是
| A.工业制粗硅、电镀、钢铁的锈蚀、制玻璃均发生氧化还原反应 |
| B.医院里的血液透析利用了胶体的性质 |
| C.“天宫一号”中使用的碳纤维,是一种新型无机非金属材料 |
| D.天然气、瓦斯等气体及面粉、煤粉等固体粉尘都容易发生爆炸 |
【知识点】 化学科学对人类文明发展的意义解读 无机非金属材料
您最近一年使用:0次
单选题
|
较易(0.85)
名校
2. NA代表阿伏加 德罗常数的值,下列有关叙述正确的是
| A.标准状况下,铁在22.4L氯气中完全燃烧时转移电子数为3NA |
| B.1 L 0.1 mol·L−1的NaHCO3溶液中HCO3−和CO32-离子数之和为0.1NA |
| C.常温常压下,NO2与N2O4的混合气体46g,所含氧原子数为2NA |
| D.含有NA个Fe(OH)3胶粒的氢氧化铁胶体中,铁元素的质量为56g |
您最近一年使用:0次
2019-07-04更新
|
67次组卷
|
2卷引用:安徽省太和第一中学2019-2020学年高二下学期教学衔接调研考试(飞越班)化学试题
单选题
|
较难(0.4)
名校
3. 由下列实验及现象推出的相应结论正确的是
| 实验 | 现象 | 结论 | |
| A | 向某溶液中加入NaOH稀溶液,管口放置湿润的红色石蕊试纸 | 试纸不变色 | 原溶液中一定没有NH4+ |
| B | 向某溶液中滴加K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | 该溶液中含有Fe2+ |
| C | 将乙醇和浓硫酸混合加热产生的气体通入酸性高锰酸钾溶液中 | 溶液褪为无色 | 产生的气体中含有乙烯 |
| D | 向4mL0.1mol/LNa2S溶液中滴入几滴0.1mol/L ZnCl2溶液,再加入CuSO4溶液 | 先产生白色沉淀,后产生黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
较易(0.85)
名校
4. 短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可与其最高价氧化物的水化物反应生成盐,Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的某一种盐加入稀盐酸后,有黄色沉淀析出,同时有刺激性气味气体产生。下列说法正确的是
| A.W、X、Y、Z的简单离子的半径依次增大 |
| B.简单氢化物的热稳定性:X<W |
| C.ZX2可以在空气中燃烧,生成ZX3 |
| D.W所形成的一种氢化物可用作火箭燃料 |
您最近一年使用:0次
2019-07-04更新
|
201次组卷
|
3卷引用:湖南师范大学附属中学2019-2020学年高一下学期期末考试化学试题
单选题
|
适中(0.65)
名校
5. 某有机物X的结构如图所示,下列说法正确的是
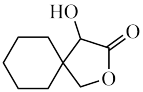
| A.X的分子式为C9H12O3 |
| B.X中所有碳原子均可能共面 |
| C.X可与氧气发生催化氧化反应 |
| D.1molX最多能消耗2 mol NaOH |
您最近一年使用:0次
2019-03-14更新
|
1029次组卷
|
7卷引用:【市级联考】山东省菏泽市2019届高三下学期第一次模拟考试理科综合化学试题
单选题
|
适中(0.65)
名校
6. 用石墨烯锂硫电池电解制备Fe(OH)2的装置如图所示。电池放电时的反应为:16Li+xS8=8Li2Sx(2≤x≤8),电解池两极材料分别为Fe和石墨,工作一段时间后,右侧玻璃管中产生大量的白色沉淀。下列说法不正确的是
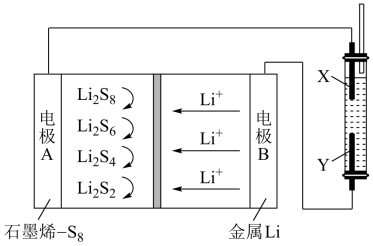

| A.X是铁电极,发生氧化反应 |
| B.电子流动的方向:B→Y,X→A |
| C.正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 |
| D.锂电极减重0.14g时,电解池中溶液减重0.18g |
您最近一年使用:0次
2019-03-14更新
|
710次组卷
|
7卷引用:【市级联考】山东省菏泽市2019届高三下学期第一次模拟考试理科综合化学试题
【市级联考】山东省菏泽市2019届高三下学期第一次模拟考试理科综合化学试题山东省泰安市2021届高考第一次模拟化学试题(已下线)专题六 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)辽宁省大连市第四十八中学2019届高三高考考前模拟理综化学试题(已下线)专题08 电化学及其应用-备战2022年高考化学真题及地市好题专项集训【山东专用】江西省宜春市万载中学2021-2022学年高二上学期第二次月考化学试题山东省济南大学城实验高中2021-2022学年高三2月阶段性调研化学试题
单选题
|
适中(0.65)
名校
7. 25℃时,向10mL0.1mol·L-1一元弱碱XOH溶液中逐滴滴加0.1mol·L-1的盐酸,溶液的AG[AG=lg ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法错误 的是
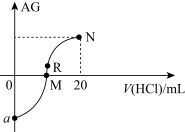
 ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法
| A.若a=-8,则Kb(XOH)=10-5 |
| B.M点表示盐酸和XOH恰好完全反应 |
| C.M点到N点,水的电离程度先增大后减小 |
| D.R点溶液中可能存在c(X+)+c(XOH)=c(Cl-) |
您最近一年使用:0次
2020-12-15更新
|
524次组卷
|
15卷引用:【市级联考】山东省菏泽市2019届高三下学期第一次模拟考试理科综合化学试题
【市级联考】山东省菏泽市2019届高三下学期第一次模拟考试理科综合化学试题【校级联考】河北省中原名校联盟2019届高三下学期3月联考理科综合化学试题四川省绵阳南山中学2020届高三下学期3月网络考试化学试题福建省漳州市2020届高中毕业班第二次高考适应性测试理综化学试题聊城一中2020届高三4月份线上模拟化学试题四川省内江市2020届高三下学期3月网络自测化学试题(已下线)考点12 盐类水解及其应用-2020年高考化学命题预测与模拟试题分类精编山东师范大学附属中学2020届普通高等学校招生全国统一考试化学试题(模拟一)甘肃省兰州市第一中学2020届高三冲刺模拟考试(一)理科综合化学试题 福建省莆田市第二中学2021届高三10月月考化学试题辽宁省大连市一〇三中学2021届高三上学期第二阶段模拟考试化学试题四川省内江市威远中学2021届高三3月月考化学试题解题达人.化学选择题(2021全国卷)巩固小卷04辽宁省大连市第四十八中学2019届高三高考考前模拟理综化学试题四川省泸县第五中学2022届高三三诊模拟考试理科综合化学试题
二、解答题 添加题型下试题
解答题-实验探究题
|
适中(0.65)
名校
8. 二氧化氯是高效、低毒的消毒剂。已知:ClO2是一种黄绿色易溶于水的气体,具有强氧化性,回答下列问题:
(1)ClO2的制备及性质探究(如图所示)。

①仪器a的名称为________ ,装置B的作用是________ 。
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为_________ 。装置D中滴有几滴淀粉溶液,其作用是________________ 。
③装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为________ ,氧化产物是___________ 。
(2)粗略测定生成ClO2的量
实验步骤如下:
a. 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤D瓶2~3次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b. 从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去24.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是_____________ 。
②进入装置D中的ClO2质量为_______ ,与C中ClO2的理论产量相比,测定值偏低,可能的原因是__________ 。
(1)ClO2的制备及性质探究(如图所示)。

①仪器a的名称为
②装置C用于制备ClO2,同时还生成一种酸式盐,该反应的化学方程式为
③装置E用于吸收尾气,反应生成NaClO2,则该反应中氧化剂与还原剂的物质的量之比为
(2)粗略测定生成ClO2的量
实验步骤如下:
a. 取下装置D,将其中的溶液转入250mL容量瓶,用蒸馏水洗涤D瓶2~3次,并将洗涤液一并转移到容量瓶中,再用蒸馏水稀释至刻度。
b. 从容量瓶中取出25.00mL溶液于锥形瓶中,用0.1000mol/L硫代硫酸钠标准溶液滴定(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去24.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是
②进入装置D中的ClO2质量为
【知识点】 氧化还原反应有关计算 仪器使用与实验安全 物质含量的测定 物质制备的探究解读
您最近一年使用:0次
2019-01-14更新
|
671次组卷
|
4卷引用:四川省绵阳市2019届高三上学期第二次(1月)诊断性考试理科综合化学试题
三、填空题 添加题型下试题
填空题
|
困难(0.15)
名校
9. 碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
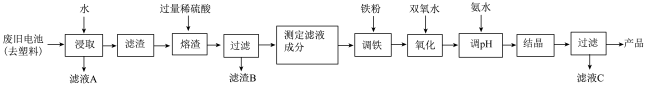
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________ 。
(2)滤液A中溶质的电子式为___________ 。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:___________________________________ 。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:__________________ 、_______________ 。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为___________ kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化”工序中,加入双氧水的目的是_________________ ,生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________ 。
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_____________ 。

(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为
(2)滤液A中溶质的电子式为
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为
(5)在“氧化”工序中,加入双氧水的目的是
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为
您最近一年使用:0次
2019-07-04更新
|
255次组卷
|
2卷引用:辽宁省大连市第四十八中学2019届高三高考考前模拟理综化学试题
四、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
名校
解题方法
10. 二甲醚又称甲醚,简称 DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g) CH3OH(g) △H1= -90.0kJ·mol-1
CH3OH(g) △H1= -90.0kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -20.0kJ·mol-1
CH3OCH3(g)+H2O(g) △H2= -20.0kJ·mol-1
回答下列问题:
(1)已知:H2O(1)=H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2)制备1molCH3OCH3(g),且生成H2O(1),其热化学方程式为____________________________________________ 。
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6mol H2,5min达到平衡,平衡时测得c(H2)=1.8mol·L-1,c(CH3OCH3)=0.2mol·L-1,此时 CO的转化率为________ 。用CH3OH表示反应①的速率是_______ mol·L-1min-1,可逆反应②的平衡常数K2 = _________ 。
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,则下列说法正中确的是_________ 。
A 平衡向正反应方向移动 B 平衡移动的原因是升高了温度
C 达到新平衡后体系的压强不变 D 容器中 CH3OCH3的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a=________ (填数值)。

(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为熔融态的碳酸盐(如熔融K2CO3),其中CO2会参与电极反应。工作时负极的电极反应式为_________________ 。
①CO(g)+2H2(g)
 CH3OH(g) △H1= -90.0kJ·mol-1
CH3OH(g) △H1= -90.0kJ·mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2= -20.0kJ·mol-1
CH3OCH3(g)+H2O(g) △H2= -20.0kJ·mol-1回答下列问题:
(1)已知:H2O(1)=H2O(g) △H= +44.0kJ/mol,若由合成气(CO、H2)制备1molCH3OCH3(g),且生成H2O(1),其热化学方程式为
(2)有人模拟该制备原理:500K时,在2L的密闭容器中充入2mol CO和6mol H2,5min达到平衡,平衡时测得c(H2)=1.8mol·L-1,c(CH3OCH3)=0.2mol·L-1,此时 CO的转化率为
(3)在体积一定的密闭容器中发生反应②,如果该反应的平衡常数K2值变小,则下列说法正中确的是
A 平衡向正反应方向移动 B 平衡移动的原因是升高了温度
C 达到新平衡后体系的压强不变 D 容器中 CH3OCH3的体积分数减小
(4)一定条件下在恒温恒容的密闭容器中,按不同投料比充入CO(g)和H2(g)进行反应①,平衡时CO(g)和H2(g)的转化率如图所示,则a=

(5)绿色电源“二甲醚燃料电池”的结构如图所示,电解质为熔融态的碳酸盐(如熔融K2CO3),其中CO2会参与电极反应。工作时负极的电极反应式为
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
困难(0.15)
名校
11. 电池在人类生产生活中具有十分重要的作用,其中锂离子电池与太阳能电池占有很大比重。太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置。其材料有单晶硅,还有铜、锗、镓、硒等化合物。

(1)基态亚铜离子中电子占据的原子轨道数目为____________ 。
(2)若基态硒原子价层电子排布式写成4s24px24py4,则其违背了____________ 。
(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是____________ (填标号)。
(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为________ ,该分子其中心原子的杂化类型为________ 。写出一种与Q互为等电子体的离子________ 。
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4] ·8H2O.其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是____________ (填选项字母)。

A 离子键 B 共价键 C 金属键 D 范德华力 E 氢键
(6)GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。

已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为___________ ,GaAs的熔点________ (填“高于”或“低于”)GaN。Ga和As的摩尔质量分别为MGa g•mol−1和MAs g•mol−1,原子半径分别为rGa pm和rAs pm,阿伏加 德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为______________ 。

(1)基态亚铜离子中电子占据的原子轨道数目为
(2)若基态硒原子价层电子排布式写成4s24px24py4,则其违背了
(3)下图表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷的曲线是
(4)元素X与硅同主族且原子半径最小,X形成的最简单氢化物Q的电子式为
(5)与镓元素处于同一主族的硼元素具有缺电子性。自然界中含硼元素的钠盐是一种天然矿藏,其化学式写作Na2B4O7·10H2O,实际上它的结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,应该写成Na2[B4O5(OH)4] ·8H2O.其结构如图所示,它的阴离子可形成链状结构,则该晶体中不存在的作用力是

A 离子键 B 共价键 C 金属键 D 范德华力 E 氢键
(6)GaAs的熔点为1238℃,密度为ρg·cm−3,其晶胞结构如图所示。

已知GaAs与GaN具有相同的晶胞结构,则二者晶体的类型均为
您最近一年使用:0次
填空题
|
较难(0.4)
名校
12. 芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
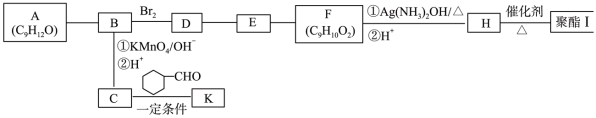
①A能与金属钠反应生成氢气,但不能使酸性高锰酸钾溶液褪色
② +CO2
+CO2
③RCOCH3+R’CHO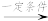 RCOCH=CHR’+H2O
RCOCH=CHR’+H2O
回答下列问题:
(1)A生成B的反应类型为__________ ,由D生成E的反应条件为_________________ 。
(2)H中含有的官能团名称为________________ 。
(3)K的结构简式为______________________ 。
(4)由E生成F的化学方程式为______________________________________________ ,
由H生成I的化学方程式为___________________________________________________ 。
(5)F有多种同分异构体,写出符合下列条件的同分异构体的结构简式_______________ 。
①能发生水解和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮(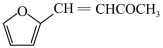 )是一种重要医药中间体,参考上述合成路线,设计一条由叔丁醇((CH3)3COH)和糠醛(
)是一种重要医药中间体,参考上述合成路线,设计一条由叔丁醇((CH3)3COH)和糠醛(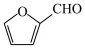 )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)___________________________________________________________ 。

①A能与金属钠反应生成氢气,但不能使酸性高锰酸钾溶液褪色
②
 +CO2
+CO2③RCOCH3+R’CHO
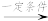 RCOCH=CHR’+H2O
RCOCH=CHR’+H2O 回答下列问题:
(1)A生成B的反应类型为
(2)H中含有的官能团名称为
(3)K的结构简式为
(4)由E生成F的化学方程式为
由H生成I的化学方程式为
(5)F有多种同分异构体,写出符合下列条件的同分异构体的结构简式
①能发生水解和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)糠叉丙酮(
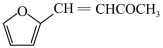 )是一种重要医药中间体,参考上述合成路线,设计一条由叔丁醇((CH3)3COH)和糠醛(
)是一种重要医药中间体,参考上述合成路线,设计一条由叔丁醇((CH3)3COH)和糠醛( )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明反应试剂和条件)
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、认识化学科学、化学反应原理、常见无机物及其应用、有机化学基础、物质结构与性质、化学实验基础
试卷题型(共 12题)
题型
数量
单选题
7
解答题
2
填空题
3
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.4 | 化学科学对人类文明发展的意义 无机非金属材料 | |
| 2 | 0.85 | 胶体 阿伏加德罗常数的应用 结合氧化还原反应知识与NA相关推算 盐类水解规律 | |
| 3 | 0.4 | 铵根离子的检验 Fe2+的鉴别及其应用 溶度积规则及其应用 乙烯的制备实验 | |
| 4 | 0.85 | 无机综合推断 元素周期表提供的元素信息 元素非金属性强弱的比较方法 | |
| 5 | 0.65 | 有机分子中原子共面的判断 醇类的化学性质 酯的化学性质 多官能团有机物的结构与性质 | |
| 6 | 0.65 | 原电池电极反应式书写 原电池、电解池综合考查 电解池电极反应式及化学方程式的书写与判断 | |
| 7 | 0.65 | 水的电离 酸碱混合时的定性判断及计算 弱电解质的电离平衡 盐溶液中微粒间的电荷守恒、物料守恒、质子守恒原理 | |
| 二、解答题 | |||
| 8 | 0.65 | 氧化还原反应有关计算 仪器使用与实验安全 物质含量的测定 物质制备的探究 | 实验探究题 |
| 10 | 0.4 | 盖斯定律与热化学方程式 化学反应的速率 化学平衡的移动及其影响因素 燃料电池原理及优点 | 原理综合题 |
| 三、填空题 | |||
| 9 | 0.15 | 氧化还原反应方程式的配平 盐溶液中离子浓度大小的比较 物质制备的探究 | |
| 11 | 0.15 | 能层与能级 电离能变化规律 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | |
| 12 | 0.4 | 根据题给物质选择合适合成路线 有机合成综合考查 有机推断综合考查 | |



