名校
解题方法
1 . 镍(Ni)是一种硬而有延展性并具有铁磁性的金属,其常见硫酸盐(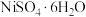 )是一种蓝色晶体,主要用于电镀行业镀镍、制镍催化剂、印染的媒染剂等,工业上用富含(NiS)的废渣(主要有
)是一种蓝色晶体,主要用于电镀行业镀镍、制镍催化剂、印染的媒染剂等,工业上用富含(NiS)的废渣(主要有 、FeO等杂质)制备
、FeO等杂质)制备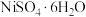 ,其流程如下:
,其流程如下: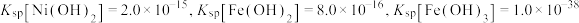 。
。
(1)Ni元素在元素周期表的位置为___________ ,其基态原子的价电子排布式为___________ 。
(2)“预处理”操作可以选择用___________(填标号)来除去含镍废料表面的矿物油污。
(3)“酸浸”过程中,加稀硫酸的同时还应加入少量的稀硝酸,其目的是将NiS氧化为 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(4)“氧化”过程保持滤液温度在45℃左右,原因是___________ ,请写出该过程反应的离子方程式___________ 。
(5)常温下加NaOH溶液调节pH,若溶液中 ,则溶液的pH范围应调节为
,则溶液的pH范围应调节为___________ (通常认为溶液中的离子浓度小于 为沉淀完全)。操作a应为
为沉淀完全)。操作a应为___________ ,过滤。
(6)煅烧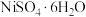 晶体,剩余固体质量与温度变化关系如图所示,该曲线中B段所表示氧化物为
晶体,剩余固体质量与温度变化关系如图所示,该曲线中B段所表示氧化物为___________ 。(填化学式)
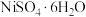 )是一种蓝色晶体,主要用于电镀行业镀镍、制镍催化剂、印染的媒染剂等,工业上用富含(NiS)的废渣(主要有
)是一种蓝色晶体,主要用于电镀行业镀镍、制镍催化剂、印染的媒染剂等,工业上用富含(NiS)的废渣(主要有 、FeO等杂质)制备
、FeO等杂质)制备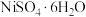 ,其流程如下:
,其流程如下: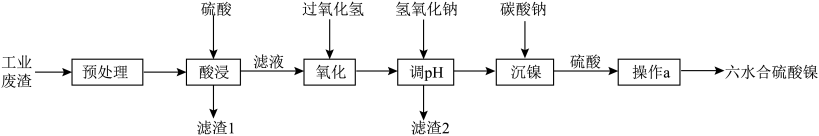
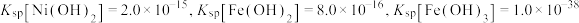 。
。(1)Ni元素在元素周期表的位置为
(2)“预处理”操作可以选择用___________(填标号)来除去含镍废料表面的矿物油污。
| A.纯碱溶液 | B.NaOH溶液 | C.酒精 | D.硫酸溶液 |
(3)“酸浸”过程中,加稀硫酸的同时还应加入少量的稀硝酸,其目的是将NiS氧化为
 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)“氧化”过程保持滤液温度在45℃左右,原因是
(5)常温下加NaOH溶液调节pH,若溶液中
 ,则溶液的pH范围应调节为
,则溶液的pH范围应调节为 为沉淀完全)。操作a应为
为沉淀完全)。操作a应为(6)煅烧
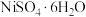 晶体,剩余固体质量与温度变化关系如图所示,该曲线中B段所表示氧化物为
晶体,剩余固体质量与温度变化关系如图所示,该曲线中B段所表示氧化物为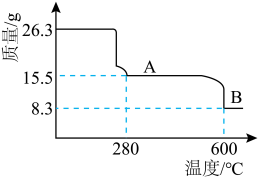
您最近一年使用:0次
名校
解题方法
2 . 二氯化砜( )又名磺酰氯,熔点为-54.1℃,沸点69.1℃,常温较稳定,遇水剧烈反应,100℃以上易分解。主要用作氯化剂或氯磺化剂。实验室可利用
)又名磺酰氯,熔点为-54.1℃,沸点69.1℃,常温较稳定,遇水剧烈反应,100℃以上易分解。主要用作氯化剂或氯磺化剂。实验室可利用 和
和 在活性炭催化下发生反应:
在活性炭催化下发生反应: ,得到少量
,得到少量 ,装置如图(部分夹持装置已省略)。请回答相应问题:
,装置如图(部分夹持装置已省略)。请回答相应问题:___________ (填“m”或“n”)。
(2)以上装置按气流方向的连接顺序为___________ →g、h←___________ (用小写字母填写,且装置可重复使用)。
(3)装置乙中发生反应的化学方程式___________ ;装置乙发生反应时浓硫酸体现的性质是___________ 。
(4)球形干燥管中的碱石灰的作用为___________ 。
(5)装置戊中仪器A置于冷水浴中,其原因是___________ 。
(6)某实验小组利用上述装置(浓盐酸、 均足量),最后得到纯净的磺酰氯
均足量),最后得到纯净的磺酰氯 ,则磺酰氯的产率为
,则磺酰氯的产率为___________ (保留三位有效数)。
 )又名磺酰氯,熔点为-54.1℃,沸点69.1℃,常温较稳定,遇水剧烈反应,100℃以上易分解。主要用作氯化剂或氯磺化剂。实验室可利用
)又名磺酰氯,熔点为-54.1℃,沸点69.1℃,常温较稳定,遇水剧烈反应,100℃以上易分解。主要用作氯化剂或氯磺化剂。实验室可利用 和
和 在活性炭催化下发生反应:
在活性炭催化下发生反应: ,得到少量
,得到少量 ,装置如图(部分夹持装置已省略)。请回答相应问题:
,装置如图(部分夹持装置已省略)。请回答相应问题:

(2)以上装置按气流方向的连接顺序为
(3)装置乙中发生反应的化学方程式
(4)球形干燥管中的碱石灰的作用为
(5)装置戊中仪器A置于冷水浴中,其原因是
(6)某实验小组利用上述装置(浓盐酸、
 均足量),最后得到纯净的磺酰氯
均足量),最后得到纯净的磺酰氯 ,则磺酰氯的产率为
,则磺酰氯的产率为
您最近一年使用:0次
名校
3 . 亚硝酰硫酸(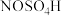 )主要用重氮化反应。实验室将二氧化硫通入到硫酸和硝酸中发生氧化还原反应,硝酸被还原为亚硝酸,二氧化硫被氧化为三氧化硫(夹持装置略)制备少量
)主要用重氮化反应。实验室将二氧化硫通入到硫酸和硝酸中发生氧化还原反应,硝酸被还原为亚硝酸,二氧化硫被氧化为三氧化硫(夹持装置略)制备少量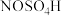 ,并测定产品的纯度。已知:
,并测定产品的纯度。已知: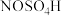 遇水分解,但溶于浓硫酸而不分解。
遇水分解,但溶于浓硫酸而不分解。 ,导管b的作用是
,导管b的作用是______ 。
(2)装置B中浓 与
与 在浓
在浓 作用下反应制得
作用下反应制得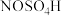 。装置B中维持体系温度不得高于20℃主要原因
。装置B中维持体系温度不得高于20℃主要原因______ 。
(3)该实验装置存在可能导致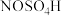 产量降低的缺陷是
产量降低的缺陷是______ 。
(4)测定亚硝酰硫酸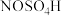 的纯度
的纯度
准确称取1.380g产品放入250mL的碘量瓶中,加入 、60.00mL的
、60.00mL的 标准溶液和10mL25%
标准溶液和10mL25% 溶液,然后摇匀。用
溶液,然后摇匀。用 草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
已知:
①写出 溶液与酸性
溶液与酸性 溶液反应的离子方程式:
溶液反应的离子方程式:______ 。
②滴定终点时的现象为______ 。
③亚硝酰硫酸的纯度=______ 。(精确到0.1%)
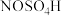 )主要用重氮化反应。实验室将二氧化硫通入到硫酸和硝酸中发生氧化还原反应,硝酸被还原为亚硝酸,二氧化硫被氧化为三氧化硫(夹持装置略)制备少量
)主要用重氮化反应。实验室将二氧化硫通入到硫酸和硝酸中发生氧化还原反应,硝酸被还原为亚硝酸,二氧化硫被氧化为三氧化硫(夹持装置略)制备少量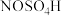 ,并测定产品的纯度。已知:
,并测定产品的纯度。已知: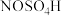 遇水分解,但溶于浓硫酸而不分解。
遇水分解,但溶于浓硫酸而不分解。
 ,导管b的作用是
,导管b的作用是(2)装置B中浓
 与
与 在浓
在浓 作用下反应制得
作用下反应制得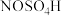 。装置B中维持体系温度不得高于20℃主要原因
。装置B中维持体系温度不得高于20℃主要原因(3)该实验装置存在可能导致
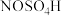 产量降低的缺陷是
产量降低的缺陷是(4)测定亚硝酰硫酸
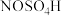 的纯度
的纯度准确称取1.380g产品放入250mL的碘量瓶中,加入
 、60.00mL的
、60.00mL的 标准溶液和10mL25%
标准溶液和10mL25% 溶液,然后摇匀。用
溶液,然后摇匀。用 草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。
草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00mL。已知:

①写出
 溶液与酸性
溶液与酸性 溶液反应的离子方程式:
溶液反应的离子方程式:②滴定终点时的现象为
③亚硝酰硫酸的纯度=

您最近一年使用:0次
解题方法
4 . 硫脲( )可用作橡胶的硫化促进剂、金属矿物的浮选剂。已知硫脲易溶于水,在空气中易被氧化,受热时部分发生异构化反应而生成硫氰化铵(
)可用作橡胶的硫化促进剂、金属矿物的浮选剂。已知硫脲易溶于水,在空气中易被氧化,受热时部分发生异构化反应而生成硫氰化铵( )。实验室制备硫脲的装置如图所示(夹持和加热装置略)。
)。实验室制备硫脲的装置如图所示(夹持和加热装置略)。

(1)仪器a的名称是
(2)反应开始时,先打开
 ,当观察到装置C中出现黑色沉淀时,再打开
,当观察到装置C中出现黑色沉淀时,再打开 ,这样操作的目的是
,这样操作的目的是(3)装置B中除生成硫脲外,还生成一种碱,写出装置B中发生反应的化学方程式:
(4)装置B反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用
 酸性
酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL(已知滴定时,硫脲转化为
标准溶液滴定,滴定至终点时消耗标准溶液VmL(已知滴定时,硫脲转化为 、
、 和
和 ,假设杂质不参与反应)。
,假设杂质不参与反应)。①该实验中滴加酸性
 标准溶液的正确操作是
标准溶液的正确操作是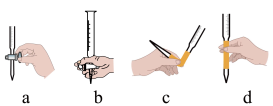
 、V的代数式表示)。
、V的代数式表示)。③若滴定前平视酸性
 标准溶液液面读数,滴定后俯视液面读数,计算得到的待测产品纯度比实际纯度
标准溶液液面读数,滴定后俯视液面读数,计算得到的待测产品纯度比实际纯度
您最近一年使用:0次
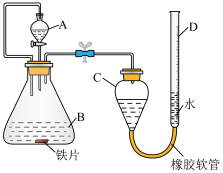
5 . 下面是两种粗略测定铁片中铁元素质量分数的实验方案,请回答相关问题:
方案一:量气法,实验装置如图(夹持仪器省略):___________ 。
(2)按图示连接好装置后,需进行的操作有:
①记录C的液面位置;
②检查气密性;
③由A向B滴加足量试剂;
④待B中不再有气体产生并恢复至室温后,记录C的液面位置。
上述操作的顺序是___________ (填序号);记录C的液面位置时,除视线平视外,还应___________ 。
(3)要计算铁片中铁元素质量分数,还需测量的实验数据有___________ 。
方案二:滴定法。
将ag铁片用过量稀硫酸完全溶解后加水稀释至250mL,移取25.00mL反应液于锥形瓶中。用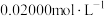 的
的 溶液滴定,平行滴定3次,平均消耗25.00mL
溶液滴定,平行滴定3次,平均消耗25.00mL  溶液。
溶液。
(4)在该滴定实验中选择___________ (填“酸式”或“碱式”)滴定管。
(5)铁片中铁元素的质量分数为___________ 。
方案一:量气法,实验装置如图(夹持仪器省略):
(2)按图示连接好装置后,需进行的操作有:
①记录C的液面位置;
②检查气密性;
③由A向B滴加足量试剂;
④待B中不再有气体产生并恢复至室温后,记录C的液面位置。
上述操作的顺序是
(3)要计算铁片中铁元素质量分数,还需测量的实验数据有
方案二:滴定法。
将ag铁片用过量稀硫酸完全溶解后加水稀释至250mL,移取25.00mL反应液于锥形瓶中。用
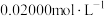 的
的 溶液滴定,平行滴定3次,平均消耗25.00mL
溶液滴定,平行滴定3次,平均消耗25.00mL  溶液。
溶液。(4)在该滴定实验中选择
(5)铁片中铁元素的质量分数为
您最近一年使用:0次
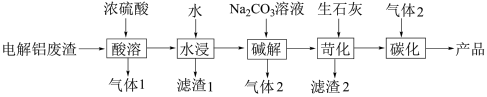
6 . 碳酸锂可以用作电池的正极材料。在锂离子电池中,正极材料是决定电池性能的关键因素之一,而碳酸锂能够有效提高电池的能量密度和稳定性,从而延长电池的使用寿命。这使得碳酸锂成为制造高性能电动汽车电池和储能系统的重要材料。以电解铝废渣(主要含AlF3、NaF、LiF、CaO)为原料,制备电池级碳酸锂的工艺流程如下: 、
、 。回答下列问题:
。回答下列问题:
(1)①电解氧化铝生成铝的化学方程式为__________ ,无碳电解铝技术是利用陶瓷材料替代碳作阳极,该技术的优点之一是__________ 。
②已知AlCl3可形成共价分子,AlF3为离子晶体,从电负性的角度解释其原因:__________ 。
(2)“气体1”是______ (填化学式,下同),“滤渣1”的主要成分是______ 。
(3)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式__________________ 。
(4)Al-Li合金具有低密度、耐腐蚀等特点,已成为航天器的重要结构材料。一种Al3Li合金的晶胞如图所示,其中白球代表的是______ ;若其晶胞参数为apm,则该合金的晶体密度为______ g∙cm-3(列出计算式,阿伏加德罗常数用NA表示)。
 、
、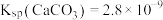 。回答下列问题:
。回答下列问题:(1)①电解氧化铝生成铝的化学方程式为
②已知AlCl3可形成共价分子,AlF3为离子晶体,从电负性的角度解释其原因:
(2)“气体1”是
(3)已知“碱解”同时生成白色沉淀,写出生成“气体2”的离子方程式
(4)Al-Li合金具有低密度、耐腐蚀等特点,已成为航天器的重要结构材料。一种Al3Li合金的晶胞如图所示,其中白球代表的是

您最近一年使用:0次
解题方法
7 . 二硝基甲苯主要用于医药、染料、涂料及其他精细化工品的合成。某探究小组利用下列装置制备二硝基甲苯。
实验步骤:①保持温度在40℃以下,按体积比1∶3配制浓硫酸与浓硝酸的混合物115mL;
②用水浴预热至60~70℃,在三颈烧瓶中加入54.80g邻硝基甲苯,按图示装好药品和其他仪器;
③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为60~70℃,反应大约30min;
⑤反应结束后,在不断搅拌下,将反应后的混合物缓慢倒入冰水中,然后过滤;
⑥洗涤、称量,所得固体质量为65.52g。
请回答下列问题:
(1)仪器A的名称为______ ;仪器B的作用是_______ ,冷凝水的进水口为____ (填“a”或“b”);三颈烧瓶最适宜的规格为______ (填标号)。
①100mL ②250mL ③500mL ④1000mL
(2)三颈烧瓶中邻硝基甲苯生成2,4-二硝基甲苯的化学方程式为_______ ,采用水浴加热的一个优点是______ 。
(3)所得固体中只有2,4-二硝基甲苯和2,6-二硝基甲苯,其中一种的核磁共振氢谱如图甲所示,该有机物的结构简式为_____ ;该实验中两种二硝基甲苯的产率之和为_____ %。_______ ,毛细管(极少量的空气可以经毛细管进入圆底烧瓶)的作用为_______ 。

摩尔质量/(g·mol ) ) | 密度/(g·cm ) ) | 沸点/℃ | 溶解性 | |
| 邻硝基甲苯 | 137 | 1.16 | 222 | 不溶于水,易溶于苯 |
| 2,4-二硝基甲苯 | 182 | 1.32 | 304(290℃时开始分解) | 微溶于水、乙醇,易溶于苯 |
| 2,6-二硝基甲苯 | 182 | 1.28 | 290 | 不溶于水,溶于乙醇、乙醚 |
| 乙醇 | 46 | 0.78 | 78 | 与水以任意比例互溶 |
②用水浴预热至60~70℃,在三颈烧瓶中加入54.80g邻硝基甲苯,按图示装好药品和其他仪器;
③向三颈烧瓶中加入混酸,并不断搅拌(磁力搅拌器已略去);
④控制温度约为60~70℃,反应大约30min;
⑤反应结束后,在不断搅拌下,将反应后的混合物缓慢倒入冰水中,然后过滤;
⑥洗涤、称量,所得固体质量为65.52g。
请回答下列问题:
(1)仪器A的名称为
①100mL ②250mL ③500mL ④1000mL
(2)三颈烧瓶中邻硝基甲苯生成2,4-二硝基甲苯的化学方程式为
(3)所得固体中只有2,4-二硝基甲苯和2,6-二硝基甲苯,其中一种的核磁共振氢谱如图甲所示,该有机物的结构简式为


您最近一年使用:0次
8 . 氟硼酸钠常用作电化学处理剂、涂料、氟化剂等工业生产。一种以硬硼钙石(含 、
、 及少量
及少量 、
、 、MgO)为原料生产氟硼酸钠的工艺流程如下:
、MgO)为原料生产氟硼酸钠的工艺流程如下: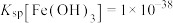 、
、 、
、 、
、 、
、 。
。
②完全沉淀时金属阳离子浓度小于等于 。
。
(1)“酸解”过程中, 与硫酸共热反应生成
与硫酸共热反应生成 的化学方程式为
的化学方程式为___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)“调pH”过程的目的为除去溶液中的铁、铝元素,常温下需要调节pH至少为___________ 。
(4)“酸溶”过程中B原子的杂化方式由___________ 变为___________ 。
(5)“酸溶”过程中存在反应 该反应的平衡常数
该反应的平衡常数
___________ 。
(6)“酸溶”过程中不能使用玻璃和陶瓷反应器的原因为___________ (用化学方程式表示)。
(7)根据元素性质分析 中氢键
中氢键 的键能小于HF中氢键
的键能小于HF中氢键 的键能的原因为
的键能的原因为___________ 。
(8) 晶体中不存在的化学键为___________(填选项)。
晶体中不存在的化学键为___________(填选项)。
 、
、 及少量
及少量 、
、 、MgO)为原料生产氟硼酸钠的工艺流程如下:
、MgO)为原料生产氟硼酸钠的工艺流程如下:
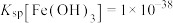 、
、 、
、 、
、 、
、 。
。②完全沉淀时金属阳离子浓度小于等于
 。
。(1)“酸解”过程中,
 与硫酸共热反应生成
与硫酸共热反应生成 的化学方程式为
的化学方程式为(2)“滤渣1”的主要成分为
(3)“调pH”过程的目的为除去溶液中的铁、铝元素,常温下需要调节pH至少为
(4)“酸溶”过程中B原子的杂化方式由
(5)“酸溶”过程中存在反应
 该反应的平衡常数
该反应的平衡常数
(6)“酸溶”过程中不能使用玻璃和陶瓷反应器的原因为
(7)根据元素性质分析
 中氢键
中氢键 的键能小于HF中氢键
的键能小于HF中氢键 的键能的原因为
的键能的原因为(8)
 晶体中不存在的化学键为___________(填选项)。
晶体中不存在的化学键为___________(填选项)。| A.离子键 | B. 键 键 | C. 键 键 | D.配位键 |
您最近一年使用:0次
解题方法
9 . 丙酸异丙酯主要用作食品香料,实验室用丙酸和异丙醇( )制备丙酸异丙酯,有关物质的相关信息如下,实验装置如图所示(夹持仪器已省略)。
)制备丙酸异丙酯,有关物质的相关信息如下,实验装置如图所示(夹持仪器已省略)。
| 有机物名称 | 丙酸 | 异丙醇 | 丙酸异丙酯 |
密度/( ) ) | 0.99 | 0.79 | 0.87 |
| 沸点/℃ | 141.1 | 82.5 | 109.0 |
| 水溶性 | 互溶 | 互溶 | 微溶 |
| 相对分子质量 | 74 | 60 | 116 |
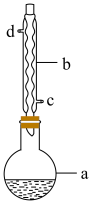
i.在圆底烧瓶中将6.00mL的丙酸和15.00mL的异丙醇混合,再加入3.00mL浓硫酸,摇匀后加入几粒沸石,加热反应2h后,将反应物冷却至室温;
ii.将“步骤i”冷却至室温的液体分离出来后,分别用适量水、10%
 溶液、饱和NaCl溶液洗涤,最后转移至锥形瓶,加入无水氯化钙;
溶液、饱和NaCl溶液洗涤,最后转移至锥形瓶,加入无水氯化钙;iii.将“步骤ii”得到的粗品蒸馏,收集馏分,得到产品体积为8.20mL。
回答下列问题:
(1)仪器a的名称为
(2)“步骤i”中发生反应的化学方程式为
(3)要使丙酸尽量转化为丙酸异丙酯,可以采取的措施是
(4)“步骤ii”加入无水氯化钙的目的是
(5)“步骤iii”精制过程中应收集
您最近一年使用:0次
2024-05-12更新
|
78次组卷
|
2卷引用:云南省昭通市水富市第一中学2023-2024学年高二下学期3月月考化学试题
名校
解题方法
10 . 三氯化六氨合钴 主要用于磷酸盐的测定和钴盐的制备。实验室以活性炭为催化剂,用
主要用于磷酸盐的测定和钴盐的制备。实验室以活性炭为催化剂,用 制备
制备 (钴为+3价),装置如图所示。
(钴为+3价),装置如图所示。
I.称取研细的 10.0g和
10.0g和 5.0g于烧杯中溶解,将溶液转入三颈烧瓶,加入25mL浓氨水和适量活性炭粉末,逐滴加入5mL30%的
5.0g于烧杯中溶解,将溶液转入三颈烧瓶,加入25mL浓氨水和适量活性炭粉末,逐滴加入5mL30%的 溶液。
溶液。
Ⅱ.控制反应温度为60℃,反应一段时间后,得到 溶液。
溶液。
Ⅲ.在一定条件下,经过一系列的操作制得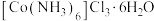 。
。
回答下列问题:
(1)仪器a的名称为_______ ,仪器b中盛装的试剂为_______ (填“碱石灰”或“无水氯化钙”)。
(2)步骤Ⅱ中控制反应温度为60℃,温度不能过高的原因是_______ 。
(3)步骤Ⅲ制得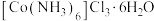 晶体的一系列的过程:加热浓缩、
晶体的一系列的过程:加热浓缩、_______ 、冷却结晶、过滤、洗涤并干燥。在冷却结晶之前还需要加入适量的浓盐酸,除了抑制水解之外加入浓盐酸的作用是_______ 。
(4)制备过程中可能会有 和
和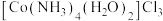 副产物生成,
副产物生成, 中的配体为
中的配体为_______ 。 为正八面体结构,Co(Ⅲ)处于八面体的中心,则
为正八面体结构,Co(Ⅲ)处于八面体的中心,则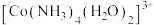 有
有_______ 种不同的结构(不考虑光学异构)。
 主要用于磷酸盐的测定和钴盐的制备。实验室以活性炭为催化剂,用
主要用于磷酸盐的测定和钴盐的制备。实验室以活性炭为催化剂,用 制备
制备 (钴为+3价),装置如图所示。
(钴为+3价),装置如图所示。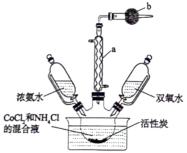
I.称取研细的
 10.0g和
10.0g和 5.0g于烧杯中溶解,将溶液转入三颈烧瓶,加入25mL浓氨水和适量活性炭粉末,逐滴加入5mL30%的
5.0g于烧杯中溶解,将溶液转入三颈烧瓶,加入25mL浓氨水和适量活性炭粉末,逐滴加入5mL30%的 溶液。
溶液。Ⅱ.控制反应温度为60℃,反应一段时间后,得到
 溶液。
溶液。Ⅲ.在一定条件下,经过一系列的操作制得
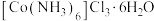 。
。回答下列问题:
(1)仪器a的名称为
(2)步骤Ⅱ中控制反应温度为60℃,温度不能过高的原因是
(3)步骤Ⅲ制得
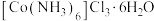 晶体的一系列的过程:加热浓缩、
晶体的一系列的过程:加热浓缩、(4)制备过程中可能会有
 和
和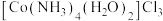 副产物生成,
副产物生成, 中的配体为
中的配体为 为正八面体结构,Co(Ⅲ)处于八面体的中心,则
为正八面体结构,Co(Ⅲ)处于八面体的中心,则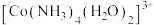 有
有
您最近一年使用:0次



