名校
1 . 由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。

(1)a电极材料应为____ ,电极反应式为_______ 。
(2)电解液C可以是__________ 。
A.纯净水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是______ ,在加入苯之前对C应作何简单处理_______
(4)为了在较短时间内看到白色沉淀,可采取的措施是________ 。
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减小两电极间距离
D.适当降低电解液的温度

(1)a电极材料应为
(2)电解液C可以是
A.纯净水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是
(4)为了在较短时间内看到白色沉淀,可采取的措施是
A.改用稀硫酸作电解液
B.适当增大电源的电压
C.适当减小两电极间距离
D.适当降低电解液的温度
您最近一年使用:0次
名校
解题方法
2 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
783次组卷
|
10卷引用:山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题
山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题河南省顶级名校2023届高三上学期10月月考化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷2021年河北省高考化学试卷变式题10-18题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第1讲 钠及其重要化合物
19-20高二·浙江·期末
解题方法
3 .  在工业生产上有重要的应用。
在工业生产上有重要的应用。

(1)实验室用碱石灰和氯化铵共热制备氨气的化学方程式:________ 。
(2)将少量氨气与过量氯气混合,生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构。写出A的电子式________ ;A在一定条件下能与水反应,可用于饮用水的消毒,写出此反应的化学方程式________ 。
(3)在100℃时以 和
和 气体为原料制备
气体为原料制备 ,反应的化学方程式是
,反应的化学方程式是________ 。
(4) 可以发生水解。相同条件下,不同粒径的
可以发生水解。相同条件下,不同粒径的 粉末水解时溶液pH的变化如图所示。解释
粉末水解时溶液pH的变化如图所示。解释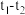 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:________ 。
 在工业生产上有重要的应用。
在工业生产上有重要的应用。
(1)实验室用碱石灰和氯化铵共热制备氨气的化学方程式:
(2)将少量氨气与过量氯气混合,生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构。写出A的电子式
(3)在100℃时以
 和
和 气体为原料制备
气体为原料制备 ,反应的化学方程式是
,反应的化学方程式是(4)
 可以发生水解。相同条件下,不同粒径的
可以发生水解。相同条件下,不同粒径的 粉末水解时溶液pH的变化如图所示。解释
粉末水解时溶液pH的变化如图所示。解释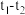 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:
您最近一年使用:0次
解题方法
4 . 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。已知: ClO2浓度过高或受热易分解,甚至会爆炸。现有下列制备ClO2的方法:
(1)方法一:氧化法
可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是_______________________ 。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因__________________________________________________ 。
(2)方法二:草酸还原法
在酸性溶液中用草酸(H2C2O4)还原氯酸钠的方法来制备ClO2
①写出制备ClO2的离子方程式:__________________________________________ ;
②与电解法相比,用草酸还原法制备ClO2的特点是____________________ ,提高了生产、储存及运输过程的安全性。
(3)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH<2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:

①用紫外分光光度法测得水样中ClO2的含量为a mol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取V mL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH小于2。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为___________ mol/L( 用含字母的代数式表示)。
(1)方法一:氧化法
可用亚氯酸钠和稀盐酸为原料制备,反应原理为5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O。
①该反应中氧化剂和还原剂的物质的量之比是
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因
(2)方法二:草酸还原法
在酸性溶液中用草酸(H2C2O4)还原氯酸钠的方法来制备ClO2
①写出制备ClO2的离子方程式:
②与电解法相比,用草酸还原法制备ClO2的特点是
(3)已知: ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH 的关系如图所示。当pH<2.0 时,ClO2-也能被I- 完全还原为Cl-。反应生成的I2与Na2S2O3反应的方程式: 2Na2S2O3+ I2= Na2S4O6 + 2NaI。用ClO2消毒的饮用水中含有ClO2、ClO2-。测定饮用水中ClO2、ClO2-的含量,分两步进行:

①用紫外分光光度法测得水样中ClO2的含量为a mol/L。
②用滴定法测量ClO2-的含量。请完成相应的实验步骤:
步骤1: 准确量取V mL 上述水样加入锥形瓶中。
步骤2: 调节水样的pH小于2。
步骤3: 加入足量的KI 晶体,充分反应。
步骤4: 加入少量淀粉溶液,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1 mL。
根据上述分析数据,测得该饮用水中ClO2-的浓度为
您最近一年使用:0次
名校
5 . 工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?___ (填“能”或“不能”,理由是___ 。
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是___ 。(填序号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?(填“是”或“否”)___ ,理由是____ 。
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有____ 。
A.浓HNO3 B.KMnO4 C.Cl2 D.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有___ 。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?(填“是”或“否”)
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有
A.浓HNO3 B.KMnO4 C.Cl2 D.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO
您最近一年使用:0次
11-12高二下·安徽六安·课时练习
名校
6 . 工业制备氯化铜时,将浓盐酸用蒸气加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤:
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?___ ,理由是___ 。
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是____ 。(填序号)
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?___ ,理由是___ 。
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有___ (多选)。
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有___ (多选)。
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3。
请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?
(2)有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?
③现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有
A.浓HNO3 B.KMnO4 C.Cl2 D.O2 E.H2O2
(3)除去溶液中的Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有
A.NaOH B.氨水 C.Cu2(OH)2CO3 D.Na2CO3 E.CuO F.Cu(OH)2
您最近一年使用:0次
2019-11-06更新
|
349次组卷
|
6卷引用:江苏省南京师大苏州实验学校2019-2020学年高二9月月考化学试题
江苏省南京师大苏州实验学校2019-2020学年高二9月月考化学试题(已下线)2011-2012学年安徽省舒城晓天中学高二下学期质量测试5化学试卷(已下线)2014年高中化学苏教版选修四专题3 溶液中的离子反应练习卷福建省宁德市2017-2018学年高二上学期期末模拟质量检测化学试题甘肃省张掖市山丹县第一中学2017—2018学年高二上学期期末质量检测化学试题甘肃省古浪县第二中学2019-2020学年高二12月基础知识竞赛化学试题
名校
7 . 碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:
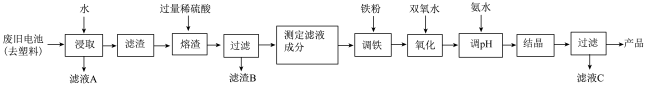
(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________ 。
(2)滤液A中溶质的电子式为___________ 。
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:___________________________________ 。
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:__________________ 、_______________ 。
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为___________ kg(忽略溶液体积变化,用含a、b的代数式表示)。
(5)在“氧化”工序中,加入双氧水的目的是_________________ ,生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________ 。
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_____________ 。

(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为
(2)滤液A中溶质的电子式为
(3)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:
(4)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:
②若测得滤液的成分为c(Mn2+)+c(Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1m3,“调铁”工序中,需加入的铁粉质量为
(5)在“氧化”工序中,加入双氧水的目的是
(6)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C(C为正盐),从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为
您最近一年使用:0次
2019-07-04更新
|
253次组卷
|
2卷引用:四川省成都市蒲江县蒲江中学2021-2022学年高二下学期5月月考化学试题
名校
8 . 高铁酸钾(暗紫色)是一种新型绿色氧化剂,制备高铁酸钾的工艺流程如下:

回答下列问题:
(1)步骤①中NaClO作______ (填“氧化剂”“还原剂"或“催化剂”)。
(2)步骤②脱除的盐是______ (填化学式)。
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4______ (填“>”或“<”)K2FeO4
(4)本次实验中K2FeO4的产率为______ 。
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸入一根带火星的木条,本条复燃;再向溶液中加入 KSCN溶液,溶液变为血红色。则K2FeO4 酸化时发生反应的离子方程式为____________ ;K2FeO4作为净水剂的优点除铁无毒外还有____________ 。

回答下列问题:
(1)步骤①中NaClO作
(2)步骤②脱除的盐是
(3)步骤③是利用溶解度的不同进行的操作。则溶解度:Na2FeO4
(4)本次实验中K2FeO4的产率为
(5)取少量K2FeO4于试管中,加硝酸酸化并堵住试管口,观察到溶液中有细微的小气泡产生,溶液紫色逐渐褪去,伸入一根带火星的木条,本条复燃;再向溶液中加入 KSCN溶液,溶液变为血红色。则K2FeO4 酸化时发生反应的离子方程式为
您最近一年使用:0次
2018-11-12更新
|
346次组卷
|
3卷引用:【全国市级联考】河北省邢台市2017-2018学年高二下学期第三次月考化学试题
9 . 如图为一“铁链”图案,图案上由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl35种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
( ) 两种物质都是非金属氧化物
( ) 两种物质都是钠的化合物
( ) 两种物质中一种是酸性氧化物,一种是碱性氧化物
( ) 两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为________ 。
②证明有红褐色胶体生成的最常用的实验操作是______________________________ 。

(1)请将分类依据代号填入相应的括号内:
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为
②证明有红褐色胶体生成的最常用的实验操作是
您最近一年使用:0次
2018-11-10更新
|
512次组卷
|
6卷引用:河北省正定县弘文中学2020-2021学年高二上学期9月月考化学(文)试题
河北省正定县弘文中学2020-2021学年高二上学期9月月考化学(文)试题河北省隆化县存瑞中学2019-2020学年高一上学期第一次质检化学试题河南省驻马店市正阳县高级中学2019-2020学年高一上学期第二次月考化学试题(已下线)【走进新高考】(人教版必修一)第二章 化学计量在实验中的应用 单元练习02(已下线)【走进新高考】(人教版必修一)第二章 化学物质及其变化 单元练习01(已下线)1.1.1 物质的分类 练习(1)——《高中新教材同步备课》(人教版 必修第一册)
10 . I.甲同学用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2· xH2O) 并测量其结晶水含量。已知: 在pH 为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。制取流程如下:

回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A 中Fe2+的试剂____ (填编号)
①KMnO4②K3[Fe(CN)6]③NaOH④KSCN
(2)试剂①是_____ ,试剂②是_____ 。(填化学式)
(3)为了测定制得的氯化铜晶体(CuCl2· xH2O) 中x的值,某兴趣小组设计了以下实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。沉淀洗涤的操作方法是________ ,根据实验数据测得x=_____ (用含m、n的代数式表示)。
II.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。回答下列问题:

(4)所选仪器接口的连接顺序是A接______,______接______;B接______,______接______;___________ 请用离子方程式说明淀粉KI溶液变蓝的原因_____________________________ 。
(5)若装入的饱和食盐水为75mL (氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL (已转换成标准状况下的体积) 时停止通电。将U 形管内的溶液倒入烧杯,常温时测得溶液的pH 约为___________________ 。

回答下列问题:
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A 中Fe2+的试剂
①KMnO4②K3[Fe(CN)6]③NaOH④KSCN
(2)试剂①是
(3)为了测定制得的氯化铜晶体(CuCl2· xH2O) 中x的值,某兴趣小组设计了以下实验方案:称取mg晶体溶于水,加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再轻为止,冷却,称量所得黑色固体的质量为ng。沉淀洗涤的操作方法是
II.乙同学设计了一套电解饱和食盐水的实验装置,来验证氯气的某些性质和测定产生的氢气的体积。回答下列问题:

(4)所选仪器接口的连接顺序是A接______,______接______;B接______,______接______;
(5)若装入的饱和食盐水为75mL (氯化钠足量,电解前后溶液体积变化可忽略,假设两极产生的气体全部逸出),当测得氢气为8.4mL (已转换成标准状况下的体积) 时停止通电。将U 形管内的溶液倒入烧杯,常温时测得溶液的pH 约为
您最近一年使用:0次



