名校
1 . I.实验室以K2MnO4为原料,用两种方法制备高锰酸钾。已知:K2MnO4在浓强碱溶液中可稳定存在,溶液呈墨绿色,当溶液碱性减弱时易发生反应:3 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。
(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知_______ 。
②停止通入CO2,过滤除去_______ (填化学式,下同),将滤液蒸发浓缩、冷却结晶,抽滤得到KMnO4粗品。若CO2通入过多,产品中可能混有的杂质是_______ 。
(2)电解法:实验装置如图。

①阳极的电极反应式为_______ ,阴极产生的气体为_______ (填化学式)。
②与CO2法相比,电解法的主要优点是_______ (写一条)。,
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为_______ 。
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为_______ 。
 +2H2O=2
+2H2O=2 +MnO2↓+4OH-。
+MnO2↓+4OH-。(1)CO2法:实验装置如图:

①反应一段时间后,用玻璃棒蘸取溶液滴在滤纸上,仅有紫红色而没有绿色痕迹,由此可知
②停止通入CO2,过滤除去
(2)电解法:实验装置如图。

①阳极的电极反应式为
②与CO2法相比,电解法的主要优点是
(3)如用氨燃料电池电解溶液,已知氨燃料电池使用的电解质溶液是KOH溶液,电池反应为4NH3+3O2=2N2+6H2O。则其负极反应式为
(4)若用钢铁(含Fe、C)制品盛装NaClO溶液会发生电化学腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化学腐蚀过程中的正极反应式为
您最近一年使用:0次
20-21高二下·浙江·阶段练习
解题方法
2 . I.电镀废水中常含有阴离子A,排放前可加CuSO4溶液处理,使之转化为沉淀B,按如图流程进行实验。
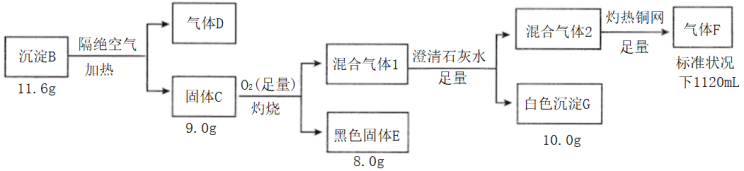
已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是___ 气体,D的分子式是___ 。
(2)写出C足量氧气中灼烧的方程式是___ 。
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是___ 。
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。
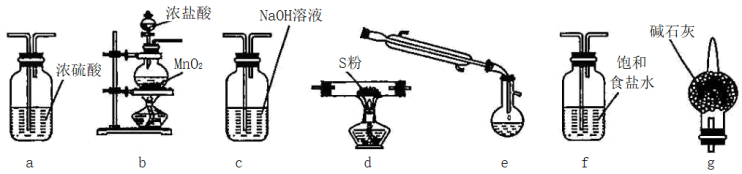
请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2___ 。
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式___ 。

已知:B含三种元素;气体D标况下密度2.32g/L;混合气体1无色无味;气体F标况密度为1.25g/L。请回答:
(1)组成B的三种元素是
(2)写出C足量氧气中灼烧的方程式是
(3)固体C在沸腾的稀盐酸中会生成一种弱酸和一种白色沉淀,该白色沉淀是共价化合物(测其分子量为199),则反应的化学方程式是
II.氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,在空气中强烈发烟,易与水发生水解反应:熔点为-80℃,沸点137.1℃。有熔融的硫中通入氯气即可生成S2Cl2。如图是实验室用S和Cl2制备S2Cl2的装置(部分夹持装置已略去)。

请回答:
(1)从上述提供的图片中选出必要的装置并排序以制备S2Cl2
(2)已知S2Cl2水解时,只有一种元素的化合价发生了变化,且被氧化和被还原的该元素的物质的量之比为1:3,请写出该反应的化学方程式
您最近一年使用:0次
3 . 铁酸H2FeO4是一种多功能、高效无毒的新型绿色水处理剂,投入水中会迅速发生反应。
(1)H2FeO4中Fe的化合价为________ 。
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为________ 。
(3)在工业上制备H2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:2FeSO4+6Na2O2=aNa2FeO4+bM↑+2Na2O+2Na2SO4
①b=________ 。
②每生成1molM,该反应转移电子的物质的量为________ mol。
Ⅱ.湿法制备的工艺流程如下;
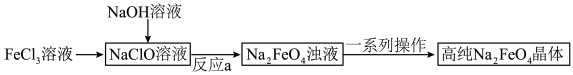
已知:H2FeO4在强碱性溶液中的溶解度较小,高温易分解。
③反应a中,生成物除了H2FeO4外,另一种盐的化学式为________ 。
④一系列操作包括过滤、________ 、________ 。
(1)H2FeO4中Fe的化合价为
(2)已知:常温下高铁酸为紫黑色固体,将H2FeO4投入水中,有气体生成,同时有红褐色沉淀产生,则H2FeO4与水反应的化学方程式为
(3)在工业上制备H2FeO4的方法有多种。
Ⅰ.干法制备的反应原理如下:2FeSO4+6Na2O2=aNa2FeO4+bM↑+2Na2O+2Na2SO4
①b=
②每生成1molM,该反应转移电子的物质的量为
Ⅱ.湿法制备的工艺流程如下;
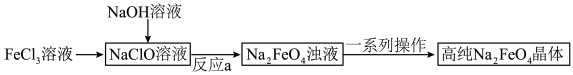
已知:H2FeO4在强碱性溶液中的溶解度较小,高温易分解。
③反应a中,生成物除了H2FeO4外,另一种盐的化学式为
④一系列操作包括过滤、
您最近一年使用:0次
19-20高二·浙江·期末
解题方法
4 .  在工业生产上有重要的应用。
在工业生产上有重要的应用。

(1)实验室用碱石灰和氯化铵共热制备氨气的化学方程式:________ 。
(2)将少量氨气与过量氯气混合,生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构。写出A的电子式________ ;A在一定条件下能与水反应,可用于饮用水的消毒,写出此反应的化学方程式________ 。
(3)在100℃时以 和
和 气体为原料制备
气体为原料制备 ,反应的化学方程式是
,反应的化学方程式是________ 。
(4) 可以发生水解。相同条件下,不同粒径的
可以发生水解。相同条件下,不同粒径的 粉末水解时溶液pH的变化如图所示。解释
粉末水解时溶液pH的变化如图所示。解释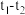 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:________ 。
 在工业生产上有重要的应用。
在工业生产上有重要的应用。
(1)实验室用碱石灰和氯化铵共热制备氨气的化学方程式:
(2)将少量氨气与过量氯气混合,生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构。写出A的电子式
(3)在100℃时以
 和
和 气体为原料制备
气体为原料制备 ,反应的化学方程式是
,反应的化学方程式是(4)
 可以发生水解。相同条件下,不同粒径的
可以发生水解。相同条件下,不同粒径的 粉末水解时溶液pH的变化如图所示。解释
粉末水解时溶液pH的变化如图所示。解释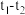 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:
您最近一年使用:0次



