名校
解题方法
1 . 某化学小组在实验室制取Na2O2。 查阅资料可知,温度在573~673 K之间可生成Na2O2,若温度提高到733 K以上Na2O2会分解。除Li外其他碱金属不与N2反应。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为______ 。
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是_____ 。水槽中量筒中收集到的气体为_____ 。测定装置的接口从左至右正确的连接顺序是_____ 。
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果____ (填“偏大”或“偏小”)。为证明其分析的正确性,设计实验方案如下:
实验方案I中发生反应的化学方程式为_______ 。 根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是______ 。
(1)甲组同学设计制取Na2O2的装置如图。

①使用该装置制取的Na2O2中不可能含有的杂质为
A. Na3N B. Na2CO3 C. Na2O D. NaOH
②该小组同学为测定制得的Na2O2样品的纯度,设计实验装置如下:

烧瓶中发生的主要反应的化学方程式是
(2)乙组同学从反应历程上分析出上述(1)②的测定反应中存在中间产物,从而会导致测定结果
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液,加入少量MnO2粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液后先变红后褪色 |
您最近一年使用:0次
2020-09-11更新
|
783次组卷
|
10卷引用:广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题
广西贺州市昭平中学2021-2022学年高二下学期第一次月考化学试题山西省忻州市第一中学2020-2021学年高二上学期开学考试化学试题山西省运城市景胜中学2020-2021学年高一10月月考化学试题河北省邢台市2022届高三9月第二次联合考试化学试题山东省济南市商河县第三中学2022届高三10月月考化学试题河南省顶级名校2023届高三上学期10月月考化学试题河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷2021年河北省高考化学试卷变式题10-18题(已下线)第07讲 钠及其重要化合物(练)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第1讲 钠及其重要化合物
19-20高二·浙江·期末
解题方法
2 .  在工业生产上有重要的应用。
在工业生产上有重要的应用。

(1)实验室用碱石灰和氯化铵共热制备氨气的化学方程式:________ 。
(2)将少量氨气与过量氯气混合,生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构。写出A的电子式________ ;A在一定条件下能与水反应,可用于饮用水的消毒,写出此反应的化学方程式________ 。
(3)在100℃时以 和
和 气体为原料制备
气体为原料制备 ,反应的化学方程式是
,反应的化学方程式是________ 。
(4) 可以发生水解。相同条件下,不同粒径的
可以发生水解。相同条件下,不同粒径的 粉末水解时溶液pH的变化如图所示。解释
粉末水解时溶液pH的变化如图所示。解释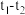 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:________ 。
 在工业生产上有重要的应用。
在工业生产上有重要的应用。
(1)实验室用碱石灰和氯化铵共热制备氨气的化学方程式:
(2)将少量氨气与过量氯气混合,生成一种酸性气体和另一种化合物A,A中所有原子均满足8电子稳定结构。写出A的电子式
(3)在100℃时以
 和
和 气体为原料制备
气体为原料制备 ,反应的化学方程式是
,反应的化学方程式是(4)
 可以发生水解。相同条件下,不同粒径的
可以发生水解。相同条件下,不同粒径的 粉末水解时溶液pH的变化如图所示。解释
粉末水解时溶液pH的变化如图所示。解释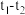 时间内两条曲线差异的可能原因:
时间内两条曲线差异的可能原因:
您最近一年使用:0次
名校
解题方法
3 . (1)21世纪是钛的世界,纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。

工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是_______
III.用TiCl4制备TiO2·xH2O的化学方程式为_______________ ,制备时需要________ ,促进水解趋于完全。
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在________ (填仪器名称)中加热。
(2)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色,轻轻摇动锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。根据上述实验,写出SOCl2与水反应的化学方程式_________________________________________________ 。AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得无水AlCl3,其原因是___________________ 。
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是______________ (用离子方程式表示)、向该溶液滴加b L 氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________ (填“正向”“不”或“逆向”)移动,所滴加氨水的浓度为________ mol/L-1。(NH3·H2O的电离平衡常数为Kb=210-5mol/L-1)

工业上二氧化钛的制备是:
I.将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应制得混有SiCl4杂质的TiCl4。
II.将SiCl4分离,得到纯净的TiCl4,所采取的操作名称是
III.用TiCl4制备TiO2·xH2O的化学方程式为
IV.TiO2·xH2O高温分解得到TiO2。如在实验室中进行,则需在
(2)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中,小心地滴加8滴~10滴SOCl2,可观察到剧烈反应,液面上有白雾形成,并有带刺激性气味的气体逸出。该气体可使滴有品红试液的滤纸褪色,轻轻摇动锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。根据上述实验,写出SOCl2与水反应的化学方程式
(3)NO2可用氨水吸收生成NH4NO3。25℃时,将a mol NH4NO3溶于水,溶液显酸性,原因是
您最近一年使用:0次



