名校
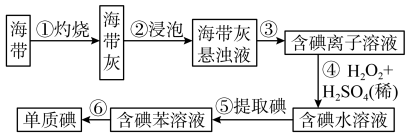
1 . 某学习小组按如下实验流程探究海带中碘含量的测定和单质碘的制取与应用。
实验(一) 碘含量的测定
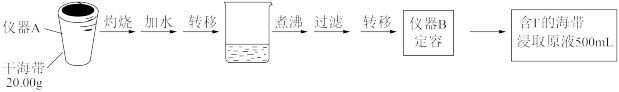
取0.0100 的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中
的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中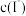 的变化,部分数据如下表:
的变化,部分数据如下表:
请回答:
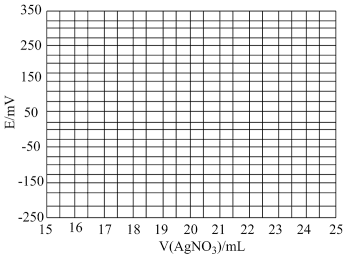
(1)①根据表中数据绘制滴定曲线:___________
②该次滴定终点时用去AgNO3溶液的体积为___________ mL,计算得海带中碘的百分含量为___________ %。
实验(二) 维生素C含量的测定
(2)将精制得到的I2配成浓度为 的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是
的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是___________ 。用250mL容量瓶定容,使用___________ (填仪器)量取25.00mL样品溶液于锥形瓶中,再加入10mL1:1醋酸溶液和适量的___________ 指示剂,立即用I2标准溶液滴定,溶液显稳定的___________ (填颜色)即为滴定终点,消耗I2标准溶液VmL,则样品中维生素C的质量分数是____ (写出表达式)。已知滴定反应方程式:  +I2
+I2
 +2HI
+2HI
实验(一) 碘含量的测定
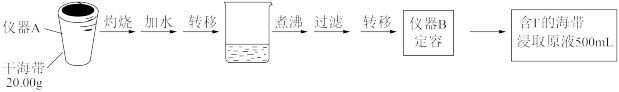
取0.0100
 的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中
的AgNO3标准溶液装入滴定管,取100.00mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E)反映溶液中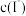 的变化,部分数据如下表:
的变化,部分数据如下表:| V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
| E/mV | 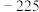 | 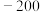 | 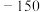 | 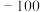 | 50.0 | 175 | 275 | 300 | 325 |

(1)①根据表中数据绘制滴定曲线:
②该次滴定终点时用去AgNO3溶液的体积为
实验(二) 维生素C含量的测定
(2)将精制得到的I2配成浓度为
 的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是
的标准溶液,用来测定某样品中维生素C(相对分子质量为M)的含量。具体操作如下:准确称量ag样品,溶于新煮沸过并冷却至室温的蒸馏水中,煮沸蒸馏水的目的是 +I2
+I2
 +2HI
+2HI
您最近一年使用:0次
名校
解题方法
2 . 为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:______ (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤⑤的实验操作名称是______ 。
(3)操作⑤选用苯做萃取剂,苯可以做萃取剂是因为______。
(4)④过程的离子方程式__________________
(5)从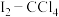 溶液中提取碘可用反萃取法,其流程如下:
溶液中提取碘可用反萃取法,其流程如下:
①操作1中向装有 的
的 溶液加入少量
溶液加入少量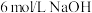 溶液,反应的离子方程式为
溶液,反应的离子方程式为______ ;
②振荡至溶液的______ 色消失,静置、分层,则______ (填“上”、“下”)层为 ;
;
③将含碘的碱溶液从仪器的______ (填“上”、“下”)口倒入烧杯中;
④边搅拌边加入几滴45% 溶液,溶液立即转为棕黄色,并析出碘晶体,若生成
溶液,溶液立即转为棕黄色,并析出碘晶体,若生成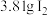 转移
转移______ mol电子。
(6) 溶液浓度越大吸光度越大。用色度计测得溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度为横坐标的标准曲线图,可以得出被测溶液浓度其结果如图所示。海带灼热(灰化)时间超过40min,测得碘的含量逐渐降低,原因是
溶液浓度越大吸光度越大。用色度计测得溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度为横坐标的标准曲线图,可以得出被测溶液浓度其结果如图所示。海带灼热(灰化)时间超过40min,测得碘的含量逐渐降低,原因是____________ 。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤⑤的实验操作名称是
(3)操作⑤选用苯做萃取剂,苯可以做萃取剂是因为______。
| A.苯不溶于水 | B.苯的密度比水小 |
| C.碘在苯中比在水中溶解度更大 | D.苯与碘水不反应 |
(4)④过程的离子方程式
(5)从
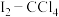 溶液中提取碘可用反萃取法,其流程如下:
溶液中提取碘可用反萃取法,其流程如下: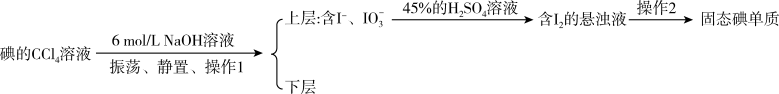
①操作1中向装有
 的
的 溶液加入少量
溶液加入少量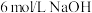 溶液,反应的离子方程式为
溶液,反应的离子方程式为②振荡至溶液的
 ;
;③将含碘的碱溶液从仪器的
④边搅拌边加入几滴45%
 溶液,溶液立即转为棕黄色,并析出碘晶体,若生成
溶液,溶液立即转为棕黄色,并析出碘晶体,若生成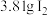 转移
转移(6)
 溶液浓度越大吸光度越大。用色度计测得溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度为横坐标的标准曲线图,可以得出被测溶液浓度其结果如图所示。海带灼热(灰化)时间超过40min,测得碘的含量逐渐降低,原因是
溶液浓度越大吸光度越大。用色度计测得溶液的吸光度后,利用以溶液吸光度为纵坐标、碘浓度为横坐标的标准曲线图,可以得出被测溶液浓度其结果如图所示。海带灼热(灰化)时间超过40min,测得碘的含量逐渐降低,原因是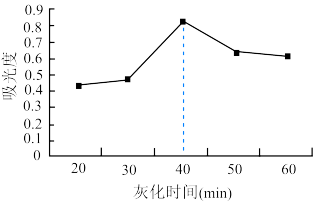
您最近一年使用:0次
解题方法
3 . 某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定
取100.00 mL海带浸取原液于锥形瓶中,用0.0100 mol·L 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00 mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00 mL。
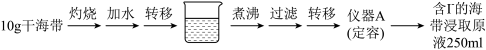
(1)灼烧海带实验用到的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、___________ 等
(2)仪器A的名称为:_______ 。
(3)计算海带中碘的百分含量为_______ %。
实验(二)碘的制取
某同学另取海带原液设计如下实验方案提取碘:

(4)步骤①中发生反应的离子方程式为______ ,当生成0.2 molI2时,转移电子的物质的量为______ 。
(5)向含有 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象为
振荡静置后的实验现象为__________________ 。
(6)步骤③中发生反应的化学方程式为__________________ 。
(7)设计一个简单实验证明步骤⑤提取碘后的水溶液中是否还含有碘单质:__________________ 。
实验(一)碘含量的测定

取100.00 mL海带浸取原液于锥形瓶中,用0.0100 mol·L
 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00 mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00 mL。(1)灼烧海带实验用到的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、
(2)仪器A的名称为:
(3)计算海带中碘的百分含量为
实验(二)碘的制取
某同学另取海带原液设计如下实验方案提取碘:

(4)步骤①中发生反应的离子方程式为
(5)向含有
 的水溶液中加入
的水溶液中加入 振荡静置后的实验现象为
振荡静置后的实验现象为(6)步骤③中发生反应的化学方程式为
(7)设计一个简单实验证明步骤⑤提取碘后的水溶液中是否还含有碘单质:
您最近一年使用:0次
4 . 海洋资源的利用具有非常广阔的前景。
I.利用空气吹出法从海水(弱碱性)中提取溴的流程如图。

已知:溴单质的沸点为58.5℃。
(1)溴元素在元素周期表中的位置是_______ 。
(2)“吸收塔”中发生反应的离子方程式为_______ 。
(3)“蒸馏塔”中温度应控制在_______ (填序号)。
A.40~50℃ B.70~80℃ C.100℃以上
(4)物质A_______ (填化学式)可以循环利用,降低成本。
(5)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的Br-的百分含量如图:

注: 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。
①“氧化”的适宜条件为_______ 。
②已知:海水中溴的浓度是64 mg/L ,经该方法处理后1m3海水最终得到 38.4g Br2,则溴的总提取率为_______ 。
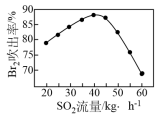
③吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:___________ 。
Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。如图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2 + I- I
I ;
;
②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I )有很强的交换吸附能力;
)有很强的交换吸附能力;
③步骤“交换吸附”发生的反应:R-Cl+I =R-I3+Cl-。
=R-I3+Cl-。
试回答下列问题:
(6)下列各步反应中,属于氧化还原反应的有:_______(填序号)
(7)酸性条件下,原料被H2O2氧化时发生的反应有:①_______ ;②I2+I- I
I 。
。
(8)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于_______ 。
I.利用空气吹出法从海水(弱碱性)中提取溴的流程如图。

已知:溴单质的沸点为58.5℃。
(1)溴元素在元素周期表中的位置是
(2)“吸收塔”中发生反应的离子方程式为
(3)“蒸馏塔”中温度应控制在
A.40~50℃ B.70~80℃ C.100℃以上
(4)物质A
(5)探究“氧化”的适宜条件,测得不同条件下溶液中被氧化的Br-的百分含量如图:

注:
 表示加入氯元素与海水中溴元素物质的量之比。
表示加入氯元素与海水中溴元素物质的量之比。①“氧化”的适宜条件为
②已知:海水中溴的浓度是64 mg/L ,经该方法处理后1m3海水最终得到 38.4g Br2,则溴的总提取率为
③吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:

Ⅱ.离子交换法从海带中提取碘是一种较为先进的制碘工艺。如图是使用离子交换树脂的“离子交换法”从海带中提取碘的主要流程。

已知:①I2 + I-
 I
I ;
;②强碱性阴离子树脂(用R-Cl表示,Cl-可被其它更易被吸附的阴离子替代)对多碘离子(I
 )有很强的交换吸附能力;
)有很强的交换吸附能力;③步骤“交换吸附”发生的反应:R-Cl+I
 =R-I3+Cl-。
=R-I3+Cl-。试回答下列问题:
(6)下列各步反应中,属于氧化还原反应的有:_______(填序号)
| A.交换吸附 | B.洗脱 | C.酸化氧化 | D.NaCl洗脱 |
 I
I 。
。(8)实验室模拟步骤“酸化氧化”,一般选用氯水。工业上生产企业可以按照自己的实际情况,选择合适的氧化剂。若某企业在酸性条件下选择NaNO2为氧化剂,反应生成一种无色气体,遇空气立即变为红棕色,则添加氧化剂与NaI的质量比应不少于
您最近一年使用:0次
名校
解题方法
5 . 海洋资源的利用具有广阔前景。
I.从海水中提取溴的工艺流程如图所示。

(1)步骤Ⅰ、步骤Ⅲ发生反应的离子反应方程式为_________ 、_______________ 。
(2)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的
,利用了溴的______________ (填性质)
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:________________ 。
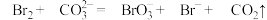
(4)步骤Ⅱ中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。若海水中溴含量约为65 从1000L海水中提取溴,理论上需要
从1000L海水中提取溴,理论上需要 的质量为
的质量为______________ 。
Ⅱ.海带中含有碘元素。实验室提取碘的步骤如下所示:
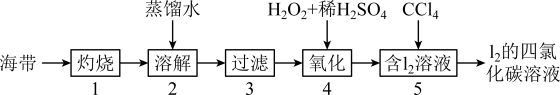
(5)灼烧海带至灰烬时会用到下列仪器中的______________ 。(填字母)
A.酒精灯 B.漏斗 C.坩埚 D.泥三角 E.烧杯
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤______________ (填序号)中实现与碘分离。
(7)写出步骤④反应的离子方程式________________ 。
I.从海水中提取溴的工艺流程如图所示。

(1)步骤Ⅰ、步骤Ⅲ发生反应的离子反应方程式为
(2)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的
,利用了溴的(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
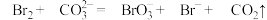
(4)步骤Ⅱ中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。若海水中溴含量约为65
 从1000L海水中提取溴,理论上需要
从1000L海水中提取溴,理论上需要 的质量为
的质量为Ⅱ.海带中含有碘元素。实验室提取碘的步骤如下所示:

(5)灼烧海带至灰烬时会用到下列仪器中的
A.酒精灯 B.漏斗 C.坩埚 D.泥三角 E.烧杯
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤
(7)写出步骤④反应的离子方程式
您最近一年使用:0次
名校
6 . 碘是动植物和人体必需的微量元素,I-的氧化和单质I2的分离是海带中碘元素分离的关键步骤。某学习小组在实验室对海带中碘元素进行分离和含量测定,并进行实验改进。
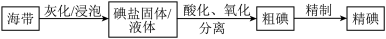
(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为______ 、_____ 。
(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为_____ 。而且该反应过程放出大量热,会对I2的提取造成的影响是_____ 。
(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为_____ 。
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为_____ 。

(1)海带中的碘元素以碘化物的形式存在,在酸化、氧化操作中,该小组首先选用氯水作为氧化剂,当氯水过量时碘单质被继续氧化成IO
 ,与该过程相关的离子方程式为
,与该过程相关的离子方程式为(2)针对以上出现的问题,该小组对实验进行改进,采用双氧水做氧化剂,逐滴滴加到过量I-溶液中,溶液颜色逐渐由黄色变为棕色。其反应原理为:①2I-+2H++H2O2=I2+2H2O②I-+I2=I
 (低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为
(低浓度为黄色,高浓度为棕色)。过氧化氢过量时:③I2+5H2O2=HIO3(无色溶液)+4H2O。如果双氧水滴加过量,造成的影响为(3)该小组针对问题又提出新的解决办法,采用溶液反加法,将I-溶液缓慢滴加到足量酸酸化的H2O2中,其反应如下:①2I-+2H++H2O2=I2+2H2O②I2+5H2O2=2HIO3+4H2O③4HI+2HIO3=3I2+6H2O。缓慢滴加过程中至反应结束,可观察到混合液颜色变化和现象为
A.黄色逐渐加深,直到紫色沉淀析出
B.紫色逐渐加深,直到紫色沉淀析出
C.黄色逐渐变为棕色,直到紫色沉淀析出
D.黄色变无色,再变为黄色,搅拌后变为无色……,直到紫色沉淀析出
该实验改进措施最大的优点为
您最近一年使用:0次
名校
7 . 某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一)碘含量的测定

取100.00mL海带浸取原液于锥形瓶中,用 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
(1)仪器A的名称为_______ ;仪器B的名称为:_______ 。
(2)计算海带中碘的百分含量为_______ %。
实验(二)碘的制取
另取海带浸取原液,甲、乙两种实验方案如下:
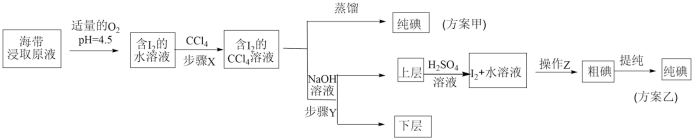
已知: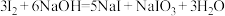 ;酸性条件下,
;酸性条件下, 在水溶液中的溶解度很小。
在水溶液中的溶解度很小。
(3)“适量 ”中能代替
”中能代替 的最佳物质的电子式为
的最佳物质的电子式为_______ 。
(4)步骤X中,萃取后分液漏斗内观察到的现象是_______ 。
(5)下列有关步骤Y的说法,正确的是_______。
(6)方案乙中,上层液体加入 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:_______ ,其中操作Z的名称是_______ 。
实验(一)碘含量的测定

取100.00mL海带浸取原液于锥形瓶中,用
 的
的 标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。
标准溶液测定其中的碘,消耗标准溶液体积的平均值为20.00mL。(1)仪器A的名称为
(2)计算海带中碘的百分含量为
实验(二)碘的制取
另取海带浸取原液,甲、乙两种实验方案如下:

已知:
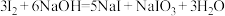 ;酸性条件下,
;酸性条件下, 在水溶液中的溶解度很小。
在水溶液中的溶解度很小。(3)“适量
 ”中能代替
”中能代替 的最佳物质的电子式为
的最佳物质的电子式为(4)步骤X中,萃取后分液漏斗内观察到的现象是
(5)下列有关步骤Y的说法,正确的是_______。
A.应控制 溶液的浓度和体积 溶液的浓度和体积 | B.将碘转化成离子进入水层 |
| C.主要是除浸取原液中的有机杂质 | D. 溶液可由乙醇代替 溶液可由乙醇代替 |
 溶液,反应的离子方程式为:
溶液,反应的离子方程式为:
您最近一年使用:0次
8 . 如图是工业上从海带中提取碘的流程,下列说法不正确的是


| A.碘在海水中含量比较高,工业提碘可直接对海水进行一系列化学操作,不需要浓缩 |
| B.浸泡液中含有I-、可溶性有机质等,氢氧化钠可使可溶性有机质形成沉淀 |
| C.如果用过氧化氢溶液氧化,发生的反应为2I-+H2O2+2H+=I2+2H2O |
| D.可用淀粉检验“滤液”中的I-离子是否氧化 |
您最近一年使用:0次
2022-05-03更新
|
605次组卷
|
6卷引用:辽宁省沈阳市市级重点高中联合体 2020-2021学年高一下学期期中测试化学试题
辽宁省沈阳市市级重点高中联合体 2020-2021学年高一下学期期中测试化学试题(已下线)章末培优 第8章 化学与可持续发展-2021-2022学年高一化学课后培优练(人教版2019必修第二册)(已下线)第13练 自然资源的开发利用-2022年【暑假分层作业】高一化学(人教版2019必修第二册)(已下线)微专题19 海水资源的综合利用(提取溴和碘)-备战2023年高考化学一轮复习考点微专题(已下线)第八章 化学与可持续发展(B卷·能力提升练)-【单元测试】2022-2023学年高一化学分层训练AB卷(人教版2019必修第二册)(已下线)第八章 化学与可持续发展【单元测试B卷】
名校
解题方法
9 . Ⅰ.工业以浓缩海水为原料提取溴的部分过程如图:
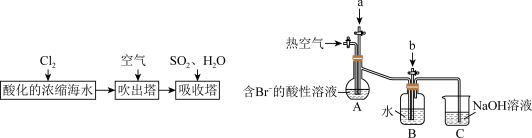
某课外小组在实验室模拟上述过程设计如图装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。
(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_______ 。
(2)反应过程中,B装置中 与
与 反应的化学方程式为
反应的化学方程式为_______ 。
(3)为提取B装置中的溴元素进行如下实验:向反应后B装置的溶液中通入氯气,充分反应得到混合液。再加入苯,后续实验操作步跟包含_______(填标号)。
Ⅱ.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:

(4)步骤④发生的离子反应方程式为_______ 。
(5)步骤⑤中用于提取碘的物质还可以是_______(填标号)。
(6)步骤⑥可通过反萃取法得到单质碘。向含碘苯溶液中加入浓 溶液,得到含
溶液,得到含 的溶液,反应的离子方程式为
的溶液,反应的离子方程式为_______ 。
(7)实验室常用碘量法测定溶液中 的含量。取
的含量。取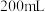 样品,加入
样品,加入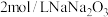 溶液,发生反应
溶液,发生反应 ,充分反应后,消耗
,充分反应后,消耗 溶液
溶液 。则该样品中
。则该样品中 的含量是
的含量是_______ 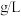 。
。

某课外小组在实验室模拟上述过程设计如图装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。
(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)
(2)反应过程中,B装置中
 与
与 反应的化学方程式为
反应的化学方程式为(3)为提取B装置中的溴元素进行如下实验:向反应后B装置的溶液中通入氯气,充分反应得到混合液。再加入苯,后续实验操作步跟包含_______(填标号)。
| A.过滤 | B.萃取、分液 | C.结晶 | D.蒸馏 |
Ⅱ.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:

(4)步骤④发生的离子反应方程式为
(5)步骤⑤中用于提取碘的物质还可以是_______(填标号)。
| A.乙醇 | B.四氯化碳 | C.乙酸 | D.环己烷 |
 溶液,得到含
溶液,得到含 的溶液,反应的离子方程式为
的溶液,反应的离子方程式为(7)实验室常用碘量法测定溶液中
 的含量。取
的含量。取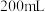 样品,加入
样品,加入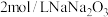 溶液,发生反应
溶液,发生反应 ,充分反应后,消耗
,充分反应后,消耗 溶液
溶液 。则该样品中
。则该样品中 的含量是
的含量是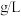 。
。
您最近一年使用:0次
名校
10 . 海洋资源的利用具有广阔前景。
Ⅰ.海带中含有丰富的碘元素。灼烧海带获取的海带灰中碘元素主要以I-形式存在。在实验室中,从海带灰中提取碘的流程如图:

回答下列问题:
(1)实验室灼烧海带的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、____ (填字母)。
(2)上述流程②主要操作步骤如图,不正确的是____ (填“甲”、“乙”或“丙”)。
甲.加入萃取剂后振荡 乙.静置分层
乙.静置分层 丙.分离
丙.分离
(3)步骤④中反应的离子方程式为____ ,在此反应中,每生成3.81gI2转移____ mol电子。
(4)上述流程中,含I2的水溶液经3步转化为含I2的悬浊液,主要目的是____ 。
Ⅱ.海水中Br-含量为65mg•L-1,工业上常用“吹出法”从海水中提溴,工艺流程示意图如图,回答下列问题:

(5)“吹出法”其过程主要包括氧化、吹出、吸收、____ 等环节。
(6)吸收塔中Br2的吸收率可达95%,吸收塔中主要反应的离子方程式是____ 。
Ⅰ.海带中含有丰富的碘元素。灼烧海带获取的海带灰中碘元素主要以I-形式存在。在实验室中,从海带灰中提取碘的流程如图:

回答下列问题:
(1)实验室灼烧海带的主要仪器有酒精灯、三脚架、泥三角、玻璃棒、
A. | B. | C. | D. |
甲.加入萃取剂后振荡
 乙.静置分层
乙.静置分层 丙.分离
丙.分离
(3)步骤④中反应的离子方程式为
(4)上述流程中,含I2的水溶液经3步转化为含I2的悬浊液,主要目的是
Ⅱ.海水中Br-含量为65mg•L-1,工业上常用“吹出法”从海水中提溴,工艺流程示意图如图,回答下列问题:

(5)“吹出法”其过程主要包括氧化、吹出、吸收、
(6)吸收塔中Br2的吸收率可达95%,吸收塔中主要反应的离子方程式是
您最近一年使用:0次
2022-04-17更新
|
838次组卷
|
3卷引用:福建省龙岩市一级校联盟(九校)2021-2022学年高一下学期期中联考化学试题
福建省龙岩市一级校联盟(九校)2021-2022学年高一下学期期中联考化学试题福建省厦门集美中学2021-2022学年高一下学期期中考试化学试题(已下线)微专题19 海水资源的综合利用(提取溴和碘)-备战2023年高考化学一轮复习考点微专题



