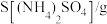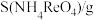钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。如图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图。
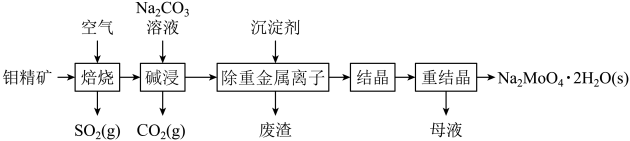
(1)在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶加入,这样处理的目的是___ ,焙烧钼精矿所用的装置是多层焙烧炉,如图为各炉层固体物料的物质的量的百分数(φ)。
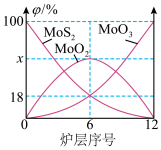
①x=___ 。
②“焙烧”时MoS2最终转化为MoO3,写出该反应的化学方程式:___ 。
(2)沉淀剂通常用Na2S,使用时若溶液pH较小,Pb2+沉淀不完全,原因是___ 。
(3)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO 。若滤液中c(MoO
。若滤液中c(MoO )=0.40mol•L-1,c(CO
)=0.40mol•L-1,c(CO )=0.10mol•L-1,当BaMoO4开始沉淀时,CO
)=0.10mol•L-1,当BaMoO4开始沉淀时,CO 的去除率是
的去除率是___ %[已知:Ksp(BaCO3)=1×10-9,Ksp(BaMoO4)=4.0×10-8,溶液体积变化忽略不计]。
(4)在碱性条件下,将钼精矿加入NaClO溶液中也能制备Na2MoO4,同时生成硫酸盐,该反应的离子方程式是___ 。
(5)钼酸盐对碳钢的腐蚀具有缓蚀作用,其原理是:在空气中钼酸盐能在钢铁表面形成FeMoO4——Fe2O3保护膜。在密闭式循环冷却水系统中,为缓蚀碳钢管道,除加入钼酸盐外还需加入的物质是___ (填选项字母)。
A.NaNO2 B.通入适量N2 C.油脂 D.盐酸

(1)在焙烧炉中,空气从炉底进入,矿石经粉碎后从炉顶加入,这样处理的目的是

①x=
②“焙烧”时MoS2最终转化为MoO3,写出该反应的化学方程式:
(2)沉淀剂通常用Na2S,使用时若溶液pH较小,Pb2+沉淀不完全,原因是
(3)“结晶”前需向滤液中加入Ba(OH)2固体以除去CO
 。若滤液中c(MoO
。若滤液中c(MoO )=0.40mol•L-1,c(CO
)=0.40mol•L-1,c(CO )=0.10mol•L-1,当BaMoO4开始沉淀时,CO
)=0.10mol•L-1,当BaMoO4开始沉淀时,CO 的去除率是
的去除率是(4)在碱性条件下,将钼精矿加入NaClO溶液中也能制备Na2MoO4,同时生成硫酸盐,该反应的离子方程式是
(5)钼酸盐对碳钢的腐蚀具有缓蚀作用,其原理是:在空气中钼酸盐能在钢铁表面形成FeMoO4——Fe2O3保护膜。在密闭式循环冷却水系统中,为缓蚀碳钢管道,除加入钼酸盐外还需加入的物质是
A.NaNO2 B.通入适量N2 C.油脂 D.盐酸
20-21高三上·山东烟台·期中 查看更多[2]
更新时间:2020-11-21 08:57:39
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】苯甲酸(C6H5COOH)的相对分子质量为122,熔点为122.4℃,沸点为249℃,密度为1.2659 g·cm-3,在水中的溶解度:0.35 g(25℃)、2.7 g(80℃)、5.9 g(100℃),不易被氧化,是一种一元有机弱酸,微溶于水、溶于乙醇。实验室中由甲苯(分子式:C6H5CH3、相对分子质量:92,沸点为110.6℃,密度为0.8669 g·cm-3)制备苯甲酸的实验如下:
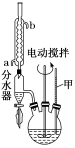
第一步:将9.2 g甲苯和硫酸酸化的KMnO4溶液(过量)置于如图的三颈烧瓶中,加热保持反应物溶液温度在90℃左右至反应结束,制备过程中不断从分水器分离出水。
第二步:将反应后混合液趁热过滤,滤液冷却后用硫酸酸化,抽滤得粗产品。
第三步:粗产品用水洗涤2到3次,干燥称量得固体11.7 g。
请回答下列问题:
(1)第一步发生反应的化学方程式为___________ 。
(2)分水器的作用是___________ ,判断该反应完成的现象是___________ 。
(3)第二步中抽滤的优点是___________ 。
(4)第三步证明粗产品洗涤干净的方法是___________ ;干燥的最佳方法是___________ (填代号)。
a.空气中自然风干 b.沸水浴干燥 c.直接加热干燥
(5)由以上数据知苯甲酸的产率为___________ 。
(6)设计合理的实验方案确定苯甲酸是弱酸,可从下列仪器和试剂中选择最简单的组合是___________ (填编号)。
①pH计 ②0.01 mol·L-1NaOH溶液 ③酚酞 ④甲基橙 ⑤1 mol·L-1NaOH溶液 ⑥0.01 mol·L-1苯甲酸溶液 ⑦滴定管 ⑧锥形瓶 ⑨量筒

第一步:将9.2 g甲苯和硫酸酸化的KMnO4溶液(过量)置于如图的三颈烧瓶中,加热保持反应物溶液温度在90℃左右至反应结束,制备过程中不断从分水器分离出水。
第二步:将反应后混合液趁热过滤,滤液冷却后用硫酸酸化,抽滤得粗产品。
第三步:粗产品用水洗涤2到3次,干燥称量得固体11.7 g。
请回答下列问题:
(1)第一步发生反应的化学方程式为
(2)分水器的作用是
(3)第二步中抽滤的优点是
(4)第三步证明粗产品洗涤干净的方法是
a.空气中自然风干 b.沸水浴干燥 c.直接加热干燥
(5)由以上数据知苯甲酸的产率为
(6)设计合理的实验方案确定苯甲酸是弱酸,可从下列仪器和试剂中选择最简单的组合是
①pH计 ②0.01 mol·L-1NaOH溶液 ③酚酞 ④甲基橙 ⑤1 mol·L-1NaOH溶液 ⑥0.01 mol·L-1苯甲酸溶液 ⑦滴定管 ⑧锥形瓶 ⑨量筒
您最近一年使用:0次
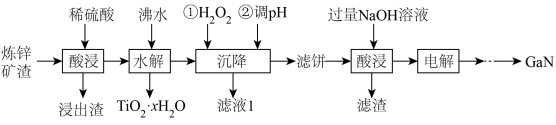
【推荐2】氮化镓( )具有优异的光电性能。一种利用炼锌矿渣[含
)具有优异的光电性能。一种利用炼锌矿渣[含 、
、 、
、 、
、 ]制备
]制备 的流程如下:
的流程如下:
已知:①“酸浸”后的溶液中,含有金属元素的离子有 、
、 、
、 、
、 、
、 ;
;
② 与
与 化学性质相似;
化学性质相似;
③该工艺条件下,相关金属离子开始沉淀和沉淀完全( )的pH范围如下表:
)的pH范围如下表:
(1)为提高酸浸效率,可采取的措施有________ (至少写两条);“沉降”时加 发生的离子方程式为
发生的离子方程式为________ 。
(2)利用表格中的数据计算 的
的
_______ 。
(3)酸浸液中加入沸水可使 发生水解,水解的离子方程式为
发生水解,水解的离子方程式为_________ 。
(4)滤液1中可回收利用的物质是_______ (填化学式,下同);“碱浸”后溶液中所含溶质有 、
、________ 。
(5)“沉降”时,调pH的理论范围为________ ;当 恰好完全沉淀时,溶液中
恰好完全沉淀时,溶液中 的浓度为
的浓度为________  。
。
 )具有优异的光电性能。一种利用炼锌矿渣[含
)具有优异的光电性能。一种利用炼锌矿渣[含 、
、 、
、 、
、 ]制备
]制备 的流程如下:
的流程如下:
已知:①“酸浸”后的溶液中,含有金属元素的离子有
 、
、 、
、 、
、 、
、 ;
;②
 与
与 化学性质相似;
化学性质相似;③该工艺条件下,相关金属离子开始沉淀和沉淀完全(
 )的pH范围如下表:
)的pH范围如下表:| 离子 |  |  |  |  |
| 开始沉淀的pH | 3.0 | 7.6 | 1.7 | 5.5 |
| 沉淀完全的pH | 4.9 | 9.6 | 3.2 | 8.0 |
(1)为提高酸浸效率,可采取的措施有
 发生的离子方程式为
发生的离子方程式为(2)利用表格中的数据计算
 的
的
(3)酸浸液中加入沸水可使
 发生水解,水解的离子方程式为
发生水解,水解的离子方程式为(4)滤液1中可回收利用的物质是
 、
、(5)“沉降”时,调pH的理论范围为
 恰好完全沉淀时,溶液中
恰好完全沉淀时,溶液中 的浓度为
的浓度为 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】镍及硫酸镍在新型材料、新型电池的生产中有着十分广泛的应用。工业上以硫化镍矿(含少量杂质硫化铜、硫化亚铁)为原料制备纯镍或硫酸镍的流程如下:

已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);
②常温下溶度积常数: 、
、 。
。
(1)步骤①所得炉气和炉渣均能使酸性高锰酸钾溶液褪色,其中炉渣能使酸性高锰酸钾溶液褪色的原因是____ ;炉气使酸性高锰酸钾溶液褪色的离子方程式为____ 。
(2)步骤③经相应溶剂萃取后得到NiSO4溶液的操作;在实验室中进行所需要使用的玻璃仪器有___ 。
(3)步骤⑥以NiS(含CuS)作阳极、NiSO4溶液作电解液电解可在___ 极(填“阳”或“阴”)获得粗镍,阳极的主要电极反应式为____ 。粗镍的电解精炼需要将电解液的pH控制在2~5之间,下列有关说法错误的是_____ (填序号)。
A.防止溶液的酸性过强造成 放电,在阴极生成H2
放电,在阴极生成H2
B.防止溶液的酸性过弱使Ni2+转化成Ni(OH)2沉淀
C.若溶液的pH<2,可加入NiO或Ni(OH)2固体调节溶液的pH
D.使粗镍中所含的杂质Cu在阳极放电而进入电解液中
(4)化学上常认为残留在溶液中的离子浓度小于 时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+,若该溶液中的
时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+,若该溶液中的 ,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:
,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:____ 。

已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);
②常温下溶度积常数:
 、
、 。
。(1)步骤①所得炉气和炉渣均能使酸性高锰酸钾溶液褪色,其中炉渣能使酸性高锰酸钾溶液褪色的原因是
(2)步骤③经相应溶剂萃取后得到NiSO4溶液的操作;在实验室中进行所需要使用的玻璃仪器有
(3)步骤⑥以NiS(含CuS)作阳极、NiSO4溶液作电解液电解可在
A.防止溶液的酸性过强造成
 放电,在阴极生成H2
放电,在阴极生成H2B.防止溶液的酸性过弱使Ni2+转化成Ni(OH)2沉淀
C.若溶液的pH<2,可加入NiO或Ni(OH)2固体调节溶液的pH
D.使粗镍中所含的杂质Cu在阳极放电而进入电解液中
(4)化学上常认为残留在溶液中的离子浓度小于
 时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+,若该溶液中的
时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+,若该溶液中的 ,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:
,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
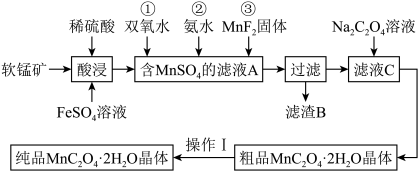
【推荐1】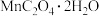 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿 主要成分为
主要成分为 ,含少量
,含少量 、
、 和
和 制备
制备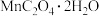 ,设计流程如图:
,设计流程如图: 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入
已知:常温时部分难溶化合物的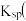 近似值
近似值 如表:
如表:
(1)该小组同学在酸浸之前,先将软锰矿粉碎,其目的是________ 。
(2)“酸浸”过程中 发生反应的离子方程式为
发生反应的离子方程式为________ 。
(3)加入 固体的作用是
固体的作用是________ ,甲同学提出将上述流程中的氨水换成氢氧化钠溶液,乙同学觉得不妥,乙同学的理由是________ 。
(4)丙同学认为向滤液C中滴加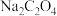 溶液的过程中可能会生成
溶液的过程中可能会生成 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为 ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数
________  填数值
填数值 。
。 已知
已知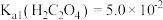 ,
,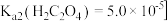 。
。
(5)操作Ⅰ的名称为________ 。
(6)如图是小组同学将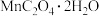 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度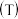 变化的曲线
变化的曲线 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在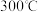 以下不变
以下不变 。
。
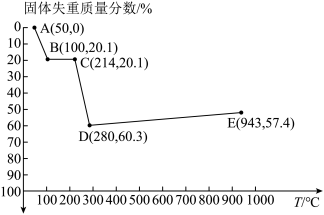
试根据各点的坐标 近似值
近似值 回答下列问题:
回答下列问题:
① 的化学方程式为
的化学方程式为________ 。
②从D点到E点过程中固体失重的质量分数下降的原因是________ 。
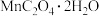 是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿
是一种常见的化学试剂,是制备其他含锰化合物的重要原料。某课外化学兴趣小组利用软锰矿 主要成分为
主要成分为 ,含少量
,含少量 、
、 和
和 制备
制备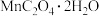 ,设计流程如图:
,设计流程如图: 注:试剂①②③按编号顺序加入
注:试剂①②③按编号顺序加入

已知:常温时部分难溶化合物的
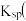 近似值
近似值 如表:
如表:| 物质 | 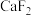 |  | 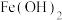 | 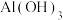 | 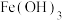 |
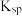 |  |  | 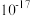 |  | 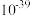 |
(2)“酸浸”过程中
 发生反应的离子方程式为
发生反应的离子方程式为(3)加入
 固体的作用是
固体的作用是(4)丙同学认为向滤液C中滴加
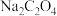 溶液的过程中可能会生成
溶液的过程中可能会生成 沉淀,并提出可能的原因为
沉淀,并提出可能的原因为 ,常温时,该反应的平衡常数
,常温时,该反应的平衡常数
 填数值
填数值 。
。 已知
已知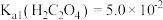 ,
,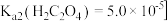 。
。(5)操作Ⅰ的名称为
(6)如图是小组同学将
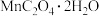 晶体放在坩埚里加热分解时,固体失重质量分数随温度
晶体放在坩埚里加热分解时,固体失重质量分数随温度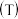 变化的曲线
变化的曲线 已知草酸锰不稳定,但其中锰元素的化合价在
已知草酸锰不稳定,但其中锰元素的化合价在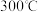 以下不变
以下不变 。
。
试根据各点的坐标
 近似值
近似值 回答下列问题:
回答下列问题:①
 的化学方程式为
的化学方程式为②从D点到E点过程中固体失重的质量分数下降的原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝。对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属的工艺路线如图: 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、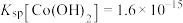 、
、 。
。
回答下列问题:
(1)写出一条提高焙烧效率的措施:_______ 。
(2)若烧渣是LiCl、 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:_______ 。
(3)简述洗涤滤饼3的操作:_______ 。
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①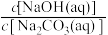
_______ (填“>”、“<”或“=”)1。
②三种溶液中由水电离出的 的浓度的关系是
的浓度的关系是_______ (用a、b、c表示)。
(5)Co2+完全沉淀时(溶液中离子浓度小于 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为_______ 。
(6)煅烧滤饼2时发生反应的化学方程式为_______ ,得到的 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为_______ 。

 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、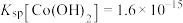 、
、 。
。回答下列问题:
(1)写出一条提高焙烧效率的措施:
(2)若烧渣是LiCl、
 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:(3)简述洗涤滤饼3的操作:
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①
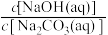
②三种溶液中由水电离出的
 的浓度的关系是
的浓度的关系是(5)Co2+完全沉淀时(溶液中离子浓度小于
 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为(6)煅烧滤饼2时发生反应的化学方程式为
 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】工业上以菱锰矿(主要成分是MnCO3,还含有Fe2+、Ni2+等)为原料制备电解锰的工艺流程如图所示。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
回答下列问题:
(1)浸出槽中发生多个反应:如主要成分与稀硫酸的反应、MnO2与Fe2+间的氧化还原反应等。这两个反应的离子方程式分别为___________ 、___________ 。
(2)加入氨水的目的是为除去杂质,根据流程图及表中数据,pH应调控在___________ 范围内。常温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=4时,溶液中c(Fe3+)=___________ 。
(3)加入硫化铵是为除去剩余的Ni2+,由此可判断相同温度下溶解度:NiS_______ Ni(OH)2(填“大于”或“小于”)。
(4)电解硫酸锰溶液的化学方程式为___________ 。
(5)工业上也可以用MnO2和Al粉作为原料,用铝热反应来制取金属锰,反应的化学方程式为_____ 。
(6)将分离出电解锰后的稀硫酸收集、循环使用,其意义是________ 。

溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 | Ni2+ | Mn2+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01mol‧L-1)的pH | 7.2 | 8.3 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0×10-5mol‧L-1)的pH | 8.7 | 9.8 | 3.2 | 9.0 |
(1)浸出槽中发生多个反应:如主要成分与稀硫酸的反应、MnO2与Fe2+间的氧化还原反应等。这两个反应的离子方程式分别为
(2)加入氨水的目的是为除去杂质,根据流程图及表中数据,pH应调控在
(3)加入硫化铵是为除去剩余的Ni2+,由此可判断相同温度下溶解度:NiS
(4)电解硫酸锰溶液的化学方程式为
(5)工业上也可以用MnO2和Al粉作为原料,用铝热反应来制取金属锰,反应的化学方程式为
(6)将分离出电解锰后的稀硫酸收集、循环使用,其意义是
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】一化学兴趣小组,探究从某工业废水(含有大量的FeSO4、较多的Cu2+ 和少量的Na+)中回收FeSO4制备绿矾(FeSO4·7H2O),同时回收金属铜的方法,以减少污染并变废为宝。以下是他们设计出的回收流程图,回答有关问题:
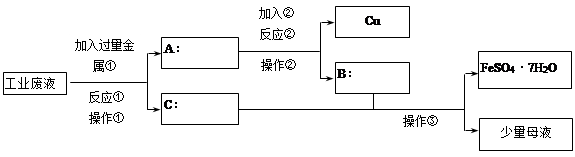
(1)加入的金属①为(填物质名称)______________ ,加入②后反应的离子方程式为_______________________ 。
(2)操作②的名称为_________________ ,用到的玻璃仪器有______________________ 。
(3)反应①和②都是氧化还原反应,写出反应①的离子方程式并用单线桥标出电子转移的方向和数目________________________ 。
(4)母液中含有的离子有(填离子符号):_______________________________ 。

(1)加入的金属①为(填物质名称)
(2)操作②的名称为
(3)反应①和②都是氧化还原反应,写出反应①的离子方程式并用单线桥标出电子转移的方向和数目
(4)母液中含有的离子有(填离子符号):
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】铼(Re)是具有重要军事战略意义的金属。NH4ReO4是制备高纯度Re的原料,实验室用Re2O7制备NH4ReO4的装置如图所示。

已知:Ⅰ. Re2O7易溶于水,溶于水后生成HReO4;HReO4与H2S反应生成Re2S7;
有关物质的溶解度S见下表:
回答下列问题:
(1)仪器a的名称是_______ ,a中发生反应的离子方程式为_______ 。
(2)反应开始前先向C中三颈烧瓶内加入一定量的Re2O7和水。关闭K2、K3,打开K1、K4,三颈烧瓶内生成Re2S7。关闭K1,打开K2通入N2一段时间,通入N2的目的是_______ ;打开K3,滴入足量H2O2的氨水溶液,生成NH4ReO4;反应结束后从溶液中分离NH4ReO4的操作方法是_______ 。
(3)下列装置可用作装置单元X的是_______ (填标号)。

(4)取mg NH4ReO4样品,在加热条件下使其分解,产生的氨气用硼酸(H3BO3)吸收。吸收液用浓度为c mol/L的盐酸滴定,消耗盐酸V mL。NH4ReO4的纯度为_______ ;下列情况会导致NH4ReO4纯度测量值偏小的是_______ (填标号)。
a.未用盐酸标准液润洗酸式滴定管
b.滴定开始时俯视读数,滴定后平视读数
c.加热温度过高,NH4ReO4分解产生N2
d.滴定结束时发现滴定管尖嘴内有气泡

已知:Ⅰ. Re2O7易溶于水,溶于水后生成HReO4;HReO4与H2S反应生成Re2S7;
有关物质的溶解度S见下表:
| 温度/℃ |
|
|
| 20 | 75.4 | 6.1 |
| 30 | 78.0 | 32.3 |
Ⅱ. ;
;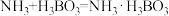 ;
;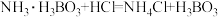
回答下列问题:
(1)仪器a的名称是
(2)反应开始前先向C中三颈烧瓶内加入一定量的Re2O7和水。关闭K2、K3,打开K1、K4,三颈烧瓶内生成Re2S7。关闭K1,打开K2通入N2一段时间,通入N2的目的是
(3)下列装置可用作装置单元X的是

(4)取mg NH4ReO4样品,在加热条件下使其分解,产生的氨气用硼酸(H3BO3)吸收。吸收液用浓度为c mol/L的盐酸滴定,消耗盐酸V mL。NH4ReO4的纯度为
a.未用盐酸标准液润洗酸式滴定管
b.滴定开始时俯视读数,滴定后平视读数
c.加热温度过高,NH4ReO4分解产生N2
d.滴定结束时发现滴定管尖嘴内有气泡
您最近一年使用:0次