第19届(2006年1月7日)全国高中学生化学竞赛试题(决赛)理论试题
全国
高三
竞赛
2021-07-15
155次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、竞赛、有机化学基础、物质结构与性质
第19届(2006年1月7日)全国高中学生化学竞赛试题(决赛)理论试题
全国
高三
竞赛
2021-07-15
155次
整体难度:
适中
考查范围:
认识化学科学、化学反应原理、竞赛、有机化学基础、物质结构与性质
一、解答题 添加题型下试题
解答题-无机推断题
|
适中(0.65)
解题方法
1. 钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。钨在自然界主要以钨(VI)酸盐的形式存在。有开采价值的钨矿石是白钨矿和黑钨矿。白钨矿的主要成分是钨酸钙(CaWO4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO4。黑钨矿传统冶炼工艺的第一阶段是碱熔法:
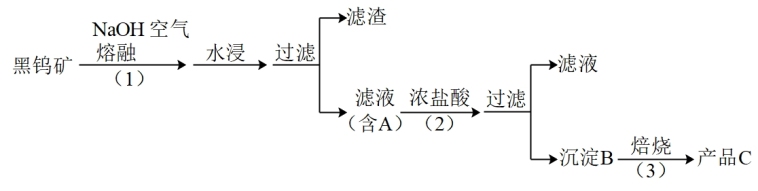
其中A、B、C都是钨的化合物。
(1)写出上述流程中A、B、C的化学式:A_______ 、B_______ 、C_______ ,以及步骤(1)、(2)、(3)中发生反应的化学方程式(1)_______ 、(2)_______ 、(3)_______ 。
(2)钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时,可用碳作还原剂。
①写出用碳还原氧化钨制取金属钨的化学方程式_______ 。
②用下表所给的298.15K的数据计算上述反应的标准自由能变化。推出该反应在什么温度条件下能自发进行_______ 。(假设表中数据不随温度变化)
(3)为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,为什么_______ ?写出用氢气还原氧化钨的化学方程式_______ 。
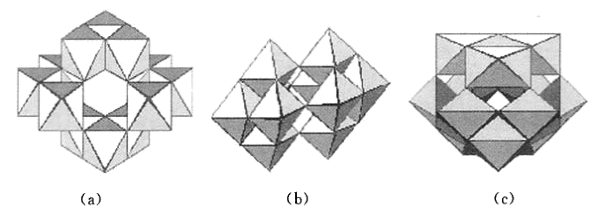
(4)在酸化钨酸盐的过程中,钨酸根WO 可能在不同程度上缩合形成多钨酸根。多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含1个中心W原子和6个配位0原子的钨氧八面体WO6通过共顶或共边的方式形成。在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2Wl2O40]6-。在下面3张结构图中,哪一张是仲钨酸根的结构?简述判断理由
可能在不同程度上缩合形成多钨酸根。多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含1个中心W原子和6个配位0原子的钨氧八面体WO6通过共顶或共边的方式形成。在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2Wl2O40]6-。在下面3张结构图中,哪一张是仲钨酸根的结构?简述判断理由_______ 。
(5)仲钨酸的肼盐在热分解时会发生内在氧化还原反应,我国钨化学研究的奠基人顾翼东先生采用这一反应制得了蓝色的非整比的钨氧化物WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点,在制钨粉时温度容易控制,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析,得知蓝色氧化钨中钨的质量分数为0.7985。
①计算WO3-x中的x值_______ 。
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价2种价态的钨。试计算蓝色氧化钨中这2种价态的钨原子数比_______ 。(相对原子质量:W-183.84;O-16.00)

其中A、B、C都是钨的化合物。
(1)写出上述流程中A、B、C的化学式:A
(2)钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。对钨的纯度要求不高时,可用碳作还原剂。
①写出用碳还原氧化钨制取金属钨的化学方程式
②用下表所给的298.15K的数据计算上述反应的标准自由能变化。推出该反应在什么温度条件下能自发进行
| 物质 |  (kJ·mol-1) (kJ·mol-1) |  (J·mol-1·K-1) (J·mol-1·K-1) |
| W(s) WO3(s) C(石墨) CO(g) CO2(g) H2(g) H2O(g) H2O(l) | 0 -842.87 0 -110.52 -393.51 0 -241.82 -285.31 | 32.64 75.90 5.74 197.56 213.64 130.57 188.72 69.90 |
(4)在酸化钨酸盐的过程中,钨酸根WO
 可能在不同程度上缩合形成多钨酸根。多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含1个中心W原子和6个配位0原子的钨氧八面体WO6通过共顶或共边的方式形成。在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2Wl2O40]6-。在下面3张结构图中,哪一张是仲钨酸根的结构?简述判断理由
可能在不同程度上缩合形成多钨酸根。多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含1个中心W原子和6个配位0原子的钨氧八面体WO6通过共顶或共边的方式形成。在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H2W12O42]10-和偏钨酸根[H2Wl2O40]6-。在下面3张结构图中,哪一张是仲钨酸根的结构?简述判断理由
(5)仲钨酸的肼盐在热分解时会发生内在氧化还原反应,我国钨化学研究的奠基人顾翼东先生采用这一反应制得了蓝色的非整比的钨氧化物WO3-x。这种蓝色氧化钨具有比表面大、易还原的优点,在制钨粉时温度容易控制,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。经分析,得知蓝色氧化钨中钨的质量分数为0.7985。
①计算WO3-x中的x值
②一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价2种价态的钨。试计算蓝色氧化钨中这2种价态的钨原子数比
您最近一年使用:0次
二、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
2. 磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、营养、肥料、阻燃、去油去污、防腐蚀、防锈、锅炉水处理等。
(1)连二磷酸H4P2O6是一种四元酸,它的结构式为_______ 。
(2)在0℃时,H4P2O6在空气中是稳定的,温度升高,部分转变成它的异构体,结构式为_______ ;也有部分会发生歧化反应,生成另外两种各含2个磷原子的含氧酸,它们的结构式为_______ 和_______ 。H4P2O6在酸性介质中加热会分解成两种磷的含氧酸,化学方程式为_______ 。
(3)制备连二磷酸可从制备其钠盐出发。在5℃把红磷加入到剧烈搅拌的NaOH(0.2mol·L-1)和NaClO(1.5mol·L-1)混合溶液中,反应得Na2H2P2O6,化学方程式为_______ 。
(4)将纯化后的二钠盐溶于水,再通过_______ ,即可获得纯的连二磷酸的水溶液,然后减压蒸发可得连二磷酸晶体。
(1)连二磷酸H4P2O6是一种四元酸,它的结构式为
(2)在0℃时,H4P2O6在空气中是稳定的,温度升高,部分转变成它的异构体,结构式为
(3)制备连二磷酸可从制备其钠盐出发。在5℃把红磷加入到剧烈搅拌的NaOH(0.2mol·L-1)和NaClO(1.5mol·L-1)混合溶液中,反应得Na2H2P2O6,化学方程式为
(4)将纯化后的二钠盐溶于水,再通过
【知识点】 分子结构
您最近一年使用:0次
填空题
|
适中(0.65)
3. 四氧化三锰主要用于电子工业,是生产软磁铁氧体的原料之一。
(1)四氧化三锰的制法有焙烧法和还原法两类。在还原法中,先将水锰矿(主要成分MnOOH)焙烧成三氧化二锰,再于250~500℃用甲烷还原生成四氧化三锰。请写出上述二步反应的化学方程式_______ 。
(2)通常所说的四氧化三锰中,锰的价态实际上既有二价,也有三价和四价。在某研究工作中,要求得知四氧化三锰中不同价态锰的比值,采用的测定方法步骤如下:
i.称取3份质量相同的试样。第一份以硫酸铵-硫酸溶液选择性溶解试样中的二价锰,过滤洗涤后,滤液用氨水中和并。用氨一氯化铵缓冲溶液调至pH10,加入必要的试剂和指示剂,用EDTA标准溶液(a1mol·L-1)滴定至终点,耗去b1mL。
ii.第二份试样中,准确加入过量的草酸钠标准溶液(a2mol·L-1,b2mL)和适量硫酸,加热使试样全部溶解,立即用高锰酸钾标准溶液(a3mol·L-1)滴定剩余的还原剂至终点,耗去b3mL。
iii.第三份试样中,同样加入过量的草酸钠标准溶液和适量硫酸,加热使全部溶解。冷却后用氨水中和并用氨-氯化铵缓冲溶液调至pH10,加入必要的试剂和指示剂,用EDTA标准溶液滴定至终点,耗去b4mL。
①写出步骤ii溶解试样时,不同价态锰的氧化物同草酸之间反应的化学方程式_______ ;写出用高锰酸钾滴定剩余还原剂的化学方程式_______ 。
②用a1、a2、a3、b1、b2、b3和b4写出试样中二价、三价和四价锰含量(分别用X、Y、Z表示)的计算式_______ ,单位用mmol表示。
(1)四氧化三锰的制法有焙烧法和还原法两类。在还原法中,先将水锰矿(主要成分MnOOH)焙烧成三氧化二锰,再于250~500℃用甲烷还原生成四氧化三锰。请写出上述二步反应的化学方程式
(2)通常所说的四氧化三锰中,锰的价态实际上既有二价,也有三价和四价。在某研究工作中,要求得知四氧化三锰中不同价态锰的比值,采用的测定方法步骤如下:
i.称取3份质量相同的试样。第一份以硫酸铵-硫酸溶液选择性溶解试样中的二价锰,过滤洗涤后,滤液用氨水中和并。用氨一氯化铵缓冲溶液调至pH10,加入必要的试剂和指示剂,用EDTA标准溶液(a1mol·L-1)滴定至终点,耗去b1mL。
ii.第二份试样中,准确加入过量的草酸钠标准溶液(a2mol·L-1,b2mL)和适量硫酸,加热使试样全部溶解,立即用高锰酸钾标准溶液(a3mol·L-1)滴定剩余的还原剂至终点,耗去b3mL。
iii.第三份试样中,同样加入过量的草酸钠标准溶液和适量硫酸,加热使全部溶解。冷却后用氨水中和并用氨-氯化铵缓冲溶液调至pH10,加入必要的试剂和指示剂,用EDTA标准溶液滴定至终点,耗去b4mL。
①写出步骤ii溶解试样时,不同价态锰的氧化物同草酸之间反应的化学方程式
②用a1、a2、a3、b1、b2、b3和b4写出试样中二价、三价和四价锰含量(分别用X、Y、Z表示)的计算式
您最近一年使用:0次
三、解答题 添加题型下试题
4. 轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,它的生产以白云石(主要成分是碳酸镁钙)为原料。
(1)石灰石和卤水长期作用形成白云石,写出该反应的离子方程式_______ 。
(2)如图是省略了部分原子或离子的白云石晶胞。
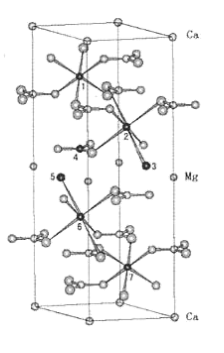
①写出图中标有1、2、3、4、5、6、7的原子或离子的元素符号_______ 。
②在答题纸的图中补上与3、5原子或离子相邻的其他原子或离子,再用连线表示它们与Mg的配位关系_______ 。
(3)白云石分解所得CaO和MgO,加水制成Mg(OH)2和Ca(OH)2的悬浮液,通入适量CO2(g),实现Ca2+、Mg2+的分离。
已知:
计算下列反应的平衡常数K_______
Mg(OH)2+Ca(OH)2+3CO2=Mg2++2HCO +CaCO3+H2O
+CaCO3+H2O
(4)25℃,100kPaCO2在水中溶解度为0.0343mol·L-1。将100molMgO和100molCaO加水制成1000L悬浮液,通入CO2,使Mg2+浓度达到0.100mol·L-1,Ca2+浓度不超过10-4mol·L-1,且不生成MgCO3沉淀。通过计算说明如何控制CO2的压力_______ (假设CO2在水中溶解符合亨利定律)。
(5)Mg(HCO3)2溶液加热分解,得到产品轻质碳酸镁(实为碱式碳酸盐)。18.26g轻质碳酸镁纯样品经高温分解完全后得8.06g固体,放出3.36L(折合成标准状况)二氧化碳,通过推算,写出轻质碳酸镁的化学式_______ (提示:轻质碳酸镁化学式所含的离子或分子数目为简单整数)。(相对原子质量:Mg-24.3;C-12.0;O-16.0;H-1.01)
(1)石灰石和卤水长期作用形成白云石,写出该反应的离子方程式
(2)如图是省略了部分原子或离子的白云石晶胞。

①写出图中标有1、2、3、4、5、6、7的原子或离子的元素符号
②在答题纸的图中补上与3、5原子或离子相邻的其他原子或离子,再用连线表示它们与Mg的配位关系
(3)白云石分解所得CaO和MgO,加水制成Mg(OH)2和Ca(OH)2的悬浮液,通入适量CO2(g),实现Ca2+、Mg2+的分离。
已知:
| Mg(OH)2 | Ksp=5.61×10-12 |
| Ca(OH)2 | Ksp=5.50×10-6 |
| MgCO3 | Ksp=6.82×10-6 |
| CaCO3 | Ksp=4.96×10-9 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
计算下列反应的平衡常数K
Mg(OH)2+Ca(OH)2+3CO2=Mg2++2HCO
 +CaCO3+H2O
+CaCO3+H2O(4)25℃,100kPaCO2在水中溶解度为0.0343mol·L-1。将100molMgO和100molCaO加水制成1000L悬浮液,通入CO2,使Mg2+浓度达到0.100mol·L-1,Ca2+浓度不超过10-4mol·L-1,且不生成MgCO3沉淀。通过计算说明如何控制CO2的压力
(5)Mg(HCO3)2溶液加热分解,得到产品轻质碳酸镁(实为碱式碳酸盐)。18.26g轻质碳酸镁纯样品经高温分解完全后得8.06g固体,放出3.36L(折合成标准状况)二氧化碳,通过推算,写出轻质碳酸镁的化学式
【知识点】 晶体
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
解题方法
5. 酒石酸在立体化学中有特殊的意义。著名法国科学家LouisPasteur曾通过研究酒石酸盐的晶体,发现了对映异构现象。在不对称合成中,手性酒石酸及其衍生物常被用作手性配体或用作制备手性配体的前体。
(1)天然L-(+)-酒石酸的Fischer投影式如图所示。请在答题纸所给出的结构图上用R或S标出L-(+)-酒石酸的手性碳构型,并用系统命名法命名_______ 。
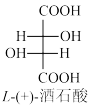
(2)在答题纸指定位置上画出L-(+)-酒石酸的非对映异构体的Fischer投影式_______ 。该化合物是否有旋光性_______ ?为什么_______ ?
(3)法国化学家H.B.Kagan曾以天然酒石酸为起始原料合成了一种重要的手性双膦配体DIOP,并用于烯烃的不对称均相催化氢化,获得很好的对映选择性。DIOP的合成路线如下:
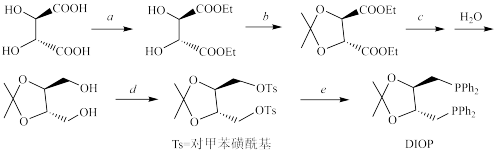
请在答卷纸的指定位置写出上述反应过程中a,b,c,d和e所代表的每一步反应的试剂及必要的反应条件:a_______ 、b_______ 、c_______ 、d_______ 、e_______ 。
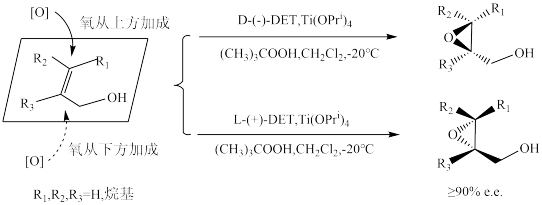
(4)美国化学家K.B.Sharpless发现了在手性酒石酸二乙酯(DET)和Ti(OPri)4的配合物催化下的烯丙醇类化合物的不对称环氧化反应,因而荣获2001年诺贝尔化学奖。该反应产物的立体化学受配体构型的控制,不同构型的DET使氧选择性地从双键平面上方或下方加成,如图所示:
该不对称环氧化反应曾被成功用于(+)-Disparlure(一种林木食叶書虫舞毒蛾性引诱剂)的合成上,合成路线如下:
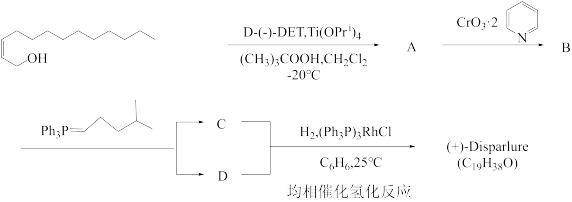
请在答卷纸的指定位置画出化合物A、B、C、D和(+)-Disparlure的立体结构:A_______ 、B_______ 、C_______ 、D_______ 、(+)-Disparlure_______ 。
(1)天然L-(+)-酒石酸的Fischer投影式如图所示。请在答题纸所给出的结构图上用R或S标出L-(+)-酒石酸的手性碳构型,并用系统命名法命名
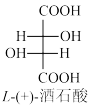
(2)在答题纸指定位置上画出L-(+)-酒石酸的非对映异构体的Fischer投影式
(3)法国化学家H.B.Kagan曾以天然酒石酸为起始原料合成了一种重要的手性双膦配体DIOP,并用于烯烃的不对称均相催化氢化,获得很好的对映选择性。DIOP的合成路线如下:

请在答卷纸的指定位置写出上述反应过程中a,b,c,d和e所代表的每一步反应的试剂及必要的反应条件:a
(4)美国化学家K.B.Sharpless发现了在手性酒石酸二乙酯(DET)和Ti(OPri)4的配合物催化下的烯丙醇类化合物的不对称环氧化反应,因而荣获2001年诺贝尔化学奖。该反应产物的立体化学受配体构型的控制,不同构型的DET使氧选择性地从双键平面上方或下方加成,如图所示:

该不对称环氧化反应曾被成功用于(+)-Disparlure(一种林木食叶書虫舞毒蛾性引诱剂)的合成上,合成路线如下:

请在答卷纸的指定位置画出化合物A、B、C、D和(+)-Disparlure的立体结构:A
您最近一年使用:0次
解答题-有机推断题
|
较难(0.4)
解题方法
6. 杂环化合物2-甲基四氢呋喃-3-酮(即目标产物1)是咖啡香气的主要成分之一,有多种合成方法。下面是一条由乙酰乙酸乙酯为起始原料的合成路线:
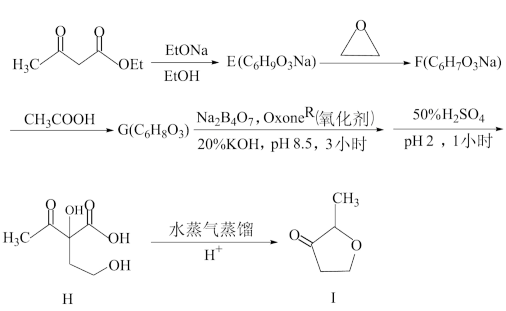
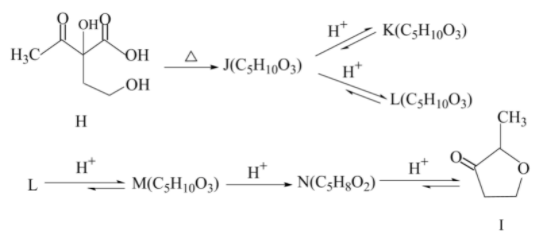
在合成路线的最后一步中,化合物H在水蒸气蒸馏过程中发生下列反应,最终转变为目标产物I:
提示:合成步骤中涉及到以下反应:
脱羧反应: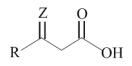

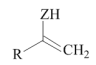 +CO2(Z=CH2或O)
+CO2(Z=CH2或O)
(1)请在答卷纸的指定位置写上化合物E、F,G、J、K、L、M和N的结构式E_______ 、F_______ 、G_______ 、J_______ 、K_______ 、L_______ 、M_______ 、N_______ 。
(2)请分别指出化合物J与K(或J与L),K与L之间是什么异构关系_______ 。
(3)除目标产物I被水蒸气蒸出之外,化合物K、L和M均留在母液中。请说明它们为什么不会被水蒸气蒸出_______ ?

在合成路线的最后一步中,化合物H在水蒸气蒸馏过程中发生下列反应,最终转变为目标产物I:

提示:合成步骤中涉及到以下反应:
脱羧反应:


 +CO2(Z=CH2或O)
+CO2(Z=CH2或O)(1)请在答卷纸的指定位置写上化合物E、F,G、J、K、L、M和N的结构式E
(2)请分别指出化合物J与K(或J与L),K与L之间是什么异构关系
(3)除目标产物I被水蒸气蒸出之外,化合物K、L和M均留在母液中。请说明它们为什么不会被水蒸气蒸出
【知识点】 有机化学
您最近一年使用:0次
解答题-结构与性质
|
较难(0.4)
解题方法
7. 沸石分子筛是重要的石油化工催化材料。如图是一种沸石晶体结构的一部分,其中多面体的每一个顶点均代表1个T原子(T可为Si或Al),每一条边代表1个氧桥(即连接2个T原子的氧原子)。该结构可以看成是由6个正方形和8个正六边形围成的凸多面体(称为β笼),通过六方柱笼与相邻的4个β笼相连形成的三维立体结构,如图所示:
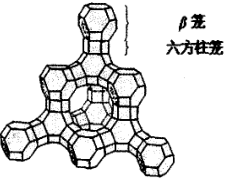
(1)完成下列问题:
①若将每个β笼看作1个原子,六方柱笼看作原子之间的化学键,图象可以简化成什么结构?在答题纸的指定位置画出这种结构的图形_______ 。
②该沸石属于14种布拉维点阵类型中的哪一种_______ ?指出其晶胞内有_______ 个β笼。
③假设该沸石骨架仅含有Si和O两种元素,写出其晶胞内每种元素的原子数_______ 。
④已知该沸石的晶胞参数a=2.34nm,试求该沸石的晶体密度_______ 。(相对原子质量:Si-28.0;O-16.0)
(2)方石英和上述假设的全硅沸石都由硅氧四面体构成,如图为方石英的晶胞示意图。
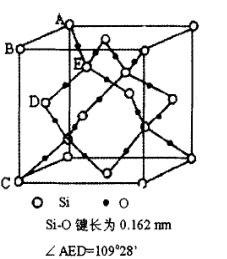
①求方石英的晶体密度_______ 。
②比较沸石和方石英的晶体密度来说明沸石晶体的结构特征_______ 。
(3)一般沸石由负电性骨架和骨架外阳离子构成,利用骨架外阳离子的可交换性,沸石可以作为阳离子交换剂或质子酸催化剂使用。如图为沸石的负电性骨架示意图:
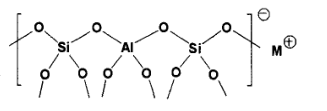
请在答题纸的图中画出图中所示负电性骨架结构的电子式_______ (用“●”表示氧原子提供的电子,用“x”表示T原子提供的电子,用“*”表示所带负电荷提供的电子)。
(4)以甲醇为甲基化试剂的甲苯甲基化反应是石油化工中制备对二甲苯的重要方法之一,常用沸石分子筛为固体酸催化剂。该过程包含如下反应网络:
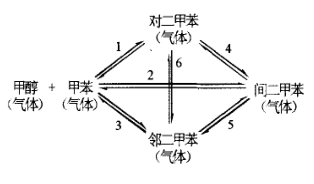
①其中有_______ 个热力学上独立的化学反应。
②若反应起始时体系中只有1摩尔甲醇和1摩尔甲苯,平衡时体系内对,间、邻二甲苯的含量分别为x,y,zmol,请写出反应1的平衡常数K1的表达式_______ (以x,y,z表示)。
③各物种在298.15K时的标准生成焓和熵列于下表:
根据表中的热力学数据(假设表中数据不随温度变化),计算500K下反应1的平衡常数_______ 。
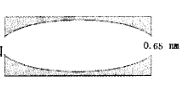
(5)若使用有效孔径为0.65nm的沸石分子筛为上述反应的催化剂,主要产物是_______ ?简述理由_______ 。(设苯的最小和最大直径分别为0.59nm和0.68nm,甲苯的最小和最大直径分别为0.59nm利0.78nm。如图为该沸石分子筛的孔道结构示意图。)。

(1)完成下列问题:
①若将每个β笼看作1个原子,六方柱笼看作原子之间的化学键,图象可以简化成什么结构?在答题纸的指定位置画出这种结构的图形
②该沸石属于14种布拉维点阵类型中的哪一种
③假设该沸石骨架仅含有Si和O两种元素,写出其晶胞内每种元素的原子数
④已知该沸石的晶胞参数a=2.34nm,试求该沸石的晶体密度
(2)方石英和上述假设的全硅沸石都由硅氧四面体构成,如图为方石英的晶胞示意图。

①求方石英的晶体密度
②比较沸石和方石英的晶体密度来说明沸石晶体的结构特征
(3)一般沸石由负电性骨架和骨架外阳离子构成,利用骨架外阳离子的可交换性,沸石可以作为阳离子交换剂或质子酸催化剂使用。如图为沸石的负电性骨架示意图:

请在答题纸的图中画出图中所示负电性骨架结构的电子式
(4)以甲醇为甲基化试剂的甲苯甲基化反应是石油化工中制备对二甲苯的重要方法之一,常用沸石分子筛为固体酸催化剂。该过程包含如下反应网络:

①其中有
②若反应起始时体系中只有1摩尔甲醇和1摩尔甲苯,平衡时体系内对,间、邻二甲苯的含量分别为x,y,zmol,请写出反应1的平衡常数K1的表达式
③各物种在298.15K时的标准生成焓和熵列于下表:
| 物质 |  (kJ·mol-1) (kJ·mol-1) |  (J·mol-1·K-1) (J·mol-1·K-1) |
| 甲醇(气体) 甲苯(气体) 水(气体) 对二甲苯(气体) 间二甲苯(气体) 邻二甲苯(气体) | -201.17 50.00 -241.82 17.95 17.24 19.00 | 237.70 319.74 188.72 352.42 357.69 352.75 |
根据表中的热力学数据(假设表中数据不随温度变化),计算500K下反应1的平衡常数
(5)若使用有效孔径为0.65nm的沸石分子筛为上述反应的催化剂,主要产物是

您最近一年使用:0次
解答题-原理综合题
|
较难(0.4)
解题方法
8. 氢气被认为是理想的能源。从绿色化学的角度来考虑,作为人类能够长久依赖的未来能源,它必须是储量丰富,可再生,不会破坏环境。基于这一原则,普遍认为以植物为主的生物质资源是理想选择。乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,故通过乙醇制取氢气具有良好的应用前景。
(1)已知通过乙醇制取氢气有如下两条路线:
a.水蒸气催化重整CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b.部分催化氧化CH3CH2OH(g)+ O2(g)→3H2(g)+2CO(g)
O2(g)→3H2(g)+2CO(g)
从原子利用率的角度来看,哪条路线制氢更加有利_______ ?从热力学的角度看(用下表中298.15K的数据计算),哪一条路线更有利_______ ?
(2)最近人们又提出了如下路线:
c.催化氧化重整CH3CH2OH(g)+2H2O(g)+ O2(g)→5H2(g)+2CO2(g)
O2(g)→5H2(g)+2CO2(g)
仅考虑298.15K时的情况,请说明该路线在热力学上相对于a,b两条路线有哪些优势_______ ?
(3)路线c可看作是路线b反应与水煤气变换(Water-GasShift,WGS)反应CO(g)+H2O(g)→CO2(g)+H2(g)的偶合。由于路线b在低温下反应速率慢,乙醇利用率低,为了提高原料的反应速率,实际反应一般在973.15K下进行。
①试问从热力学上看,该温度是否有利于WGS反应_______ ?
②试问应采用什么措施既能保证乙醇利用率又能充分发挥WGS反应的作用_______ ?
(4)水煤气变换反应在实际生产过程中需要在加压(如6×105Pa)条件下进行。简述理由_______ 。
(1)已知通过乙醇制取氢气有如下两条路线:
a.水蒸气催化重整CH3CH2OH(g)+H2O(g)→4H2(g)+2CO(g)
b.部分催化氧化CH3CH2OH(g)+
 O2(g)→3H2(g)+2CO(g)
O2(g)→3H2(g)+2CO(g)从原子利用率的角度来看,哪条路线制氢更加有利
 (kJ·mol-1) (kJ·mol-1) |  (J·mol-1·K-1) (J·mol-1·K-1) | |
| CH3CH2OH(g)298.15K O2(g)298.15K H2O(g)298.15K H2((g)973.15K H2(g)298.15K H2(g)973.15K CO(g)298.15K CO(g)973.15K CO2(g)298.15K CO2(g)973.15K | -234.80 0 -241.82 -216.89 01 19.79 -110.52 -89.74 -393.51 -361.55 | 281.62 205.15 188.72 231.67 130.68 165.18 197.56 233.64 213.64 267.82 |
(2)最近人们又提出了如下路线:
c.催化氧化重整CH3CH2OH(g)+2H2O(g)+
 O2(g)→5H2(g)+2CO2(g)
O2(g)→5H2(g)+2CO2(g)仅考虑298.15K时的情况,请说明该路线在热力学上相对于a,b两条路线有哪些优势
(3)路线c可看作是路线b反应与水煤气变换(Water-GasShift,WGS)反应CO(g)+H2O(g)→CO2(g)+H2(g)的偶合。由于路线b在低温下反应速率慢,乙醇利用率低,为了提高原料的反应速率,实际反应一般在973.15K下进行。
①试问从热力学上看,该温度是否有利于WGS反应
②试问应采用什么措施既能保证乙醇利用率又能充分发挥WGS反应的作用
(4)水煤气变换反应在实际生产过程中需要在加压(如6×105Pa)条件下进行。简述理由
您最近一年使用:0次
试卷分析
整体难度:较难
考查范围:认识化学科学、化学反应原理、竞赛、有机化学基础、物质结构与性质
试卷题型(共 8题)
题型
数量
解答题
6
填空题
2
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、解答题 | |||
| 1 | 0.65 | 氧化还原反应方程式的配平 与氧化剂、还原剂有关的计算 依据热化学方程式的计算 化学热力学初步 | 无机推断题 |
| 4 | 0.4 | 晶体 | 结构与性质 |
| 5 | 0.4 | 有机推断综合考查 分子结构 有机化学 | 有机推断题 |
| 6 | 0.4 | 有机化学 | 有机推断题 |
| 7 | 0.4 | 物质结构与性质综合考查 利用杂化轨道理论判断化学键杂化类型 晶胞的有关计算 | 结构与性质 |
| 8 | 0.4 | 化学动力学初步 化学平衡 | 原理综合题 |
| 二、填空题 | |||
| 2 | 0.65 | 分子结构 | |
| 3 | 0.65 | 氧化还原反应方程式的配平 基于氧化还原反应守恒规律的计算 酸碱中和滴定实质、原理 酸碱中和滴定实验基本操作及步骤 | |



