2016届浙江省台州中学高三上学期期中测试理综化学试卷
浙江
高三
期中
2017-07-27
603次
整体难度:
适中
考查范围:
化学与STSE、化学反应原理、物质结构与性质、有机化学基础、认识化学科学、化学实验基础
2016届浙江省台州中学高三上学期期中测试理综化学试卷
浙江
高三
期中
2017-07-27
603次
整体难度:
适中
考查范围:
化学与STSE、化学反应原理、物质结构与性质、有机化学基础、认识化学科学、化学实验基础
一、单选题 添加题型下试题
单选题
|
容易(0.94)
1. 下列说法不正确的是
| A.“煤改气”、“煤改电”等清洁燃料改造工程有利于减少雾霾天气 |
| B.汽车尾气催化转化装置可将尾气中的NO和CO等有害气体转化为N2和CO2,该装置中的催化剂可降低NO和CO反应的活化能,有利于提高该反应的平衡转化率 |
| C.2014年诺贝尔化学奖授予美国科学家埃里克·贝齐格、威廉·莫纳和德国科学家斯特凡·黑尔,以表彰他们为发展超分辨率荧光显微镜所作的贡献,利用此类显微镜可以观察病毒以及活细胞内蛋白质等大分子 |
| D.“地沟油”经过加工处理后,可以用来制肥皂和生物柴油,实现厨余废物合理利用 |
【知识点】 化学与STSE
您最近一年使用:0次
单选题
|
适中(0.64)
2. 下列说法正确的是


A.氯化钴溶液中存在平衡,[Co(H2O)6]2+(粉红色)+4Cl- [CoCl4]2-(蓝色)+6H2O△H =akJ·mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 [CoCl4]2-(蓝色)+6H2O△H =akJ·mol-1,将氯化钴溶液置于冰水浴中,溶液变成粉红色,则可知:a<0 |
| B.用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏小 |
| C.为了减小中和滴定的误差,锥形瓶必须洗净并烘干后才能使用 |
| D.右图表示Zn-Cu原电池反应过程中的电流强度的变化,T时可能加入了H2O2 |
【知识点】 原电池
您最近一年使用:0次
单选题
|
适中(0.64)
3. 短周期元素X、Y、Z、R和W在元素周期表的位置如下表所示,其中W元素族序数等于周期序数的2倍。则下列说法正确的是


| A.原子半径从小到大:X<Y<R<W |
| B.Z、W元素与X均可以形成AB2型化合物 |
| C.X有多种同素异形体,而Z不存在同素异形体 |
| D.Z的氢化物的稳定性大于W的氢化物,是因为Z的氢化物分子间存在氢键 |
【知识点】 元素周期表 元素周期律
您最近一年使用:0次
单选题
|
适中(0.65)
4. 下列说法或表述中正确的是


A.烷烃 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 |
| B.由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯 |
| C.上图所示的有机物分子式为C14H12O2,能发生银镜反应 |
| D.在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH |
您最近一年使用:0次
2016-12-09更新
|
454次组卷
|
4卷引用:2015届浙江省丽水市高三第一次模拟理综化学试卷
单选题
|
适中(0.65)
名校
5. 某同学按右图所示的装置进行实验。 A、B为两种常见金属,它们的硫酸盐可溶于水。当 K 闭合时,在交换膜处 SO42-从右向左移动。下列分析正确的是
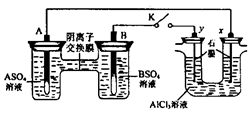

| A.溶液中A2+浓度减小 |
| B.B 的电极反应: B-2eˉ=B2+ |
| C.y 电极上有 H2产生,发生还原反应 |
| D.反应初期,x电极周围出现白色胶状沉淀,不久沉淀溶解 |
您最近一年使用:0次
2019-01-30更新
|
1165次组卷
|
14卷引用:江苏省南通市通州区2010届高三查漏补缺专项练习化学试题
(已下线)江苏省南通市通州区2010届高三查漏补缺专项练习化学试题(已下线)2010届江苏启东中学高三考前辅导训练化学试题(已下线)2011-2012学年辽宁省瓦房店市高级中学高二上学期期末考试化学试卷(已下线)2012届陕西省西安中学高三第三次月考化学试卷(已下线)2014届山东省济宁市高三上学期期末考试化学试卷2016届浙江省台州中学高三上学期期中测试理综化学试卷2015-2016学年河南省信阳高级中学高二12月月考化学卷2015-2016学年吉林省延边三中高二上12月月考化学试卷2016-2017学年河北省博野中学高二上学期第二次月考化学试卷【全国百强校】河南省信阳市高级中学2018-2019学年高二上学期10月月考化学试题2河北省临漳县第一中学2019-2020学年高二上学期期中考试化学试题2020届高三化学化学二轮复习——高考常考题型:原电池、电解池串联的分析和计算【精编选择30题】2020届高考化学二轮复习题精准训练——原电池电解池选择题专练黑龙江省佳木斯市第十二中学2022-2023学年高三上学期开学考试化学试题
单选题
|
较难(0.4)
6. 下列溶液中微粒的物质的量浓度关系不正确的是
| A.若将适量CO2通入0.1 mol·L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2c(CO32ˉ)+ c(HCO3ˉ)=" 0.1" mol·L-1 |
| B.在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
| C.常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 |
| D.等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
【知识点】 水溶液中的离子反应和平衡
您最近一年使用:0次
单选题
|
适中(0.65)
名校
7. 某试液中只可能含有下列K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol·L-1。某同学进行了如下实验:

下列说法正确的是( )

下列说法正确的是( )
| A.无法确定原试液中是否含有Al3+、Cl- |
| B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ |
| C.无法确定沉淀C的成分 |
| D.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- |
【知识点】 离子共存 离子反应在化合物组成的分析、鉴定的应用解读
您最近一年使用:0次
2019-05-31更新
|
206次组卷
|
6卷引用:2016届浙江省台州中学高三上学期期中测试理综化学试卷
二、解答题 添加题型下试题
解答题-有机推断题
|
适中(0.65)
解题方法
8. 聚合物G可用于生产全生物降解塑料,在“白色污染”日益严重的今天有着重要的作用。有关转化关系如下:

已知:
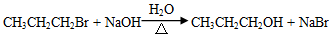
请回答下列问题:
(1)物质A的分子式为_________________ ,B的结构简式为________________ ;
(2)请写出F中含氧官能团的名称______________________ ;
(3)反应①~④中属于加成反应的是_____________________ ;
(4)写出由F生成聚合物G的化学方程式______________________ 。

已知:

请回答下列问题:
(1)物质A的分子式为
(2)请写出F中含氧官能团的名称
(3)反应①~④中属于加成反应的是
(4)写出由F生成聚合物G的化学方程式
【知识点】 常见官能团名称、组成及结构解读 缩聚反应 有机推断综合考查解读
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.64)
9. 有X、Y、Z、R四种短周期主族元素,Y、Z、R同周期。相关信息如下:
I.(1)Z元素在周期表的位置是_______ ,Y、Z、R简单离子的半径从大到小的顺序是______ (用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水可形成一种常见的漂白性物质。则甲的结构式为________________ ;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为_______________ ,写出乙溶液在空气中变质生成Y2R2的化学方程式_________________ 。
II.元素X与氢可形成多种化合物,如丙、丁、戊。
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸。8.6 g丙爆炸分解生成H2和6.72 L(标况下)X2。写出其爆炸的化学方程式________________ ;
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76 g·L-1,则物质丁的化学式为____________ ;
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式_________________ ,有人提出生成的产物中可能还有FeO,请设计实验方案验证(用化学方法)_____________________ 。
| 相关信息 | |
| X | 单质为双原子分子。若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
I.(1)Z元素在周期表的位置是
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构。甲遇水可形成一种常见的漂白性物质。则甲的结构式为
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色。则Y2R2的电子式为
II.元素X与氢可形成多种化合物,如丙、丁、戊。
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸。8.6 g丙爆炸分解生成H2和6.72 L(标况下)X2。写出其爆炸的化学方程式
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76 g·L-1,则物质丁的化学式为
(6)戊在高温条件下能还原Fe2O3,生成两种单质,写出该反应的化学方程式
【知识点】 元素周期表 元素周期律
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
10. (I)在一个容积固定不变的密闭容器中进行反应:2X(g) + Y(g)  2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H_______ 0; 熵变△S__________ 0 ( 填:“< ,> ,= ”)。该反应在___________ (填高温或低温)条件下能自发进行。
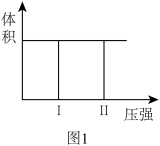
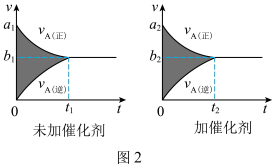
(2)该反应的v-t图象如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示。以下说法正确的是________
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
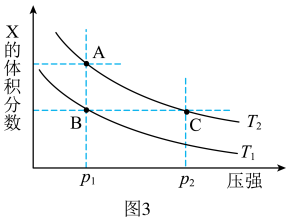
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示。下列说法正确的是_________ 。
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g) pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡_______________ 移动(填:向左, 向右 ,不)
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是_______________ mol。
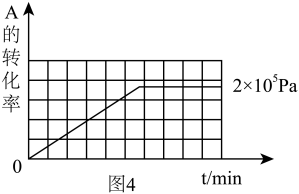
(3)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强)。__________________
 2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:
2Z(g) ,已知将2molX和1molY充入该容器中,反应在绝热条件下达到平衡时,Z的物质的量为pmol。回答下列问题:(1)若把2molX和1molY充入该容器时,处于状态I,达到平衡时处于状态II(如图1),则该反应的△H


(2)该反应的v-t图象如图2中左图所示。若其他条件不变,仅在反应前加入合适的催化剂,则其v-t图象如图2中右图所示。以下说法正确的是
①a1>a2 ②b1<b2 ③t1>t2 ④右图中阴影部分面积更大⑤两图中阴影部分面积相等
(3)若该反应在容积可变的密闭容器中发生,在温度为T1、T2时,平衡体系中X的体积分数随压强变化曲线如图3所示。下列说法正确的是
A.A、C两点的反应速率:A>C
B.A、C两点的气体密度:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法


(II)在容积可变的密闭容器中发生反应:mA(g) + nB(g)
 pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
pC(g) ,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡
(2)维持压强为2×105 Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入bmolB,当重新达到平衡时,体系中气体总物质的量是
(3)其他条件相同时,在上述三个压强下分别发生该反应。2×105 Pa时,A的转化率随时间变化如图4,请在图4中补充画出压强分别为5×105 Pa 和1×106 Pa时,A的转化率随时间的变化曲线(请在图4上画出曲线并标出相应压强)。
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
11. 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH 3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;
K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在______________ 中加热(填仪器编号)。
①烧杯 ②瓷坩埚 ③蒸发皿 ④钨坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。

①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞_________ ,打开旋塞___________ ,轻轻挤压气囊F,使CO2气体缓缓地压入K2MnO4溶液中再次反应,未反应的CO2气体又被收集在气囊G中。然后将气囊G中的气体挤压入气囊F中,如此反复,直至K2MnO4完全反应。
②通入CO2后,用玻璃棒蘸取溶液点在滤纸上,观察到_______________ 证明歧化反应已发生。
(3)将三颈烧瓶中所得产物进行过滤,将滤液倒入蒸发皿中,蒸发浓缩,自然冷却结晶,过滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是___________ 。
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用滴定管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为____________ (保留3位有效数字,已知M(KMnO4)=158g·mol-1)。若量取待测液的滴定管用蒸馏水洗净后没有用待测液润洗或烘干,则最终测定结果将____________ 。(填“偏大”、“偏小”、“不变”)
MnO2熔融氧化:3MnO2+ KClO3+ 6KOH
 3K2MnO4+ KCl+3H2O ;
3K2MnO4+ KCl+3H2O ;K2MnO4歧化:3K2MnO4+ 2CO2=2KMnO4+ MnO2↓+2K2CO3。
已知K2MnO4溶液显绿色。请回答下列问题:
(1)MnO2熔融氧化应放在
①烧杯 ②瓷坩埚 ③蒸发皿 ④钨坩埚
(2)在MnO2熔融氧化所得产物的热浸取液中通入CO2气体,使K2MnO4歧化的过程在如图装置中进行,A、B、C、D、E为旋塞,F、G为气囊,H为带套管的玻璃棒。

①为了能充分利用CO2,装置中使用了两个气囊。当试管内依次加入块状碳酸钙和盐酸后,关闭旋塞B、E,微开旋塞A, 打开旋塞C、D,往热K2MnO4溶液中通入CO2气体,未反应的CO2被收集到气囊F中。待气囊F收集到较多气体时,关闭旋塞
②通入CO2后,用玻璃棒蘸取溶液点在滤纸上,观察到
(3)将三颈烧瓶中所得产物进行过滤,将滤液倒入蒸发皿中,蒸发浓缩,自然冷却结晶,过滤,得到针状的高锰酸钾晶体。本实验应采用低温烘干的方法来干燥产品,原因是
(4)利用氧化还原滴定法进行高锰酸钾纯度分析,原理为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
现称取制得的高锰酸钾产品7.245g,配成500mL溶液,用滴定管量取25.00 mL待测液,用0.1000 mol·L-1草酸钠标准溶液液进行滴定,终点时消耗标准液体积为50.00mL(不考虑杂质的反应),则高锰酸钾产品的纯度为
【知识点】 化学实验基础
您最近一年使用:0次
试卷分析
整体难度:适中
考查范围:化学与STSE、化学反应原理、物质结构与性质、有机化学基础、认识化学科学、化学实验基础
试卷题型(共 11题)
题型
数量
单选题
7
解答题
3
填空题
1
试卷难度
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、单选题 | |||
| 1 | 0.94 | 化学与STSE | |
| 2 | 0.64 | 原电池 | |
| 3 | 0.64 | 元素周期表 元素周期律 | |
| 4 | 0.65 | 烷烃的命名 醛类性质 酯的水解反应机理 化石能源 | |
| 5 | 0.65 | 原电池原理理解 电解原理的理解及判断 原电池、电解池综合考查 | |
| 6 | 0.4 | 水溶液中的离子反应和平衡 | |
| 7 | 0.65 | 离子共存 离子反应在化合物组成的分析、鉴定的应用 | |
| 二、解答题 | |||
| 8 | 0.65 | 常见官能团名称、组成及结构 缩聚反应 有机推断综合考查 | 有机推断题 |
| 10 | 0.4 | 催化剂对化学反应速率的影响 压强对化学平衡移动的影响 化学平衡常数的有关计算 化学平衡题中基于图表数据的相关计算 | 原理综合题 |
| 11 | 0.4 | 化学实验基础 | 实验探究题 |
| 三、填空题 | |||
| 9 | 0.64 | 元素周期表 元素周期律 | |



