2020届高三化学二轮复习实验题必练-化学平衡
全国
高三
专题练习
2020-02-26
85次
整体难度:
适中
考查范围:
化学反应原理、认识化学科学、化学实验基础、常见无机物及其应用
2020届高三化学二轮复习实验题必练-化学平衡
全国
高三
专题练习
2020-02-26
85次
整体难度:
适中
考查范围:
化学反应原理、认识化学科学、化学实验基础、常见无机物及其应用
一、解答题 添加题型下试题
解答题-原理综合题
|
适中(0.65)
名校
解题方法
1. 目前有效控制及高效利用CO、 的研究正引起全球广泛关注,根据
的研究正引起全球广泛关注,根据 中国化工报
中国化工报 报道,美国科学家发现了几种新的可将CO、
报道,美国科学家发现了几种新的可将CO、 转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。
转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。
已知工业上可以利用 制备
制备 涉及反应如下:
涉及反应如下:
反应I: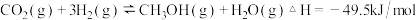
反应II:
(1)写出工业上CO和 制取甲醇的热化学方程式
制取甲醇的热化学方程式 ______ 。
(2)反应I能自发进行的条件是______ 。
(3)一定温度下, 、CO在体积固定的密闭容器中发生如下反应:
、CO在体积固定的密闭容器中发生如下反应: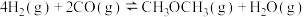 ,下列选项能判断该反应达到平衡状态的依据有
,下列选项能判断该反应达到平衡状态的依据有 ______ 。
A.该反应的平衡常数不变
 的消耗速率等于
的消耗速率等于 的生成速率
的生成速率
C.容器内的压强保持不变
 混合气体的密度保持不变
混合气体的密度保持不变
E.混合气体的平均相对分子质量不随时间而变化
(4)500K, 恒容密闭容器中充入
恒容密闭容器中充入 的
的  和
和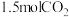 仅发生反应I,该反应10min时生成
仅发生反应I,该反应10min时生成 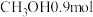 ,此时达到平衡:
,此时达到平衡:
①用氢气表示该反应的速率为______ 。
②该温度下,反应I的平衡常数为______ 。
 的研究正引起全球广泛关注,根据
的研究正引起全球广泛关注,根据 中国化工报
中国化工报 报道,美国科学家发现了几种新的可将CO、
报道,美国科学家发现了几种新的可将CO、 转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。
转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90倍。已知工业上可以利用
 制备
制备 涉及反应如下:
涉及反应如下:反应I:
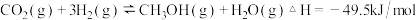
反应II:

(1)写出工业上CO和
 制取甲醇的热化学方程式
制取甲醇的热化学方程式 (2)反应I能自发进行的条件是
(3)一定温度下,
 、CO在体积固定的密闭容器中发生如下反应:
、CO在体积固定的密闭容器中发生如下反应: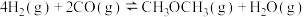 ,下列选项能判断该反应达到平衡状态的依据有
,下列选项能判断该反应达到平衡状态的依据有 A.该反应的平衡常数不变
 的消耗速率等于
的消耗速率等于 的生成速率
的生成速率C.容器内的压强保持不变
 混合气体的密度保持不变
混合气体的密度保持不变E.混合气体的平均相对分子质量不随时间而变化
(4)500K,
 恒容密闭容器中充入
恒容密闭容器中充入 的
的  和
和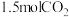 仅发生反应I,该反应10min时生成
仅发生反应I,该反应10min时生成 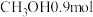 ,此时达到平衡:
,此时达到平衡:①用氢气表示该反应的速率为
②该温度下,反应I的平衡常数为
您最近一年使用:0次
2020-02-26更新
|
133次组卷
|
2卷引用:2020届高三化学二轮复习实验题必练-化学平衡
解答题-实验探究题
|
较难(0.4)
2. 某小组研究AgCl的溶解平衡:向10 mL 1mol/L KCl 溶液中加入1 mL 0.2 mol/LAgNO3溶液,将浑浊液均分为2份,进行如下实验:
已知:AgOH不稳定,立即分解为Ag2O(棕褐色或棕黑色),Ag粉为黑色,AgCl、Ag2O可溶于浓氨水生成Ag(NH3)2+
(1)滤液所属分散系为________ 。
(2)现象ii中无色气泡产生的原因是_________ (写出化学方程式)。
(3)现象iii中,导致产生气泡的速率下降的主要影响因素 是________ 。
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为____ 。
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为_____ (填化学式),棕色气体产生的原因是_____ (写离子方程式)。
② 试剂a为________ ,加入试剂a的目的是________ 。
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是________ 。
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条_________ 。
(7)综合上述实验,能说明存在AgCl(s) Ag+(aq) + Cl-(aq)的证据及理由有
Ag+(aq) + Cl-(aq)的证据及理由有________ 。
| 实验序号 | 实验操作 | 实验现象 |
| I | 将其中一份浑浊液过滤,向滤液中放入Mg条 | i. 滤液澄清透明,用激光照射有丁达尔现象。 ii. 放入Mg条后,立即有无色气泡产生,气体可燃,滤液中出现白色浑浊。 iii. 一段时间后开始出现棕褐色浑浊物,Mg条表面也逐渐变为棕褐色,产生气泡的速率变缓慢。 |
| Ⅱ | 向另一份浑浊液中放入大小相同的Mg条 | iv. 棕褐色浑浊物的量明显多于实验I,Mg条表面棕褐色更深,其他现象与ii、iii相同。 |
(1)滤液所属分散系为
(2)现象ii中无色气泡产生的原因是
(3)现象iii中,导致产生气泡的速率下降的主要
(4)甲认为Mg条表面的棕褐色物质中一定有Ag和Ag2O,其中生成Ag的离子方程式为
(5)甲设计实验检验Ag:取实验I中表面变为棕褐色的Mg条于试管中,向其中加入足量试剂a,反应结束后,继续向其中加入浓硝酸,产生棕色气体,溶液中有白色不溶物。
① 白色不溶物为
② 试剂a为
③ 该实验能证明棕褐色物质中一定有Ag的实验现象是
(6)甲进一步设计实验验证了Mg条表面的棕褐色物质中有Ag2O,实验方案是:取实验I中表面变为棕褐色的Mg条
(7)综合上述实验,能说明存在AgCl(s)
 Ag+(aq) + Cl-(aq)的证据及理由有
Ag+(aq) + Cl-(aq)的证据及理由有
您最近一年使用:0次
2019-05-10更新
|
791次组卷
|
4卷引用:【区级联考】北京市丰台区2019届高三下学期5月二模理科综合化学试题
【区级联考】北京市丰台区2019届高三下学期5月二模理科综合化学试题2020届高三化学二轮复习实验题必练-碱土金属及其化合物2020届高三化学二轮复习实验题必练-化学平衡(已下线)专题6.2 实验综合题(必考)(综合提升卷)——巅峰冲刺2020年高考化学二轮专项提升
解答题-原理综合题
|
适中(0.65)
解题方法
3. 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.
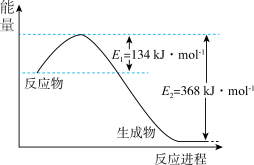
(1)如图是1mol 气体和1mol CO反应生成
气体和1mol CO反应生成 和NO过程中能量变化示意图。则反应过程中放出的总热量应为
和NO过程中能量变化示意图。则反应过程中放出的总热量应为______ 。
(2)在固定体积的密闭容器中,进行如下化学反应:
 ;
; ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表:
①写出该反应的平衡常数表达式K=______ 。
②试判断K1______ K2 (填写“ ”“
”“ ”或“
”或“ ”
” 。
。
③下列各项能说明该反应已达到平衡状态的是______  填字母
填字母 .
.
 容器内
容器内 、
、 、
、 的浓度之比为1:3:2
的浓度之比为1:3:2 
 容器内压强保持不变
容器内压强保持不变  混合气体的密度保持不变
混合气体的密度保持不变
(3)化合物N2H4做火箭发动机的燃料时,与氧化剂 反应生成
反应生成 和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与
和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与 混合溶液,其装置如图所示:
混合溶液,其装置如图所示:
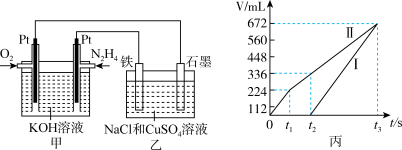
①该燃料电池的负极反应式为______ ;
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示 气体体积已换算成标准状况下的体积
气体体积已换算成标准状况下的体积 ,写出在
,写出在 时间段铁电极上的电极反应式
时间段铁电极上的电极反应式______ ;原混合溶液中NaCl的物质的量浓度为______ 。
③在 时所得溶液的pH为
时所得溶液的pH为______ (假设溶液体积不变
(1)如图是1mol
 气体和1mol CO反应生成
气体和1mol CO反应生成 和NO过程中能量变化示意图。则反应过程中放出的总热量应为
和NO过程中能量变化示意图。则反应过程中放出的总热量应为
(2)在固定体积的密闭容器中,进行如下化学反应:
 ;
; ,其平衡常数K与温度T的关系如下表:
,其平衡常数K与温度T的关系如下表: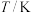 | 298 | 398 | 498 |
| 平衡常数K | 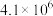 |  |  |
②试判断K1
 ”“
”“ ”或“
”或“ ”
” 。
。③下列各项能说明该反应已达到平衡状态的是
 填字母
填字母 .
. 容器内
容器内 、
、 、
、 的浓度之比为1:3:2
的浓度之比为1:3:2 
 容器内压强保持不变
容器内压强保持不变  混合气体的密度保持不变
混合气体的密度保持不变(3)化合物N2H4做火箭发动机的燃料时,与氧化剂
 反应生成
反应生成 和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与
和水蒸气。某同学设计了一个N2H4-空气碱性燃料电池,并用该电池电解200mL一定浓度NaCl与 混合溶液,其装置如图所示:
混合溶液,其装置如图所示:
①该燃料电池的负极反应式为
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示
 气体体积已换算成标准状况下的体积
气体体积已换算成标准状况下的体积 ,写出在
,写出在 时间段铁电极上的电极反应式
时间段铁电极上的电极反应式③在
 时所得溶液的pH为
时所得溶液的pH为
您最近一年使用:0次
解答题-实验探究题
|
较难(0.4)
4. 某小组同学对FeCl3与KI的反应进行探究。
【初步探究】室温下进行下表所列实验。
(1)证明实验Ⅰ中有I2生成,加入的试剂为 __________ 。
(2)写出实验Ⅰ反应的离子方程式:_________________ 。
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是_____________________ 。
【深入探究】20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:________ ,20 min内溶液不变蓝,证明该假设不成立,导致溶液不变蓝的因素 可能是_____________ (写出两条)。
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2 I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:____________ 。
(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为__________________ 。
【初步探究】室温下进行下表所列实验。
| 序号 | 操作 | 现象 |
| 实验Ⅰ | 取5 mL 0.1 mol·L-1 KI溶液,滴加0.1 mol·L-1FeCl3溶液5~6滴(混合溶液pH=5) | 溶液变为棕黄色 |
| 实验Ⅱ | 取2 mL实验Ⅰ反应后的溶液,滴加2滴0.1 mol·L-1 KSCN溶液 | 溶液呈红色 |
(2)写出实验Ⅰ反应的离子方程式:
(3)结合上述实验现象可以证明Fe3+与I-发生可逆反应,原因是
【深入探究】20 min后继续观察实验现象:实验Ⅰ溶液棕黄色变深;实验Ⅱ溶液红色变浅。
(4)已知在酸性较强的条件下,I-可被空气氧化为I2,故甲同学提出假设:该反应条件下空气将I-氧化为I2,使实验Ⅰ中溶液棕黄色变深。甲同学设计实验:
(5)乙同学查阅资料可知:FeCl3与KI的反应体系中还存在I- + I2
 I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:
I3-,I3-呈棕褐色。依据资料从平衡移动原理解释实验Ⅱ中20 min后溶液红色变浅的原因:(6)丙同学针对20 min后的实验现象继续提出假设:FeCl3与KI的反应、I-与I2的反应达到平衡需要一段时间,有可能20 min之前并未达到平衡。为验证该假设,丙同学用4支试管进行实验,得到了颜色由浅到深的四个红色溶液体系,具体实验方案为
您最近一年使用:0次
2019-03-27更新
|
637次组卷
|
3卷引用:【区级联考】北京市海淀区2019届高三下学期适应性训练化学试题
【区级联考】北京市海淀区2019届高三下学期适应性训练化学试题2020届高三化学二轮复习实验题必练-化学平衡(已下线)《2020年新高考政策解读与配套资源》模拟试题05-2020年北京新高考化学模拟试题



