对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5 NO2+NO3 ΔH1快速平衡
NO2+NO3 ΔH1快速平衡
第二步 NO2+NO3→NO+NO2+O2 ΔH2慢反应
第三步 NO+NO3→2NO2 ΔH3快反应
下列说法正确的是( )
第一步 N2O5
 NO2+NO3 ΔH1快速平衡
NO2+NO3 ΔH1快速平衡第二步 NO2+NO3→NO+NO2+O2 ΔH2慢反应
第三步 NO+NO3→2NO2 ΔH3快反应
下列说法正确的是( )
| A.使用催化剂可以改变第一步中NO2平衡产量 |
| B.第二步NO2和NO3的碰撞都是有效的 |
| C.反应2N2O5(g)→4NO2(g)+O2(g)的ΔH=2ΔH1+ΔH2+ΔH3 |
| D.第二步反应的活化能小于第三步反应的活化能 |
19-20高三·山东日照·阶段练习 查看更多[2]
更新时间:2020/04/12 11:38:05
|
相似题推荐
单选题
|
适中
(0.65)
解题方法
【推荐1】已知: 、
、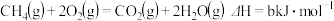 ,则下列叙述正确的是
,则下列叙述正确的是
 、
、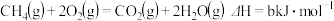 ,则下列叙述正确的是
,则下列叙述正确的是A. 键的键长小于 键的键长小于 键 键 |
B.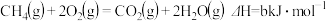 表示甲烷燃烧热的热化学方程式 表示甲烷燃烧热的热化学方程式 |
C.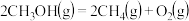 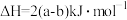 |
D.当 和 和 的物质的量之比为 的物质的量之比为 时,其混合物完全燃烧生成 时,其混合物完全燃烧生成 和 和 时放出的热量为 时放出的热量为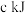 ,则该混合物中 ,则该混合物中 的物质的量为 的物质的量为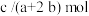 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】已知, 时
时 溶液中存在以下平衡:
溶液中存在以下平衡:
①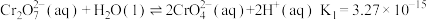
②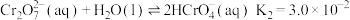
③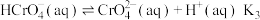
 时,
时,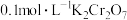 溶液中,
溶液中,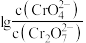 随
随 的变化关系如图所示
的变化关系如图所示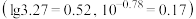 。下列说法
。下列说法错误 的是
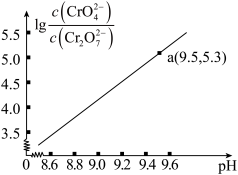
 时
时 溶液中存在以下平衡:
溶液中存在以下平衡:①
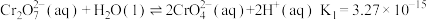
②
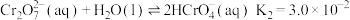
③
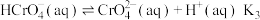
 时,
时,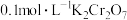 溶液中,
溶液中,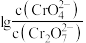 随
随 的变化关系如图所示
的变化关系如图所示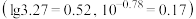 。下列说法
。下列说法
A.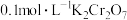 溶液中,加入少量的 溶液中,加入少量的 气体, 气体,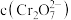 增大 增大 |
| B.溶液颜色不再变化,可以判断该体系达到平衡状态 |
C.a点溶液中离子浓度关系: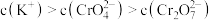 |
D.反应③的化学平衡常数 |
您最近一年使用:0次
【推荐3】用活性炭还原氮氧化物可防止空气污染。向1L密闭容器加入一定量的活性炭和NO,某温度下发生反应:
已知:①C(s)+2NO(g) N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH
②C(s)+O2(g) CO2 (g) ΔH1= -393.5 kJ/mol
CO2 (g) ΔH1= -393.5 kJ/mol
③N2(g)+O2(g) 2NO(g) ΔH2= +180.5 kJ/mol
2NO(g) ΔH2= +180.5 kJ/mol
下列说法错误的是
已知:①C(s)+2NO(g)
 N2(g)+CO2 (g) ΔH
N2(g)+CO2 (g) ΔH②C(s)+O2(g)
 CO2 (g) ΔH1= -393.5 kJ/mol
CO2 (g) ΔH1= -393.5 kJ/mol③N2(g)+O2(g)
 2NO(g) ΔH2= +180.5 kJ/mol
2NO(g) ΔH2= +180.5 kJ/mol下列说法错误的是
| A.ΔH= -574.0 kJ/mol |
| B.当容器内气体密度不变时,反应①达到平衡状态 |
| C.反应③正反应的活化能大于180.5 kJ/mol |
| D.反应①达到平衡后,增大压强平衡向正反应方向移动 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法不正确的是( )
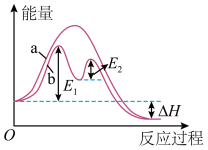

| A.改变催化剂,可改变该反应的活化能 |
| B.有催化剂条件下,反应的活化能等于E1+E2 |
| C.反应过程b 有催化剂参与,有两个过渡态 |
| D.该反应反应物总键能比生成物总键能小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】如图是苯与卤素发生取代反应进程中的势能变化图,下列说法正确的是


A.该反应的总活化能为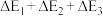 |
| B.该反应的决速步骤为第Ⅲ步 |
| C.第III步转化中失去了一个质子 |
D. 是常用碘化剂,根据电性和反应进程判断, 是常用碘化剂,根据电性和反应进程判断, 比 比 更易发生碘化反应 更易发生碘化反应 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
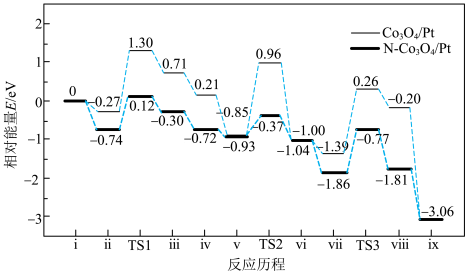
【推荐1】我国科学家利用两种不同的纳米催化剂(Co3O4/Pt,N-Co3O4/Pt)在室温水汽条件下实现高效CO催化氧化(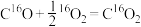 ),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
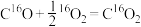 ),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
),其反应历程中相对能量的变化如下图所示(TS1、TS2、TS3分别代表过渡态1、过渡态2、过渡态3)。下列说法错误的是
| A.效果较好的催化剂是N-Co3O4/Pt |
B.若利用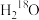 进行同位素标记实验,检测到以上反应中有 进行同位素标记实验,检测到以上反应中有 和 和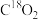 生成,说明O-H键断裂 生成,说明O-H键断裂 |
C.反应: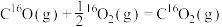 的 的 |
| D.若ⅱ表示H2O被吸附在催化剂表面,则Co3O4/Pt更容易吸附H2O |
您最近一年使用:0次
单选题
|
适中
(0.65)
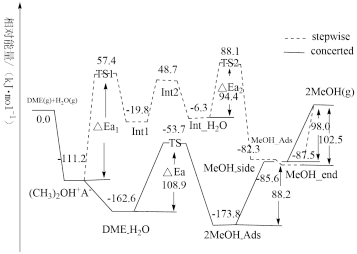
【推荐2】科学家研究二甲醚(DME)在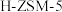 分子筛(用
分子筛(用 表示)上的水解反应,其反应进程中能量变化如图所示。下列说法错误的是
表示)上的水解反应,其反应进程中能量变化如图所示。下列说法错误的是
 分子筛(用
分子筛(用 表示)上的水解反应,其反应进程中能量变化如图所示。下列说法错误的是
表示)上的水解反应,其反应进程中能量变化如图所示。下列说法错误的是
| A.根据反应图示可知,在相同的催化剂作用下,化学反应也存在多种反应途径 |
| B.升高温度,stepwise路径和concerted路径的反应速率都加快,有利于提高反应物的转化率 |
C.由于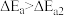 ,DME水解反应更易以stepwise路径进行 ,DME水解反应更易以stepwise路径进行 |
D.根据图示可知,DME首先与分子筛 结合形成 结合形成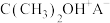 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐1】下列说法不正确的是
| A.对于有气体参加的反应增大压强能提高活化分子的浓度 |
| B.升高温度增大了活化分子百分数 |
| C.催化剂能够改变化学反应途径 |
| D.具有较高能量的反应物分子一定能发生有效碰撞 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法不正确的是
| A.铅蓄电池在放电过程中,负极、正极质量都增加 |
B.常温下,反应 不能自发进行,则该反应的 不能自发进行,则该反应的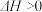 |
| C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
D.相同条件下,溶液中 、 、 、 、 的氧化性依次减弱 的氧化性依次减弱 |
您最近一年使用:0次

 与CO合成
与CO合成 的反应机理如下:
的反应机理如下: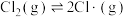
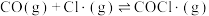

 ;
;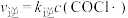 。下列说法正确的是
。下列说法正确的是
 浓度能增加活化分子百分数,加快反应速率
浓度能增加活化分子百分数,加快反应速率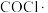 是该反应的催化剂
是该反应的催化剂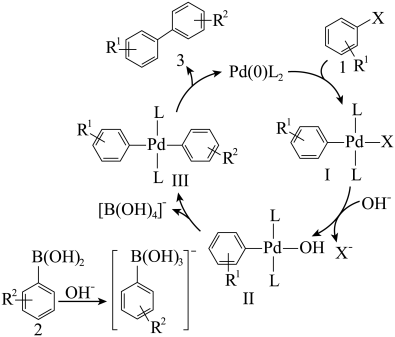
 →
→ +2 X-
+2 X-
 白色沉淀
白色沉淀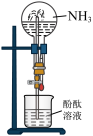
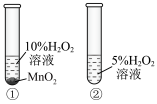
 易溶于水且溶液呈碱性
易溶于水且溶液呈碱性

