博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
铁器在具有O2、_______ 等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.Fe转化为Fe2+。
Ⅱ.Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为______ 。
Ⅲ..FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是_______ 。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
_______ Fe3O4+_____ O2+______ H2O=__________ FeO(OH)(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
①检测洗涤液中Cl-的方法是_______ 。
②脱氯反应:FeOCl+OH- =FeO(OH)+Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:S(FeOCl)_______ S[FeO(OH)]。(填“>”、“<”、“=”)
③Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是___________________________ 。
(1)检测锈蚀产物
| 主要成分的化学式 | |||
| Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
铁器在具有O2、
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.Fe转化为Fe2+。
Ⅱ.Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为
Ⅲ..FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
①检测洗涤液中Cl-的方法是
②脱氯反应:FeOCl+OH- =FeO(OH)+Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:S(FeOCl)
③Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是
19-20高一·全国·期末 查看更多[1]
(已下线)【南昌新东方】南昌二中 2019-2020 高一(上)期末
更新时间:2020/04/18 10:14:50
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】实验室可用如图装置制备无水FeCl3。已知FeCl3易升华,易吸收水分而潮解。请回答下列问题:

(1)连接好仪器后首先应进行的操作是___________ 。
(2)A装置中发生反应的离子方程式为___________ ,当加入一定量的浓盐酸与足量MnO2反应,实际生成的Cl2体积小于理论值的原因是___________ 。
(3)装置B的作用是___________ , D中发生反应的化学方程式为___________ 。
(4)D中盛放铁粉的硬质玻璃管与E中收集器之间选用较粗导管的原因是___________ 。
(5)F中所装试剂为___________ ,目的是___________ 。

(1)连接好仪器后首先应进行的操作是
(2)A装置中发生反应的离子方程式为
(3)装置B的作用是
(4)D中盛放铁粉的硬质玻璃管与E中收集器之间选用较粗导管的原因是
(5)F中所装试剂为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】利用分类法研究化学物质可系统、全面认识物质的性质。下列三组物质中,均有一种物质的类别与其他三种不同。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):①________ ;②________ ;③________ 。
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应________ (填“是”或“不是”)氧化还原反应。
(3)写出Na2CO3与足量稀硫酸反应的离子方程式:________________ 。
(2)HCO3-与H+、OH-在溶液都不能大量共存,试用离子方程式说明:_________ 、_________ 。
①MgO、Na2O、CO2、CuO
②HCl、H2O、H2SO4、HNO3
③NaOH、Na2CO3、KOH、Cu(OH)2
(1)三种物质依次是(填化学式):①
(2)这三种物质相互作用可生成一种新物质NaHCO3,该反应
(3)写出Na2CO3与足量稀硫酸反应的离子方程式:
(2)HCO3-与H+、OH-在溶液都不能大量共存,试用离子方程式说明:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】请用化学用语(化学方程式或离子方程式或电子式等)解释以下事实:
(1)NaCl固体溶于水可导电_______ 。
(2)工业酸性废水中含有的重铬酸根离子(Cr2O )有毒,可用硫酸亚铁转化成无毒的Cr3+处理达标后安全排放(离子方程式)
)有毒,可用硫酸亚铁转化成无毒的Cr3+处理达标后安全排放(离子方程式)________ 。
(3)钠与水剧烈反应(离子方程式)________ 。
(4)过氧化钠可做潜水艇氧气来源_______ 。
(5)实验室常用舎勒的方法制备氯气________ 。
(6)氯气溶于水能杀菌消毒(离子方程式)________ 。
(7)工业上将Cl2转化成更易保存的漂白粉________ 。
(8)炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理_______ 。
(9)工业上用FeCl3溶液刻蚀覆铜板(离子方程式)________ 。
(10)由Na和Cl形成离子键的过程:________ 。
(1)NaCl固体溶于水可导电
(2)工业酸性废水中含有的重铬酸根离子(Cr2O
 )有毒,可用硫酸亚铁转化成无毒的Cr3+处理达标后安全排放(离子方程式)
)有毒,可用硫酸亚铁转化成无毒的Cr3+处理达标后安全排放(离子方程式)(3)钠与水剧烈反应(离子方程式)
(4)过氧化钠可做潜水艇氧气来源
(5)实验室常用舎勒的方法制备氯气
(6)氯气溶于水能杀菌消毒(离子方程式)
(7)工业上将Cl2转化成更易保存的漂白粉
(8)炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理
(9)工业上用FeCl3溶液刻蚀覆铜板(离子方程式)
(10)由Na和Cl形成离子键的过程:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】近年来,我国秋冬季雾霾天气呈现常态化趋势,造成严重空气污染,对人类身心健康造成极大威胁。硫酸盐气溶胶作为PM2.5的主要构成成分,是雾霾产生的一个重要元凶。科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制。如图所示:
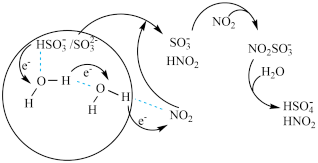
(1)NO2和SO2作为大气初期污染物的主要成分,主要来自_____ 。
(2)电子传递可以促进HSO 中O—H键的解离,进而形成中间体SO
中O—H键的解离,进而形成中间体SO ,反应的离子方程式为
,反应的离子方程式为_____ 。
(3)通过“水分子桥”,处于纳米液滴中的SO 或HSO
或HSO 可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠
可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____ 形成。写出HSO 与NO2间发生的总反应的离子方程式:
与NO2间发生的总反应的离子方程式:_____ 。
(4)亚硝酸(HNO2)是一种弱酸,酸性比醋酸稍强,极不稳定,只能存在于稀的水溶液中,加热时发生歧化反应,生成一种强酸和一种遇空气变为红棕色的气体,写出该反应的化学方程式:_____ 。
(5)结合题中信息,请写出一种鉴别NaNO2和NaCl的方法:_____ 。

(1)NO2和SO2作为大气初期污染物的主要成分,主要来自
(2)电子传递可以促进HSO
 中O—H键的解离,进而形成中间体SO
中O—H键的解离,进而形成中间体SO ,反应的离子方程式为
,反应的离子方程式为(3)通过“水分子桥”,处于纳米液滴中的SO
 或HSO
或HSO 可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠
可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠 与NO2间发生的总反应的离子方程式:
与NO2间发生的总反应的离子方程式:(4)亚硝酸(HNO2)是一种弱酸,酸性比醋酸稍强,极不稳定,只能存在于稀的水溶液中,加热时发生歧化反应,生成一种强酸和一种遇空气变为红棕色的气体,写出该反应的化学方程式:
(5)结合题中信息,请写出一种鉴别NaNO2和NaCl的方法:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】工业烟道气中含有的二氧化硫和氮氧化物是大气主要污染物,脱硫脱氮是环境治理的热点问题。回答下列问题:
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,__________ (在“□”里填入系数,在“__”上填入微粒符号),加入CaCO3可以提高SO2去除率,原因是________ 。
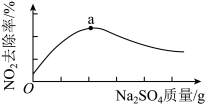
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是________ 。
(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为________ 。
②滴定过程中主要使用的玻璃仪器有________ 和锥形瓶等。
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为________ mg·m−3。
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是

(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为
②滴定过程中主要使用的玻璃仪器有
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】亚氯酸(HClO2)是一种中强酸,易分解,亚氯酸及其盐类在工业生产和环境治理等方面用途非常广泛。回答下列问题:
(1)HClO2中氯元素的化合价为_______ ;亚氯酸不稳定,易分解为Cl2、ClO2和H2O,分解后的氧化产物与还原产物的物质的量之比为__________________ 。
(2)已知常温下Ka(HClO2)=1.1×10-2,则反应HClO2+OH- ClO2-+H2O在常温下的平衡常数K=
ClO2-+H2O在常温下的平衡常数K=_________________ 。
(3)亚氯酸盐可用于脱除氮氧化物和硫氧化物,当其他条件不变时,测得脱除率与吸收液pH的关系如图所示。已知:C12和ClO2溶于水后更易与SO2和NO反应。
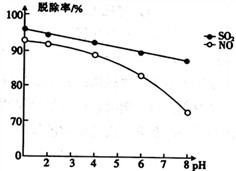
①亚氯酸盐脱除SO2的离子方程式为________________________ 。
②pH越小,脱除率越大,其原因是____________________________________________ 。
(1)HClO2中氯元素的化合价为
(2)已知常温下Ka(HClO2)=1.1×10-2,则反应HClO2+OH-
 ClO2-+H2O在常温下的平衡常数K=
ClO2-+H2O在常温下的平衡常数K=(3)亚氯酸盐可用于脱除氮氧化物和硫氧化物,当其他条件不变时,测得脱除率与吸收液pH的关系如图所示。已知:C12和ClO2溶于水后更易与SO2和NO反应。

①亚氯酸盐脱除SO2的离子方程式为
②pH越小,脱除率越大,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】阅读下面两条科普信息,回答有关问题:
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有______ 性,铁离子具有_______ 性,第二则则信息中CO2是_________ 剂。
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__ Fe(NO3)3 +__ NaOH+ __ Cl2 → __ Na2FeO4+ __ NaNO3 + __ NaCl + __ H2O
①配平上述反应,并分析_______ 元素被氧化,当生成3mol还原产物时,转移电子的总数为______ ;
②铁酸钠除了能消毒外,还可以用于净水,原因是_____________________ 。
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
①配平上述反应,并分析
②铁酸钠除了能消毒外,还可以用于净水,原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】把金属铁加入含FeCl3、FeCl2、CuCl2的混合液中充分反应后,
(1)铁全部溶解,且没有固体,则滤液中肯定有的阳离子__________ ,可能有的阳离子____________
(2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子___________ ,肯定不存在的阳离子___________ ,可能有的阳离子___________
(3)过滤,滤出不溶物有铁,则滤液中肯定有的阳离子____________ ,肯定不存在的阳离子___________ 。
(1)铁全部溶解,且没有固体,则滤液中肯定有的阳离子
(2)过滤,滤出不溶物有铜,则滤液中肯定有的阳离子
(3)过滤,滤出不溶物有铁,则滤液中肯定有的阳离子
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】铁在人体中以Fe2+和Fe3+的形式存在。二价铁离子易被吸收,给贫血者补充铁时,应给予含二价铁离子的铁盐,如硫酸亚铁(FeSO4)。
(1)人体中经常进行转化 Fe2+ Fe3+,A反应中Fe2+作
Fe3+,A反应中Fe2+作_______ 剂,B反应中Fe3+作_______ 剂。
(2)新配制的FeCl2溶液应加入_______ 以防止FeCl2转化为FeCl3,要除去FeCl3溶液中少量的FeCl2杂质,可向其中通入适量的_______ 。
(3)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。反应的离子方程式为_______ 。
(4)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为2Fe2++Cl2=2Fe3++2Cl- 和_______ ;处理过程中需定期添加的原料是_______ 。
(5)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证: 取少许未知试液于试管中
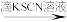 溶液呈红色(证明含有FeCl2),你认为此方案
溶液呈红色(证明含有FeCl2),你认为此方案_______ (填“合理”或“不合理”),若不合理,如何改进:_______ 。
(1)人体中经常进行转化 Fe2+
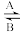 Fe3+,A反应中Fe2+作
Fe3+,A反应中Fe2+作(2)新配制的FeCl2溶液应加入
(3)在制作印刷电路板的过程中常利用铜与氯化铁溶液的反应。反应的离子方程式为
(4)为消除废气中的Cl2对环境的污染,将废气通过含有铁粉的FeCl2溶液,即可有效地除去Cl2,这一处理过程可用两个离子方程式表示为2Fe2++Cl2=2Fe3++2Cl- 和
(5)某同学为检验某未知溶液中是否为FeCl2溶液,采取如下实验方案加以验证: 取少许未知试液于试管中
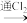
 溶液呈红色(证明含有FeCl2),你认为此方案
溶液呈红色(证明含有FeCl2),你认为此方案
您最近一年使用:0次
【推荐1】某研究小组对铁钉生锈进行研究
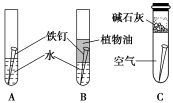
(1)经过较长时间后,甲同学观察到的现象是:上述图中的铁钉最容易生锈的是____ (填序号)。
(2)在铁钉的锈蚀过程中,Fe发生了____ (填“氧化”或“还原”反应)。
(3)铁生锈的外部条件是____ 。
(4)若为了防止铁钉生锈,该同学想在铁钉表面镀上一层金属,该金属最好是____ 。
A.锡 B.铜 C.锌
(5)水是一种宝贵的自然资源。下列做法会造成水污染的是_____ (填序号)。
①生活污水任意排放②海上油轮原油泄漏③水力发电④农药化肥不合理施用
向含Hg2+的废水中加入Na2S以除去Hg2+,该反应的离子方程式为_____ 。

(1)经过较长时间后,甲同学观察到的现象是:上述图中的铁钉最容易生锈的是
(2)在铁钉的锈蚀过程中,Fe发生了
(3)铁生锈的外部条件是
(4)若为了防止铁钉生锈,该同学想在铁钉表面镀上一层金属,该金属最好是
A.锡 B.铜 C.锌
(5)水是一种宝贵的自然资源。下列做法会造成水污染的是
①生活污水任意排放②海上油轮原油泄漏③水力发电④农药化肥不合理施用
向含Hg2+的废水中加入Na2S以除去Hg2+,该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】钢铁的电化学腐蚀原理___________ ;
(2)实验现象:a装置右边的小试管中液面________ ;b装置中右边小试管中液面_________ 。
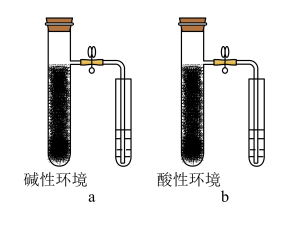
(2)实验现象:a装置右边的小试管中液面
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.铝合金和钢铁是国家重要的金属材料。回答下列问题:
(1)下列是气态铝原子或离子的电子排布式,其中处于激发态的有___________ (填序号)。A变为D所需的能量为E1,D变为E所需的能量为E2,则E1___________ E2(填“>”“<”或“=”),理由是___________ 。
A.1s22s22p63s23p1 B.1s22s22p63s13px13py1 C.1s22s22p63s13px13pz1
D.1s22s22p63s2 E.1s22s22p63s1 F.1s22s22p63s13p1
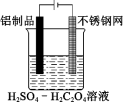
(2)利用电解法可在铝制品表面形成致密的氧化物保护膜,不仅可以增加美观,而且可以延长铝制品使用时间。制取氧化物保护膜的装置如下图所示,阳极的电极反应方程式为___________ 。
Ⅱ.钢铁在潮湿空气中容易生锈,某兴趣小组查阅资料可知,钢铁腐蚀的快慢与温度、电解质溶液的pH值、氧气浓度以及钢铁中的含碳量有关,为此设计了下列实验。

通过上述实验分析回答:
(3)上述实验①、②探究___________ 对铁的腐蚀快慢的影响,写出实验②碳电极上的电极反应式___________ ;
(4)上述四个实验中___________ (用编号表示)发生吸氧腐蚀,上述四个实验铁腐蚀由快到慢的顺序为___________ (用编号表示)。
(1)下列是气态铝原子或离子的电子排布式,其中处于激发态的有
A.1s22s22p63s23p1 B.1s22s22p63s13px13py1 C.1s22s22p63s13px13pz1
D.1s22s22p63s2 E.1s22s22p63s1 F.1s22s22p63s13p1
(2)利用电解法可在铝制品表面形成致密的氧化物保护膜,不仅可以增加美观,而且可以延长铝制品使用时间。制取氧化物保护膜的装置如下图所示,阳极的电极反应方程式为

Ⅱ.钢铁在潮湿空气中容易生锈,某兴趣小组查阅资料可知,钢铁腐蚀的快慢与温度、电解质溶液的pH值、氧气浓度以及钢铁中的含碳量有关,为此设计了下列实验。

| 编号 | ① | ② | ③ | ④ |
| A | 100 mL饱和NaCl溶液 | 100 mL饱和NaCl溶液 | 100 mLpH = 2 CH3COOH | 100 mLpH = 5 H2SO4 |
| B | m g铁粉 | m g铁粉和n g碳粉混合物 | m g铁粉和n g碳粉混合物 | m g铁粉和n g碳粉混合物 |
| 锥形瓶中压强随时间变化 | 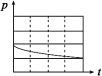 | 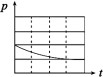 | 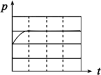 |  |
通过上述实验分析回答:
(3)上述实验①、②探究
(4)上述四个实验中
您最近一年使用:0次



