Ⅰ.铝合金和钢铁是国家重要的金属材料。回答下列问题:
(1)下列是气态铝原子或离子的电子排布式,其中处于激发态的有___________ (填序号)。A变为D所需的能量为E1,D变为E所需的能量为E2,则E1___________ E2(填“>”“<”或“=”),理由是___________ 。
A.1s22s22p63s23p1 B.1s22s22p63s13px13py1 C.1s22s22p63s13px13pz1
D.1s22s22p63s2 E.1s22s22p63s1 F.1s22s22p63s13p1
(2)利用电解法可在铝制品表面形成致密的氧化物保护膜,不仅可以增加美观,而且可以延长铝制品使用时间。制取氧化物保护膜的装置如下图所示,阳极的电极反应方程式为___________ 。
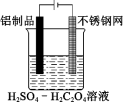
Ⅱ.钢铁在潮湿空气中容易生锈,某兴趣小组查阅资料可知,钢铁腐蚀的快慢与温度、电解质溶液的pH值、氧气浓度以及钢铁中的含碳量有关,为此设计了下列实验。

通过上述实验分析回答:
(3)上述实验①、②探究___________ 对铁的腐蚀快慢的影响,写出实验②碳电极上的电极反应式___________ ;
(4)上述四个实验中___________ (用编号表示)发生吸氧腐蚀,上述四个实验铁腐蚀由快到慢的顺序为___________ (用编号表示)。
(1)下列是气态铝原子或离子的电子排布式,其中处于激发态的有
A.1s22s22p63s23p1 B.1s22s22p63s13px13py1 C.1s22s22p63s13px13pz1
D.1s22s22p63s2 E.1s22s22p63s1 F.1s22s22p63s13p1
(2)利用电解法可在铝制品表面形成致密的氧化物保护膜,不仅可以增加美观,而且可以延长铝制品使用时间。制取氧化物保护膜的装置如下图所示,阳极的电极反应方程式为

Ⅱ.钢铁在潮湿空气中容易生锈,某兴趣小组查阅资料可知,钢铁腐蚀的快慢与温度、电解质溶液的pH值、氧气浓度以及钢铁中的含碳量有关,为此设计了下列实验。

| 编号 | ① | ② | ③ | ④ |
| A | 100 mL饱和NaCl溶液 | 100 mL饱和NaCl溶液 | 100 mLpH = 2 CH3COOH | 100 mLpH = 5 H2SO4 |
| B | m g铁粉 | m g铁粉和n g碳粉混合物 | m g铁粉和n g碳粉混合物 | m g铁粉和n g碳粉混合物 |
| 锥形瓶中压强随时间变化 | 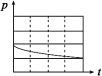 | 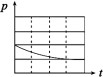 | 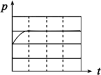 |  |
通过上述实验分析回答:
(3)上述实验①、②探究
(4)上述四个实验中
更新时间:2023-05-30 12:20:18
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_______ 。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+ 氧化成Co3+,然后以Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:
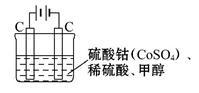
①写出阳极电极反应式_______ 。
②写出Co3+除去甲醇的离子方程式_______ 。
Ⅰ:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.0kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g)ΔH=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+ 氧化成Co3+,然后以Co3+ 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:

①写出阳极电极反应式
②写出Co3+除去甲醇的离子方程式
您最近一年使用:0次
【推荐2】合成氨技术的发明使工业化人工固氮成为现实。请回答下列问题:
(1)合成氨的反应为:2NH3(g) N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。
①该反应的反应热ΔH=_______ 。
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?_______ (填标号)
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=_______ 。
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=_______ (用平衡分压代替浓度计算,分压=总压×物质的量分数)。
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。
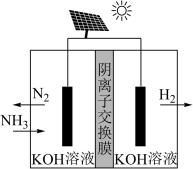
①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为_______ ;
②阳极的电极反应式为_______ 。
(1)合成氨的反应为:2NH3(g)
 N2(g)+3H2(g),有关化学键的键能如表所示。
N2(g)+3H2(g),有关化学键的键能如表所示。| 化学键 |  |  |  |
| 键能E/ kJ·mol−1 | 946 | 436.0 | 390.8 |
②已知该反应的ΔS=198.9 J·mol−1·K−1,在下列哪些温度下反应能自发进行?
A.25℃ B.125℃ C.225℃ D.325℃
(2)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为3.0 mol。
①达平衡时,H2的转化率α=
②已知平衡时,容器压强为8 MPa,则平衡常数Kp=
(3)利用电解原理,将氨转化为高纯氢气,其装置如图所示。

①阴极产生标准状况下112mL气体时,通过阴离子交换膜的离子的物质的量为
②阳极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】绿色甲醇 是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、
是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、 的捕集、
的捕集、 和
和 一步法制甲醇。
一步法制甲醇。
(1)磁场辅助光电分解水制氢的工作原理如下[磁场辅助光照电极材料促使单位时间内产生更多的“电子”和“空穴”( ,具有强氧化性),驱动并加快电极反应]。
,具有强氧化性),驱动并加快电极反应]。
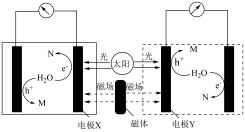
①电极X为______ (填“阴”或“阳”)极。
②理论上生成的气体M与N的质量之比为______ 。
③在酸性介质中生成M的电极反应式为______ 。
(2)工业上从高炉气中捕集 的示意图如图所示。
的示意图如图所示。
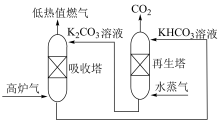
①高炉气从“吸收塔”底部通入, 溶液从塔顶喷洒,这样做的优点是
溶液从塔顶喷洒,这样做的优点是____________ 。
②若从“吸收塔”出来的盐溶液中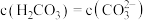 ,则该溶液的pH为
,则该溶液的pH为______
[该条件下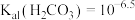 、
、 ,不考虑其他因素对pH的影响]。
,不考虑其他因素对pH的影响]。
③为研究温度对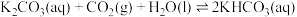 的影响,将一定量的
的影响,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得
气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得 气体的浓度如图所示:
气体的浓度如图所示:
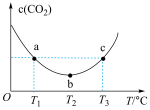
化学平衡常数
______ 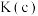 (填“>”“<”或“=”);
(填“>”“<”或“=”); 温度范围内,容器内
温度范围内,容器内 气体浓度呈减小的趋势,其原因是
气体浓度呈减小的趋势,其原因是______ 。
 是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、
是2023年杭州亚运会主火炬燃料,制备绿色甲醇分为三个阶段:利用可再生能源制绿氢、 的捕集、
的捕集、 和
和 一步法制甲醇。
一步法制甲醇。(1)磁场辅助光电分解水制氢的工作原理如下[磁场辅助光照电极材料促使单位时间内产生更多的“电子”和“空穴”(
 ,具有强氧化性),驱动并加快电极反应]。
,具有强氧化性),驱动并加快电极反应]。
①电极X为
②理论上生成的气体M与N的质量之比为
③在酸性介质中生成M的电极反应式为
(2)工业上从高炉气中捕集
 的示意图如图所示。
的示意图如图所示。
①高炉气从“吸收塔”底部通入,
 溶液从塔顶喷洒,这样做的优点是
溶液从塔顶喷洒,这样做的优点是②若从“吸收塔”出来的盐溶液中
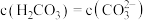 ,则该溶液的pH为
,则该溶液的pH为[该条件下
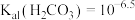 、
、 ,不考虑其他因素对pH的影响]。
,不考虑其他因素对pH的影响]。③为研究温度对
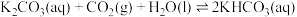 的影响,将一定量的
的影响,将一定量的 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的 气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得
气体,保持其他初始实验条件不变,分别在不同温度下,经过相同时间测得 气体的浓度如图所示:
气体的浓度如图所示:
化学平衡常数

 (填“>”“<”或“=”);
(填“>”“<”或“=”); 温度范围内,容器内
温度范围内,容器内 气体浓度呈减小的趋势,其原因是
气体浓度呈减小的趋势,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】吸氧腐蚀的实质是铁在_____________ 的存在下被__________ 氧化,这一腐蚀过程因吸收了__________ 而被称为吸氧腐蚀。发生吸氧腐蚀的正极反应是_______________ ,负极反应是____________________ 。
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛。
(1)下图是常见电化学装置图
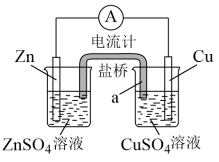
①负极材料为Zn,其在此装置中的作用是___________ 。
②若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应___________ 。
(2)下图是氯碱工业电解饱和NaCl溶液的示意图
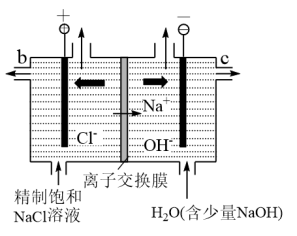
①电解饱和NaCl溶液的离子方程式是___________ 。
②NaOH溶液从___________ (填b或c)口导出。结合化学用语解释NaOH在此区域生成的原因___________ 。
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用___________ 。
(3)下图探究金属Fe是否腐蚀的示意图
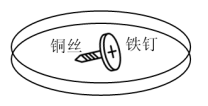
在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为___________ 端(填“左”或“右”),结合化学用语解释变红的原因___________ 。
(1)下图是常见电化学装置图

①负极材料为Zn,其在此装置中的作用是
②若用一根铜丝代替盐桥插入两烧杯中,电流计指针也发生偏转,推测:其中一个为原电池,一个为电解池,写出a端发生的电极反应
(2)下图是氯碱工业电解饱和NaCl溶液的示意图

①电解饱和NaCl溶液的离子方程式是
②NaOH溶液从
③电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
(3)下图探究金属Fe是否腐蚀的示意图

在培养皿中加入一定量的琼脂和饱和NaCl溶液混合,滴入5~6滴酚酞溶液,混合均匀,将缠有铜丝的铁钉放入培养皿中。溶液变红的部位为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,欲对其进行修复和防护具有重要意义。图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。
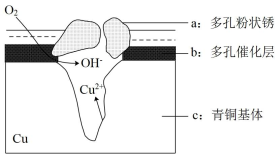
①腐蚀过程中,负极是_____ (填图中字母“a”或“b”或“c”)
②环境中的Clˉ̄扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_____ ;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为_____ L(标准状况)。

①腐蚀过程中,负极是
②环境中的Clˉ̄扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为
您最近一年使用:0次
【推荐1】某研究小组对铁钉生锈进行研究
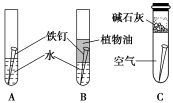
(1)经过较长时间后,甲同学观察到的现象是:上述图中的铁钉最容易生锈的是____ (填序号)。
(2)在铁钉的锈蚀过程中,Fe发生了____ (填“氧化”或“还原”反应)。
(3)铁生锈的外部条件是____ 。
(4)若为了防止铁钉生锈,该同学想在铁钉表面镀上一层金属,该金属最好是____ 。
A.锡 B.铜 C.锌
(5)水是一种宝贵的自然资源。下列做法会造成水污染的是_____ (填序号)。
①生活污水任意排放②海上油轮原油泄漏③水力发电④农药化肥不合理施用
向含Hg2+的废水中加入Na2S以除去Hg2+,该反应的离子方程式为_____ 。

(1)经过较长时间后,甲同学观察到的现象是:上述图中的铁钉最容易生锈的是
(2)在铁钉的锈蚀过程中,Fe发生了
(3)铁生锈的外部条件是
(4)若为了防止铁钉生锈,该同学想在铁钉表面镀上一层金属,该金属最好是
A.锡 B.铜 C.锌
(5)水是一种宝贵的自然资源。下列做法会造成水污染的是
①生活污水任意排放②海上油轮原油泄漏③水力发电④农药化肥不合理施用
向含Hg2+的废水中加入Na2S以除去Hg2+,该反应的离子方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】博物馆修复出土铁器的过程如下:
(1)检测锈蚀产物
铁器在具有O2、_______ 等环境中容易被腐蚀。
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.Fe转化为Fe2+。
Ⅱ.Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为______ 。
Ⅲ..FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是_______ 。
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
_______ Fe3O4+_____ O2+______ H2O=__________ FeO(OH)(将反应补充完整)
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
①检测洗涤液中Cl-的方法是_______ 。
②脱氯反应:FeOCl+OH- =FeO(OH)+Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:S(FeOCl)_______ S[FeO(OH)]。(填“>”、“<”、“=”)
③Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是___________________________ 。
(1)检测锈蚀产物
| 主要成分的化学式 | |||
| Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
铁器在具有O2、
(2)分析腐蚀原理:一般认为,铁经过了如下腐蚀循环。
Ⅰ.Fe转化为Fe2+。
Ⅱ.Fe2+在自然环境中形成FeO(OH),该物质中铁元素的化合价为
Ⅲ..FeO(OH)和Fe2+反应形成致密的Fe3O4保护层,Fe2+的作用是
a.氧化剂 b.还原剂 c.既不是氧化剂也不是还原剂
Ⅳ.Fe3O4保护层被氧化为FeO(OH),如此往复腐蚀。
(3)研究发现,Cl-对铁的腐蚀会造成严重影响。化学修复:脱氯、还原,形成Fe3O4保护层,方法如下:
将铁器浸没在盛有0.5 mol/L Na2SO3、0.5 mol/L NaOH溶液的容器中,缓慢加热至60~90℃。一段时间,取出器物,用NaOH溶液洗涤至无Cl-。
①检测洗涤液中Cl-的方法是
②脱氯反应:FeOCl+OH- =FeO(OH)+Cl-。离子反应的本质是离子浓度的减小,比较FeOCl 与FeO(OH)溶解度的大小:S(FeOCl)
③Na2SO3还原FeO(OH)形成Fe3O4的离子方程式是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】如图所示三套实验装置,分别回答下列问题.
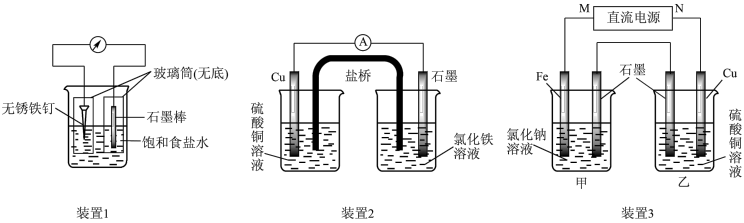
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______ .
(2)装置2中的石墨是______ 极(填“正”或“负”),该装置发生的总反应的离子方程式为______ .
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为______ 极;甲烧杯中铁电极的电极反应为______ .
②乙烧杯中电解反应的离子方程式为______ .
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为______ mL.

(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为
(2)装置2中的石墨是
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为
②乙烧杯中电解反应的离子方程式为
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】电子排布的轨道表示式
(1)电子排布的轨道表示式的定义_______ 。
(2)H、O的基态原子的轨道表示式_______ 。
(3)电子排布的轨道表示式的书写方法_______ 。
(4)概念辨析:简并轨道、单电子、电子对、自旋平行、自旋相反_______ 。
(1)电子排布的轨道表示式的定义
(2)H、O的基态原子的轨道表示式
(3)电子排布的轨道表示式的书写方法
(4)概念辨析:简并轨道、单电子、电子对、自旋平行、自旋相反
您最近一年使用:0次
【推荐2】(1)某元素的原子最外层电子排布为3s23p2,它的次外层上电子云形状有_____ 种,原子中所有电子占有____ 个轨道,核外共有____________ 种运动状态。
(2)用镁粉、碱金属盐及碱土金属盐等可以做成烟火。燃放时,烟火发出五颜六色的光,请用原子结构的知识解释发光的原因:______________________________________ 。
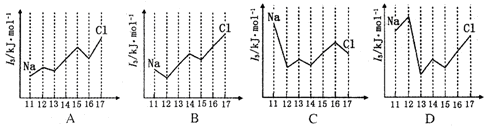
(3)下图中能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是____ 。
(2)用镁粉、碱金属盐及碱土金属盐等可以做成烟火。燃放时,烟火发出五颜六色的光,请用原子结构的知识解释发光的原因:
(3)下图中能正确表示与Si同周期部分元素的第三电离能(I3)与原子序数关系的是
您最近一年使用:0次



